解题方法
1 . 写出下列反应的离子方程式。
(1)往澄清石灰水中通入少量二氧化碳:______ 。
(2) 与
与 溶液反应:
溶液反应:______ 。
(3)小苏打可以用于治疗胃酸过多:______ 。
(4)向 溶液中加入少量
溶液中加入少量 溶液:
溶液:______ 。
(5)常温下, 溶液与
溶液与 溶液反应至溶液
溶液反应至溶液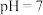 :
:______ 。
(6)高铁酸钠(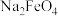 )是水处理过程中的一种新型的绿色多功能净水剂。湿法制备高铁酸钾(
)是水处理过程中的一种新型的绿色多功能净水剂。湿法制备高铁酸钾( )是在碱性环境中进行,反应体系中有六种反应微粒:
)是在碱性环境中进行,反应体系中有六种反应微粒: 、
、 、
、 、
、 、
、 、
、 。请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:
。请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:______
(1)往澄清石灰水中通入少量二氧化碳:
(2)
 与
与 溶液反应:
溶液反应:(3)小苏打可以用于治疗胃酸过多:
(4)向
 溶液中加入少量
溶液中加入少量 溶液:
溶液:(5)常温下,
 溶液与
溶液与 溶液反应至溶液
溶液反应至溶液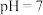 :
:(6)高铁酸钠(
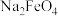 )是水处理过程中的一种新型的绿色多功能净水剂。湿法制备高铁酸钾(
)是水处理过程中的一种新型的绿色多功能净水剂。湿法制备高铁酸钾( )是在碱性环境中进行,反应体系中有六种反应微粒:
)是在碱性环境中进行,反应体系中有六种反应微粒: 、
、 、
、 、
、 、
、 、
、 。请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:
。请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:
您最近半年使用:0次
名校
解题方法
2 . 回答下列问题。
(1)依据物质的性质分析:CaO、Na2O、Fe2O3、CuO均属于______ (填“酸性氧化物”、“碱性氧化物”或“两性氧化物”),下列物质均能与它们发生反应的是______ (填字母)。
a.水 b.盐酸 c.氢氧化钠溶液
(2)木炭与浓硫酸发生反应: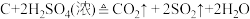 。作还原剂的物质是
。作还原剂的物质是______ ,硫元素的化合价______ (填“升高”或“降低”)。
(3)某反应中反应物与生成物的Fe3+、Mn2+、H+、 、H2O和一种未知离子X
、H2O和一种未知离子X
①已知 在反应中得到电子,则X是
在反应中得到电子,则X是______ 。
②该反应的离子方程式是______ 。
(1)依据物质的性质分析:CaO、Na2O、Fe2O3、CuO均属于
a.水 b.盐酸 c.氢氧化钠溶液
(2)木炭与浓硫酸发生反应:
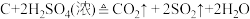 。作还原剂的物质是
。作还原剂的物质是(3)某反应中反应物与生成物的Fe3+、Mn2+、H+、
 、H2O和一种未知离子X
、H2O和一种未知离子X①已知
 在反应中得到电子,则X是
在反应中得到电子,则X是②该反应的离子方程式是
您最近半年使用:0次
解题方法
3 . 高铁酸盐( )被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
)被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
(1)KClO饱和溶液与 饱和溶液反应可制备K2FeO4,反应的离子方程为
饱和溶液反应可制备K2FeO4,反应的离子方程为___________ 。
(2)聚合硫酸铁[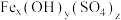 ]的组成可通过下列实验测定:
]的组成可通过下列实验测定:
①称取一定质量的聚合硫酸铁配成100.00 mL溶液A;
②准确量取20.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65 g;
③准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00 mL溶液B;
④准确量取25.00 mL溶液B,用 的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
通过计算确定该聚合硫酸铁的化学式_______ (写出计算过程)。
 )被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
)被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。(1)KClO饱和溶液与
 饱和溶液反应可制备K2FeO4,反应的离子方程为
饱和溶液反应可制备K2FeO4,反应的离子方程为(2)聚合硫酸铁[
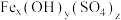 ]的组成可通过下列实验测定:
]的组成可通过下列实验测定:①称取一定质量的聚合硫酸铁配成100.00 mL溶液A;
②准确量取20.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65 g;
③准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00 mL溶液B;
④准确量取25.00 mL溶液B,用
 的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。通过计算确定该聚合硫酸铁的化学式
您最近半年使用:0次
4 . 氧化还原反应对我们的生产和生活同时具有正负两方面的影响,如果我们能够掌握化学变化的规律,就有可能做到趋利避害,使之更好地为社会发展服务。下面我们逐一分析:
(1)黑火药是我国古代的四大发明之一,黑火药着火时,发生如下氧化还原反应: 。在此反应中,还原剂为
。在此反应中,还原剂为_______ (填化学式),还原产物是_______ (填化学式),当该反应转移2.4mol电子时,产生气体的体积为_______ L(标况下)。
(2)湿法制备高铁酸钾 是在碱性环境中进行,反应体系中有六种反应微粒:
是在碱性环境中进行,反应体系中有六种反应微粒: 、
、 、
、 、
、 、
、 、
、 。请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:
。请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:_______ 。
(3)汽车剧烈碰撞时,安全气囊中发生反应: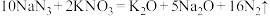 。若反应得到的氧化产物比还原产物多2.8mol,则此过程中转移电子的个数为
。若反应得到的氧化产物比还原产物多2.8mol,则此过程中转移电子的个数为_______ 。
(4)在第一次世界大战期间,德军在比利时的伊普雷战役中使用了氯气制造的毒气弹。现代工业常用氯气制备漂白粉、消毒液等物质。写出制备漂白粉的化学反应方程式_______ 。
(1)黑火药是我国古代的四大发明之一,黑火药着火时,发生如下氧化还原反应:
 。在此反应中,还原剂为
。在此反应中,还原剂为(2)湿法制备高铁酸钾
 是在碱性环境中进行,反应体系中有六种反应微粒:
是在碱性环境中进行,反应体系中有六种反应微粒: 、
、 、
、 、
、 、
、 、
、 。请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:
。请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:(3)汽车剧烈碰撞时,安全气囊中发生反应:
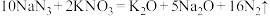 。若反应得到的氧化产物比还原产物多2.8mol,则此过程中转移电子的个数为
。若反应得到的氧化产物比还原产物多2.8mol,则此过程中转移电子的个数为(4)在第一次世界大战期间,德军在比利时的伊普雷战役中使用了氯气制造的毒气弹。现代工业常用氯气制备漂白粉、消毒液等物质。写出制备漂白粉的化学反应方程式
您最近半年使用:0次
5 . 回答下列问题:
(1)①H2+CuO Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH
Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH 2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有
2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有______ (填序号)。
(2)用双线桥法表示下述反应的电子转移的方向和数目______ 。
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(3)在反应KClO3+6HCl=3Cl2+KCl+3H2O中,氧化剂与还原剂的系数之比为______ 。
(4)配平下面两个反应:
____H2O+____Cl2+____SO2=____H2SO4+____HCl,(系数是1的也请填上)______ 。
____KMnO4+____HCl=____KCl+____MnCl2+____Cl2↑+____H2O(系数是1的也请填上)______ 。
根据以上两个反应反应,写出由KMnO4、K2SO4、MnSO4、SO2、H2O、H2SO4这六种物质组成的氧化还原反应的方程式并配平。______ 。
(1)①H2+CuO
 Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH
Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH 2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有
2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有(2)用双线桥法表示下述反应的电子转移的方向和数目
MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。(3)在反应KClO3+6HCl=3Cl2+KCl+3H2O中,氧化剂与还原剂的系数之比为
(4)配平下面两个反应:
____H2O+____Cl2+____SO2=____H2SO4+____HCl,(系数是1的也请填上)
____KMnO4+____HCl=____KCl+____MnCl2+____Cl2↑+____H2O(系数是1的也请填上)
根据以上两个反应反应,写出由KMnO4、K2SO4、MnSO4、SO2、H2O、H2SO4这六种物质组成的氧化还原反应的方程式并配平。
您最近半年使用:0次
2024高三下·全国·专题练习
6 . 烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下检测方法:将v L气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO ,加水稀释至100.00 mL;量取20.00 mL该溶液,加入v1 mL c1 mol·L−1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L−1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗v2 mL。
,加水稀释至100.00 mL;量取20.00 mL该溶液,加入v1 mL c1 mol·L−1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L−1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗v2 mL。
(1)NO被H2O2氧化为NO 的离子方程式是
的离子方程式是___________ 。
(2)滴定操作使用的玻璃仪器主要有___________ 。
(3)滴定过程中发生下列反应:3Fe2++NO +4H+=NO↑+3Fe3++2H2O
+4H+=NO↑+3Fe3++2H2O
Cr2O + 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O,则气样中NOx折合成NO2的含量为
+ 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O,则气样中NOx折合成NO2的含量为___________ mg·m−3.
(4)若FeSO4标准溶液部分变质,会使NOx含量测定结果___________ (填“偏高” 、“偏低”或“无影响 ”)。
 ,加水稀释至100.00 mL;量取20.00 mL该溶液,加入v1 mL c1 mol·L−1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L−1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗v2 mL。
,加水稀释至100.00 mL;量取20.00 mL该溶液,加入v1 mL c1 mol·L−1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L−1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗v2 mL。(1)NO被H2O2氧化为NO
 的离子方程式是
的离子方程式是(2)滴定操作使用的玻璃仪器主要有
(3)滴定过程中发生下列反应:3Fe2++NO
 +4H+=NO↑+3Fe3++2H2O
+4H+=NO↑+3Fe3++2H2OCr2O
 + 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O,则气样中NOx折合成NO2的含量为
+ 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O,则气样中NOx折合成NO2的含量为(4)若FeSO4标准溶液部分变质,会使NOx含量测定结果
您最近半年使用:0次
名校
解题方法
7 . 填写下列空白:
(1)工业上湿法制备高铁酸钾( )的反应体系中有六种微粒:
)的反应体系中有六种微粒: 、
、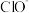 、
、 、
、 、
、 、
、 。写出并配平该反应的离子方程式
。写出并配平该反应的离子方程式___________ ;若反应过程中转移了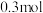 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为___________  。
。
(2)一定条件下,下列物质可以通过化合反应制得的有(写序号)___________ 。
①小苏打 ②硫酸铝 ③氯化亚铁 ④磁性氧化铁 ⑤铜绿(碱式碳酸铜) ⑥氢氧化铁
(3)向一定量的 的混合物中加入
的混合物中加入 的盐酸,恰好使混合物完全溶解,放出
的盐酸,恰好使混合物完全溶解,放出 (标准状况)的气体,在所得溶液中加入
(标准状况)的气体,在所得溶液中加入 溶液无血红色出现。若用足量的
溶液无血红色出现。若用足量的 在高温下还原相同质量的此混合物,能得到铁的质量是
在高温下还原相同质量的此混合物,能得到铁的质量是___________ g。
(4)将 铁粉与含有
铁粉与含有 的
的 溶液完全反应,铁粉全部溶解,并得到
溶液完全反应,铁粉全部溶解,并得到 铜,则参加反应的
铜,则参加反应的 与
与 的物质的量之比为
的物质的量之比为___________ 。
(5)等质量的铝分别与 浓度均为
浓度均为 的盐酸和氢氧化钠溶液反应,生成气体体积比为
的盐酸和氢氧化钠溶液反应,生成气体体积比为 ,铝与氢氧化钠溶液反应的离子方程式:
,铝与氢氧化钠溶液反应的离子方程式:___________ ;铝的质量为___________ g。
(6)将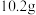 镁铝合金置于
镁铝合金置于 的盐酸中充分反应,无金属剩余,向反应后的溶液中加入
的盐酸中充分反应,无金属剩余,向反应后的溶液中加入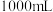 烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为
烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为___________  。
。
(1)工业上湿法制备高铁酸钾(
 )的反应体系中有六种微粒:
)的反应体系中有六种微粒: 、
、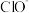 、
、 、
、 、
、 、
、 。写出并配平该反应的离子方程式
。写出并配平该反应的离子方程式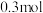 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为 。
。(2)一定条件下,下列物质可以通过化合反应制得的有(写序号)
①小苏打 ②硫酸铝 ③氯化亚铁 ④磁性氧化铁 ⑤铜绿(碱式碳酸铜) ⑥氢氧化铁
(3)向一定量的
 的混合物中加入
的混合物中加入 的盐酸,恰好使混合物完全溶解,放出
的盐酸,恰好使混合物完全溶解,放出 (标准状况)的气体,在所得溶液中加入
(标准状况)的气体,在所得溶液中加入 溶液无血红色出现。若用足量的
溶液无血红色出现。若用足量的 在高温下还原相同质量的此混合物,能得到铁的质量是
在高温下还原相同质量的此混合物,能得到铁的质量是(4)将
 铁粉与含有
铁粉与含有 的
的 溶液完全反应,铁粉全部溶解,并得到
溶液完全反应,铁粉全部溶解,并得到 铜,则参加反应的
铜,则参加反应的 与
与 的物质的量之比为
的物质的量之比为(5)等质量的铝分别与
 浓度均为
浓度均为 的盐酸和氢氧化钠溶液反应,生成气体体积比为
的盐酸和氢氧化钠溶液反应,生成气体体积比为 ,铝与氢氧化钠溶液反应的离子方程式:
,铝与氢氧化钠溶液反应的离子方程式:(6)将
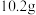 镁铝合金置于
镁铝合金置于 的盐酸中充分反应,无金属剩余,向反应后的溶液中加入
的盐酸中充分反应,无金属剩余,向反应后的溶液中加入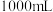 烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为
烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为 。
。
您最近半年使用:0次
8 . 分类法是进行化学研究的重要方法。不同的标准可以把物质和反应分为不同的类别。回答下列问题:
(1)现有九种物质:①铜;②小苏打;③硫酸铁;④二氧化碳;⑤葡萄糖;⑥熔融氯化钠;⑦氢氧化铁胶体;⑧浓硫酸;⑨液氨;上述物质中,属于能导电的纯净物是___________ (填序号);属于非电解质的是___________ (填序号);③在水中的电离方程式为___________ 。
(2)下列物质属于如图所示化学概念交叉部分(阴影部分)的是___________ (填标号)。

A. B.HCl C.
B.HCl C. (乙醇) D.NaCl E.Hg
(乙醇) D.NaCl E.Hg
(3)氧化还原反应是一类重要化学反应,在生产生活中有重要应用。
①工业上,用 溶液“腐蚀”覆铜板制作印刷电路板,写出对应的离子方程式
溶液“腐蚀”覆铜板制作印刷电路板,写出对应的离子方程式___________ 。
②完善下面的化学方程式,并配平___________ 。

③利用盐酸酸化淀粉的KI溶液检验食盐中的碘元素( )。写出发生反应的离子方程式
)。写出发生反应的离子方程式___________ 。
(4)在20.00ml 溶液中加入0.195g锌粉,恰好完全反应,则还原产物可能是___________
溶液中加入0.195g锌粉,恰好完全反应,则还原产物可能是___________
(1)现有九种物质:①铜;②小苏打;③硫酸铁;④二氧化碳;⑤葡萄糖;⑥熔融氯化钠;⑦氢氧化铁胶体;⑧浓硫酸;⑨液氨;上述物质中,属于能导电的纯净物是
(2)下列物质属于如图所示化学概念交叉部分(阴影部分)的是

A.
 B.HCl C.
B.HCl C. (乙醇) D.NaCl E.Hg
(乙醇) D.NaCl E.Hg(3)氧化还原反应是一类重要化学反应,在生产生活中有重要应用。
①工业上,用
 溶液“腐蚀”覆铜板制作印刷电路板,写出对应的离子方程式
溶液“腐蚀”覆铜板制作印刷电路板,写出对应的离子方程式②完善下面的化学方程式,并配平

③利用盐酸酸化淀粉的KI溶液检验食盐中的碘元素(
 )。写出发生反应的离子方程式
)。写出发生反应的离子方程式(4)在20.00ml
 溶液中加入0.195g锌粉,恰好完全反应,则还原产物可能是___________
溶液中加入0.195g锌粉,恰好完全反应,则还原产物可能是___________A. | B.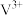 | C. | D.V |
您最近半年使用:0次
名校
9 . 完成下列小题
(1)储氢纳米碳管的成功研制体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种。
①请用上述物质填空,并配平化学方程式:_____ 。
_____C+_____+_____H2SO4=_____K2SO4+_____+_____Cr2(SO4)3+_____H2O
②若上述反应中转移0.8mol电子则产生的气体在标准状况下的体积为_____ 。
(2)有相同质量的两份NaHCO3粉末,第一份加入足量盐酸,第二份先加热使其完全分解后再加同质量分数的盐酸,则二者所消耗的盐酸中HCl的质量比为_____ 。
(3)1L1.0mol/L的NaOH溶液吸收0.8molCO2,所得溶液中 和
和 的物质的量浓度之比为
的物质的量浓度之比为_____ 。
(4)某含碘废液中,碘元素以 形式存在,为测定
形式存在,为测定 的浓度,现进行如下实验:准确量取20mL废液,加水稀释配成100.00mL溶液,取20.00mL溶液,加入盐酸,加入足量KI晶体,以淀粉为指示剂,用0.1000mol/LNa2S2O3溶液滴定I2至恰好完全反应,消耗Na2S2O3溶液24.0mL。已知测定过程中发生的反应为
的浓度,现进行如下实验:准确量取20mL废液,加水稀释配成100.00mL溶液,取20.00mL溶液,加入盐酸,加入足量KI晶体,以淀粉为指示剂,用0.1000mol/LNa2S2O3溶液滴定I2至恰好完全反应,消耗Na2S2O3溶液24.0mL。已知测定过程中发生的反应为 +I-+H+=I2+H2O(未配平),I2+2
+I-+H+=I2+H2O(未配平),I2+2 =2I-+
=2I-+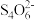 。计算废液中
。计算废液中 的物质的量浓度,并写出计算过程
的物质的量浓度,并写出计算过程_____ 。
(1)储氢纳米碳管的成功研制体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种。
①请用上述物质填空,并配平化学方程式:
_____C+_____+_____H2SO4=_____K2SO4+_____+_____Cr2(SO4)3+_____H2O
②若上述反应中转移0.8mol电子则产生的气体在标准状况下的体积为
(2)有相同质量的两份NaHCO3粉末,第一份加入足量盐酸,第二份先加热使其完全分解后再加同质量分数的盐酸,则二者所消耗的盐酸中HCl的质量比为
(3)1L1.0mol/L的NaOH溶液吸收0.8molCO2,所得溶液中
 和
和 的物质的量浓度之比为
的物质的量浓度之比为(4)某含碘废液中,碘元素以
 形式存在,为测定
形式存在,为测定 的浓度,现进行如下实验:准确量取20mL废液,加水稀释配成100.00mL溶液,取20.00mL溶液,加入盐酸,加入足量KI晶体,以淀粉为指示剂,用0.1000mol/LNa2S2O3溶液滴定I2至恰好完全反应,消耗Na2S2O3溶液24.0mL。已知测定过程中发生的反应为
的浓度,现进行如下实验:准确量取20mL废液,加水稀释配成100.00mL溶液,取20.00mL溶液,加入盐酸,加入足量KI晶体,以淀粉为指示剂,用0.1000mol/LNa2S2O3溶液滴定I2至恰好完全反应,消耗Na2S2O3溶液24.0mL。已知测定过程中发生的反应为 +I-+H+=I2+H2O(未配平),I2+2
+I-+H+=I2+H2O(未配平),I2+2 =2I-+
=2I-+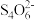 。计算废液中
。计算废液中 的物质的量浓度,并写出计算过程
的物质的量浓度,并写出计算过程
您最近半年使用:0次
10 . 饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 ,其化学方程式为:
,其化学方程式为: 。请回答下列问题:
。请回答下列问题:
(1)上述反应中,被氧化的元素是___________ ,还原产物是___________ 。
(2)用“双线桥法”表示反应中电子转移的方向和数目:___________ 。

(3)反应中每生成1个 ,转移
,转移___________ 个电子。
(4)请配平下列离子方程式:___________ 。
___________ ___________
___________ ___________
___________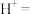 ___________
___________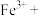 ___________
___________
(5)已知 、
、 、
、 、
、 、
、 均有还原性,它们在酸性溶液中还原性的强弱顺序为:
均有还原性,它们在酸性溶液中还原性的强弱顺序为: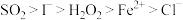 ,则下列反应不能发生的是:___________。
,则下列反应不能发生的是:___________。
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 ,其化学方程式为:
,其化学方程式为: 。请回答下列问题:
。请回答下列问题:(1)上述反应中,被氧化的元素是
(2)用“双线桥法”表示反应中电子转移的方向和数目:

(3)反应中每生成1个
 ,转移
,转移(4)请配平下列离子方程式:
___________
 ___________
___________ ___________
___________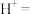 ___________
___________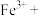 ___________
___________
(5)已知
 、
、 、
、 、
、 、
、 均有还原性,它们在酸性溶液中还原性的强弱顺序为:
均有还原性,它们在酸性溶液中还原性的强弱顺序为: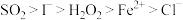 ,则下列反应不能发生的是:___________。
,则下列反应不能发生的是:___________。A.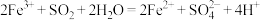 |
B. |
C.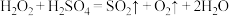 |
D. |
您最近半年使用:0次



