1 . 汽车发生强烈碰撞时,安全气囊内的NaN3发生化学反应生成Na3N和N2所产生的N2快速充满气囊,可以达到保护车内人员的目的。
(1)写出上述反应的化学方程式:___________ ,它的基本反应类型属于___________ 。
(2)若安全气囊内含有97.5gNaN3,则其物质的量为___________ 。
(3)若97.5gNaN3完全分解,在标准状况下,气囊膨胀的体积约为___________ 。
(1)写出上述反应的化学方程式:
(2)若安全气囊内含有97.5gNaN3,则其物质的量为
(3)若97.5gNaN3完全分解,在标准状况下,气囊膨胀的体积约为
您最近半年使用:0次
2 . 近来,《饮用天然矿泉水》新标准引起热议,其中备受争议的溴酸盐是一种致癌物,新标准中溴酸盐极值为0.01mg/L。已知在酸性条件下有以下反应:
①2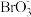 +I2===2
+I2===2 +Br2
+Br2
②2 +10Br-+12H+===I2+5Br2+6H2O
+10Br-+12H+===I2+5Br2+6H2O
③5Br-+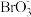 +6H+===3Br2+3H2O
+6H+===3Br2+3H2O
请回答下列问题:
(1)有同学根据反应①得出氧化性:I2>Br2的结论,请说明该结论错误的理由是:_________ 。
(2)反应②中: →l2发生的是
→l2发生的是__________ 反应(氧化、还原)。
现向含6mol的KI的硫酸溶液中逐滴滴加KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量有如图的关系:
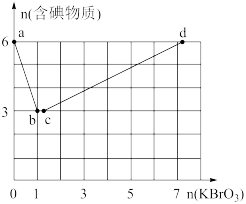
(3)完成a→b阶段的反应方程式,并标出电子转移的方向和数目:I-+BrO3-+H+→ ,________ 。
(4)b→c阶段只有一种元素化合价发生了改变,反应中氧化产物和还原产物的物质的量之比为______ 。
(5)a→b、b→c、c→d阶段的还原剂分别是______ 、_______ 、______ ,依次发生的这些反应,说明有关物质(l2、Br2、I-、Br-)还原性由强到弱的顺序是________ 。
①2
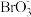 +I2===2
+I2===2 +Br2
+Br2②2
 +10Br-+12H+===I2+5Br2+6H2O
+10Br-+12H+===I2+5Br2+6H2O③5Br-+
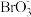 +6H+===3Br2+3H2O
+6H+===3Br2+3H2O请回答下列问题:
(1)有同学根据反应①得出氧化性:I2>Br2的结论,请说明该结论错误的理由是:
(2)反应②中:
 →l2发生的是
→l2发生的是现向含6mol的KI的硫酸溶液中逐滴滴加KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量有如图的关系:

(3)完成a→b阶段的反应方程式,并标出电子转移的方向和数目:I-+BrO3-+H+→ ,
(4)b→c阶段只有一种元素化合价发生了改变,反应中氧化产物和还原产物的物质的量之比为
(5)a→b、b→c、c→d阶段的还原剂分别是
您最近半年使用:0次
2010·上海松江·二模
解题方法
3 . 某工业尾气中含有NO和NO2(通常表示为NOx),处理尾气常用以下方法。
方法一:氨气还原法:NH3+NOx→N2+H2O(未配平),
方法二:用碱液吸收:2NO2+2NaOH→NaNO2+NaNO3+H2O;NO+NO2+2NaOH→2NaNO2+H2O。
(1)另写一个氨气作还原剂的化学方程式:__ ;
(2)方法二中若使NOx完全被吸收。则n(NO2)__ n(NO)(填“≤”、“=”、“≥”);NOx中 =
=__ (用含“x”的代数式表示);
(3)若用方法一消除NOx,当x=1.75时,则应通入的氨气与NOx的体积比(同温同压下) ≥
≥__ ;
(4)若气体中除含NOx(NO和NO2)外,还含有体积分数为y的N2O4,用方法二处理1mol这种气体,气体完全被吸收。计算:
①若y=0.2,求生成NaNO3和NaNO2的质量___ ;
②满足气体完全被吸收的y和x的关系式___ 。
方法一:氨气还原法:NH3+NOx→N2+H2O(未配平),
方法二:用碱液吸收:2NO2+2NaOH→NaNO2+NaNO3+H2O;NO+NO2+2NaOH→2NaNO2+H2O。
(1)另写一个氨气作还原剂的化学方程式:
(2)方法二中若使NOx完全被吸收。则n(NO2)
 =
=(3)若用方法一消除NOx,当x=1.75时,则应通入的氨气与NOx的体积比(同温同压下)
 ≥
≥(4)若气体中除含NOx(NO和NO2)外,还含有体积分数为y的N2O4,用方法二处理1mol这种气体,气体完全被吸收。计算:
①若y=0.2,求生成NaNO3和NaNO2的质量
②满足气体完全被吸收的y和x的关系式
您最近半年使用:0次
2010·上海·零模
解题方法
4 . 氧化还原反应中实际上包含氧化和还原两个过程。下面是一个发生还原过程的反应式:NO3ˉ+4H++3e→ NO+ 2H2O在下列四种物质KMnO4、Na2CO3、KI、Fe2(SO4)3中的一种物质(甲)中滴加少量稀硝酸能使上述还原过程发生。
(1)写出并配平该氧化还原反应的化学方程式,标出电子转移的方向和数目______
(2)上述反应中_________ 被还原,还原剂是_____________________ 。
(3)反应生成0.3mol H2O,则转移电子的数目为____________ 个。
(4)若反应后还生成KIO3,且其它物质保持不变,则反应中氧化剂与还原剂的物质的量之比将_____________ (填“增大”、“减小”、“不变”或“不能确定”)。
(1)写出并配平该氧化还原反应的化学方程式,标出电子转移的方向和数目
(2)上述反应中
(3)反应生成0.3mol H2O,则转移电子的数目为
(4)若反应后还生成KIO3,且其它物质保持不变,则反应中氧化剂与还原剂的物质的量之比将
您最近半年使用:0次
2011·上海虹口·一模
5 . 现向含6molKI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。请回答下列问题:

(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为__ ,还原产物是__ 。
(2)已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式__ 。
(3)①已知反应:2BrO3-+I2=2IO3-+Br2;有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由:__ 。
②n(KBrO3)=4时,对应含碘物质的化学式为__ 。
(4)含amolKI的硫酸溶液所能消耗n(KBrO3)的最大值为__ 。

(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为
(2)已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式
(3)①已知反应:2BrO3-+I2=2IO3-+Br2;有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由:
②n(KBrO3)=4时,对应含碘物质的化学式为
(4)含amolKI的硫酸溶液所能消耗n(KBrO3)的最大值为
您最近半年使用:0次
2014·上海杨浦·三模
6 . 氯、磷的化合物广泛用于农药、医药、染料等领域。
(1)PCl3与氯气、水反应,得到HCl气体和一种无色透明有刺激性臭味的液体X,实验测定,1mol的H2O完全反应会生成2mol的HCl,则X的组成元素是___ ;已知X的相对分子质量为153.5,则X的化学式为___ 。
(2)X在高温与O2发生反应,形成P4O10(固态)和Cl2。将3.07gX与448mLO2(已折算至标准状况,下同)在高温下充分反应后,生成Cl2___ mol,气体的体积将变为___ mL。
(3)白磷在氯气中燃烧,一般得到PCl3和PCl5的混合物。2.480g白磷(P4),与一定量的氯气恰好完全反应,产物的总质量为14.550g,计算产物中PCl3的质量分数___ (保留4位有效数字)。
(4)PCl3和PCl5能发生如下水解反应:PCl3+3H2O→H3PO3+3HCl;PCl5+4H2O→H3PO4+5HCl
现将一定量的PCl3和PCl5混合物溶于足量水中,在加热条件下缓缓通入0.020molO2,恰好将H3PO3氧化为H3PO4。往反应后的溶液中加入15.725gCa(OH)2,充分反应后磷元素全部转化为Ca3(PO4)2沉淀,过滤后得到2.5L滤液,测得pH为12。计算:
①Ca3(PO4)2(已知式量310)沉淀的质量___ ;
②滤液中溶质的物质的量浓度___ 。
(1)PCl3与氯气、水反应,得到HCl气体和一种无色透明有刺激性臭味的液体X,实验测定,1mol的H2O完全反应会生成2mol的HCl,则X的组成元素是
(2)X在高温与O2发生反应,形成P4O10(固态)和Cl2。将3.07gX与448mLO2(已折算至标准状况,下同)在高温下充分反应后,生成Cl2
(3)白磷在氯气中燃烧,一般得到PCl3和PCl5的混合物。2.480g白磷(P4),与一定量的氯气恰好完全反应,产物的总质量为14.550g,计算产物中PCl3的质量分数
(4)PCl3和PCl5能发生如下水解反应:PCl3+3H2O→H3PO3+3HCl;PCl5+4H2O→H3PO4+5HCl
现将一定量的PCl3和PCl5混合物溶于足量水中,在加热条件下缓缓通入0.020molO2,恰好将H3PO3氧化为H3PO4。往反应后的溶液中加入15.725gCa(OH)2,充分反应后磷元素全部转化为Ca3(PO4)2沉淀,过滤后得到2.5L滤液,测得pH为12。计算:
①Ca3(PO4)2(已知式量310)沉淀的质量
②滤液中溶质的物质的量浓度
您最近半年使用:0次
7 . 关于离子反应:M2O7x-+3S2﹣+14H+=2M3++3S↓+7H2O其中x值和M2O7x-离子中M化合价分别是______ 和______ .
您最近半年使用:0次
8 . 钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠___ g。
(2)钠-钾合金可在核反应堆中用作热交换液。5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气。
①计算溶液中氢氧根离子的物质的量浓度________ (忽略溶液体积变化)。
②计算并确定该钠-钾合金的化学式________ 。
(3)氢氧化钠溶液处理铝土矿井过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:2NaAl(OH)4+CO2→2Al(OH)3↓ +Na2CO3+H2O。已知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比________ 。
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,给出结论________ 。
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠
(2)钠-钾合金可在核反应堆中用作热交换液。5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气。
①计算溶液中氢氧根离子的物质的量浓度
②计算并确定该钠-钾合金的化学式
(3)氢氧化钠溶液处理铝土矿井过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:2NaAl(OH)4+CO2→2Al(OH)3↓ +Na2CO3+H2O。已知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,给出结论
您最近半年使用:0次
9 . 硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应方程式如下:Na2SO4+4C →Na2S+ 4CO,Na2SO4+4CO→Na2S+4CO2
(1)现有无水芒硝17.75g,若生成过程中无水芒硝的利用率为80%,则理论上可得到Na2S_____ g,最多生成标况下的CO_____ L。
(2)若在反应过程中生成的Na2S3mol,则消耗的碳单质的物质的量 n的范围是____ mol≤n≤___ mol,若生成等物质的量CO和CO2,则消耗的碳的物质的量为____ mol。
(3)Na2S放置在空气中,会被缓慢氧化成Na2SO4及 Na2SO3,现称取已经部分氧化的硫化钠样品78.40g溶于水中,加入足量盐酸,充分反应后过滤得沉淀19.20g,放出H2S气体2.24L(标准状况)。请计算:78.40g样品中各氧化产物的物质的量(写出必要的计算过程)。_____
(1)现有无水芒硝17.75g,若生成过程中无水芒硝的利用率为80%,则理论上可得到Na2S
(2)若在反应过程中生成的Na2S3mol,则消耗的碳单质的物质的量 n的范围是
(3)Na2S放置在空气中,会被缓慢氧化成Na2SO4及 Na2SO3,现称取已经部分氧化的硫化钠样品78.40g溶于水中,加入足量盐酸,充分反应后过滤得沉淀19.20g,放出H2S气体2.24L(标准状况)。请计算:78.40g样品中各氧化产物的物质的量(写出必要的计算过程)。
您最近半年使用:0次
名校
10 . 酸性条件下, 与
与 按物质的量
按物质的量 恰好完全反应,生成的产物能使淀粉溶液变蓝,请完成下列离子方程式的填空与配平。
恰好完全反应,生成的产物能使淀粉溶液变蓝,请完成下列离子方程式的填空与配平。
( ) H++( ) NO2-+( ) I-→( ) +( ) +( ) H2O
根据上述离子方程式,1摩尔 参与反应则转移的电子数目是
参与反应则转移的电子数目是______ ,反应中被还原的元素是______ 。
 与
与 按物质的量
按物质的量 恰好完全反应,生成的产物能使淀粉溶液变蓝,请完成下列离子方程式的填空与配平。
恰好完全反应,生成的产物能使淀粉溶液变蓝,请完成下列离子方程式的填空与配平。根据上述离子方程式,1摩尔
 参与反应则转移的电子数目是
参与反应则转移的电子数目是
您最近半年使用:0次



