1 . 汽车发生强烈碰撞时,安全气囊内的NaN3发生化学反应生成Na3N和N2所产生的N2快速充满气囊,可以达到保护车内人员的目的。
(1)写出上述反应的化学方程式:___________ ,它的基本反应类型属于___________ 。
(2)若安全气囊内含有97.5gNaN3,则其物质的量为___________ 。
(3)若97.5gNaN3完全分解,在标准状况下,气囊膨胀的体积约为___________ 。
(1)写出上述反应的化学方程式:
(2)若安全气囊内含有97.5gNaN3,则其物质的量为
(3)若97.5gNaN3完全分解,在标准状况下,气囊膨胀的体积约为
您最近一年使用:0次
2 . 近来,《饮用天然矿泉水》新标准引起热议,其中备受争议的溴酸盐是一种致癌物,新标准中溴酸盐极值为0.01mg/L。已知在酸性条件下有以下反应:
①2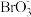 +I2===2
+I2===2 +Br2
+Br2
②2 +10Br-+12H+===I2+5Br2+6H2O
+10Br-+12H+===I2+5Br2+6H2O
③5Br-+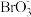 +6H+===3Br2+3H2O
+6H+===3Br2+3H2O
请回答下列问题:
(1)有同学根据反应①得出氧化性:I2>Br2的结论,请说明该结论错误的理由是:_________ 。
(2)反应②中: →l2发生的是
→l2发生的是__________ 反应(氧化、还原)。
现向含6mol的KI的硫酸溶液中逐滴滴加KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量有如图的关系:
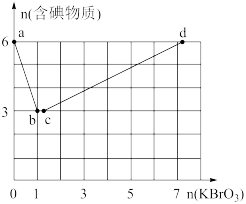
(3)完成a→b阶段的反应方程式,并标出电子转移的方向和数目:I-+BrO3-+H+→ ,________ 。
(4)b→c阶段只有一种元素化合价发生了改变,反应中氧化产物和还原产物的物质的量之比为______ 。
(5)a→b、b→c、c→d阶段的还原剂分别是______ 、_______ 、______ ,依次发生的这些反应,说明有关物质(l2、Br2、I-、Br-)还原性由强到弱的顺序是________ 。
①2
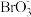 +I2===2
+I2===2 +Br2
+Br2②2
 +10Br-+12H+===I2+5Br2+6H2O
+10Br-+12H+===I2+5Br2+6H2O③5Br-+
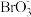 +6H+===3Br2+3H2O
+6H+===3Br2+3H2O请回答下列问题:
(1)有同学根据反应①得出氧化性:I2>Br2的结论,请说明该结论错误的理由是:
(2)反应②中:
 →l2发生的是
→l2发生的是现向含6mol的KI的硫酸溶液中逐滴滴加KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量有如图的关系:

(3)完成a→b阶段的反应方程式,并标出电子转移的方向和数目:I-+BrO3-+H+→ ,
(4)b→c阶段只有一种元素化合价发生了改变,反应中氧化产物和还原产物的物质的量之比为
(5)a→b、b→c、c→d阶段的还原剂分别是
您最近一年使用:0次
2011·上海虹口·一模
3 . 现向含6molKI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。请回答下列问题:

(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为__ ,还原产物是__ 。
(2)已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式__ 。
(3)①已知反应:2BrO3-+I2=2IO3-+Br2;有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由:__ 。
②n(KBrO3)=4时,对应含碘物质的化学式为__ 。
(4)含amolKI的硫酸溶液所能消耗n(KBrO3)的最大值为__ 。

(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为
(2)已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式
(3)①已知反应:2BrO3-+I2=2IO3-+Br2;有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由:
②n(KBrO3)=4时,对应含碘物质的化学式为
(4)含amolKI的硫酸溶液所能消耗n(KBrO3)的最大值为
您最近一年使用:0次
名校
4 . 氯化铁和摩尔盐是铁的两种重要盐类,在净水和定量分析等方面具有重要作用。
(1) 用FeCl3溶液腐蚀印刷电路板上的铜,向所得溶液中加入铁粉,对加入铁粉充分反应后的溶液分析合理的是____________ 。
a. 若无固体剩余,则溶液中一定有Fe3+ b. 若有固体存在,则溶液中一定有Fe2+
c. 若溶液中有Cu2+,则一定没有固体析出 d. 若溶液中有Fe2+,则一定有Cu析出
(2)工业上通过氧化酸性FeCl2废液得到含FeCl3的溶液。若酸性FeCl2废液中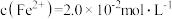 ,
,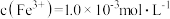 ,
,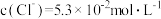 ,则该溶液的
,则该溶液的 约为
约为______ (不考虑水的电离和离子的水解)。
(3)摩尔盐 [(NH4)2Fe(SO4)2•6H2O]在定量分析中常作为基准物质,用来标定重铬酸钾、高锰酸钾等溶液的浓度,在 的该盐的溶液中,离子浓度由大到小的顺序是
的该盐的溶液中,离子浓度由大到小的顺序是____________ 。
(4)摩尔盐与酸性高锰酸钾发生反应: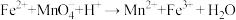
a.配平上述离子方程式:( ) Fe2++( ) MnO4-+( ) H+→( ) Mn2++( ) Fe3++( ) H2O
b.已知摩尔盐相对分子质量为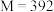 ,取摩尔盐产品
,取摩尔盐产品 (杂质不与高锰酸钾反应),配成
(杂质不与高锰酸钾反应),配成 溶液,取出
溶液,取出 用
用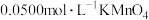 溶液滴定,消耗
溶液滴定,消耗 溶液
溶液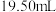 ,则产品中摩尔盐的质量分数为
,则产品中摩尔盐的质量分数为____________ (用小数表示,保留四位小数)。
(1) 用FeCl3溶液腐蚀印刷电路板上的铜,向所得溶液中加入铁粉,对加入铁粉充分反应后的溶液分析合理的是
a. 若无固体剩余,则溶液中一定有Fe3+ b. 若有固体存在,则溶液中一定有Fe2+
c. 若溶液中有Cu2+,则一定没有固体析出 d. 若溶液中有Fe2+,则一定有Cu析出
(2)工业上通过氧化酸性FeCl2废液得到含FeCl3的溶液。若酸性FeCl2废液中
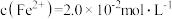 ,
,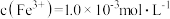 ,
,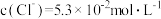 ,则该溶液的
,则该溶液的 约为
约为(3)摩尔盐 [(NH4)2Fe(SO4)2•6H2O]在定量分析中常作为基准物质,用来标定重铬酸钾、高锰酸钾等溶液的浓度,在
 的该盐的溶液中,离子浓度由大到小的顺序是
的该盐的溶液中,离子浓度由大到小的顺序是(4)摩尔盐与酸性高锰酸钾发生反应:
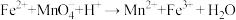
a.配平上述离子方程式:
b.已知摩尔盐相对分子质量为
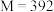 ,取摩尔盐产品
,取摩尔盐产品 (杂质不与高锰酸钾反应),配成
(杂质不与高锰酸钾反应),配成 溶液,取出
溶液,取出 用
用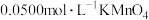 溶液滴定,消耗
溶液滴定,消耗 溶液
溶液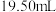 ,则产品中摩尔盐的质量分数为
,则产品中摩尔盐的质量分数为
您最近一年使用:0次
名校
5 . (1)在标准状况下,体积为11.2L 的SO2所含O原子数为__________ 。
(2)9g水与_________ g硫酸所含的分子数相等,它们所含氧原子数之比是__________ 。
(3)在2H2S+SO2===2H2O+3S反应中氧化产物与还原产物的物质的量之比为__________ 。
(4)氯气有毒,实验室常用NaOH溶液吸收多余的氯气,反应的离子方程式为
______________________________ ;将少量 的CO2通入次氯酸钙溶液中发生反应的离子方程式为__________________________________________________________________________ ;
(5) 配平下列化学方程式___ NH3 + ___ O2 === ___ NO + ___ H2O
(6) 请在下列化学方程式上用双线桥法标出电子转移的方向和数目 8NH3 + 3Cl2 === 6NH4Cl + N2__________________________________ 。
(2)9g水与
(3)在2H2S+SO2===2H2O+3S反应中氧化产物与还原产物的物质的量之比为
(4)氯气有毒,实验室常用NaOH溶液吸收多余的氯气,反应的离子方程式为
(5) 配平下列化学方程式
(6) 请在下列化学方程式上用双线桥法标出电子转移的方向和数目 8NH3 + 3Cl2 === 6NH4Cl + N2
您最近一年使用:0次
2018-12-07更新
|
260次组卷
|
2卷引用:沪科版高中化学拓展课程第4章《离子互换反应和氧化还原反应》检测题1
2014·上海金山·一模
6 . 二氧化硫和氮氧化物(NOx)是大气的主要污染物,治理环境污染是当前环保工作的重要研究内容之一。
完成下列计算:
(1)石灰石-石膏湿法烟气脱硫工艺技术的原理是:烟气中的二氧化硫与浆液中的碳酸钙以及空气反应生成石膏(CaSO4·2H2O)。某电厂用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,用该方法脱硫时有96%的硫转化为石膏,则理论上可得到_________ 吨石膏。
(2)用CH4催化还原NOx,主要产物为N2与CO2。现有1 L NOx(含NO2、NO),用CH4将其还原成N2,消耗同温同压下的CH40.4 L,则混合气体中NO2、NO的物质量之比为____ 。
(3)乙二酸(H2C2O4)的制备有如下反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
上述反应产生的NOx用氧气和水吸收后生成硝酸循环利用,若尾气NOx中n(NO2)︰n(NO)=2︰1,且NOx的吸收转化率为90%。每生产9 kg乙二酸至少需要补充质量分数为63%的硝酸溶液多少千克?____
(4)用碱液吸收法处理某工业尾气(含NOx:NO、NO2和N2O4)的反应为:
2NO2+ 2NaOH→ NaNO2+ NaNO3 + H2O;
NO + NO2+ 2NaOH→ 2NaNO2+ H2O。
当N2O4体积分数为0.2时,处理1mol该NOx,计算生成NaNO3和NaNO2的物质的量(x可作为已知条件使用)。____
完成下列计算:
(1)石灰石-石膏湿法烟气脱硫工艺技术的原理是:烟气中的二氧化硫与浆液中的碳酸钙以及空气反应生成石膏(CaSO4·2H2O)。某电厂用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,用该方法脱硫时有96%的硫转化为石膏,则理论上可得到
(2)用CH4催化还原NOx,主要产物为N2与CO2。现有1 L NOx(含NO2、NO),用CH4将其还原成N2,消耗同温同压下的CH40.4 L,则混合气体中NO2、NO的物质量之比为
(3)乙二酸(H2C2O4)的制备有如下反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
上述反应产生的NOx用氧气和水吸收后生成硝酸循环利用,若尾气NOx中n(NO2)︰n(NO)=2︰1,且NOx的吸收转化率为90%。每生产9 kg乙二酸至少需要补充质量分数为63%的硝酸溶液多少千克?
(4)用碱液吸收法处理某工业尾气(含NOx:NO、NO2和N2O4)的反应为:
2NO2+ 2NaOH→ NaNO2+ NaNO3 + H2O;
NO + NO2+ 2NaOH→ 2NaNO2+ H2O。
当N2O4体积分数为0.2时,处理1mol该NOx,计算生成NaNO3和NaNO2的物质的量(x可作为已知条件使用)。
您最近一年使用:0次
11-12高二上·上海·期中
7 . 将10g铁粉置于40mL较浓的硝酸中,微热完全反应时,收集到NO2和NO混合气体1792mL(标准状况下),还残留4.4g固体。求:
(1)该反应中被还原的硝酸和未被还原的硝酸的物质的量之比_______ ;
(2)原硝酸的物质的量浓度_______ ;
(3)NO和NO2的体积比_______ ;
(4)写出总的化学方程式_______ 。
(1)该反应中被还原的硝酸和未被还原的硝酸的物质的量之比
(2)原硝酸的物质的量浓度
(3)NO和NO2的体积比
(4)写出总的化学方程式
您最近一年使用:0次
2011·上海嘉定·一模
8 . (1)配平反应的离子方程式:_____ XeO3+____ Mn2++_____ H2O →____ MnO4-+____ Xe↑+___ H+
(2)反应现象为:①有气泡产生,②______________________ 。
(3)发生氧化反应的物质(或微粒)是_______________ 。
(4)将适量的XeO3投入30mL 0.1mol⋅L−1 Mn2+的水溶液中,刚好完全反应。
①此时转移电子_____________ mol。
②将反应后的溶液稀释至90mL,所得溶液的pH=________ 。
(2)反应现象为:①有气泡产生,②
(3)发生氧化反应的物质(或微粒)是
(4)将适量的XeO3投入30mL 0.1mol⋅L−1 Mn2+的水溶液中,刚好完全反应。
①此时转移电子
②将反应后的溶液稀释至90mL,所得溶液的pH=
您最近一年使用:0次
真题
名校
9 . 氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e→NO+2H2O ;KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:_______________________________
(2)反应中硝酸体现了_________ 、_________ 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是________ mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:___________________________________ 。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了
(3)反应中若产生0.2mol气体,则转移电子的物质的量是
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
您最近一年使用:0次
2009-11-16更新
|
1896次组卷
|
10卷引用:2007年普通高等学校招生全国统一考试(上海卷)化学试题
2007年普通高等学校招生全国统一考试(上海卷)化学试题沪科版化学拓展性课程4《离子互换反应和氧化还原反应》测试题(已下线)2012届北京四中高三上学期期中测试化学试卷(已下线)2012-2013学年辽宁省丹东市宽甸二中高二4月月考(一)化学试卷(已下线)2014高考化学二轮专题突破 专题四氧化还原反应练习卷(已下线)2014届高考化学三轮复习排查 专题3离子反应 氧化还原反应练习卷(已下线)2015届四川省成都市高新区高三9月月考化学试卷(已下线)2015届浙江省江山实验中学高三9月月考化学试卷2015届福建省武平县第一中学高三上学期12月月考化学试卷四川省南充高级中学2017-2018学年高一12月月考化学试题



