1 . 实验室用 与浓盐酸共热制备
与浓盐酸共热制备 ,反应如下:
,反应如下: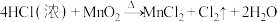
(1)该反应中被氧化的元素是___________ ,还原产物是___________ ;
(2)用单线桥标明电子转移的方向与数目___________ 。
(3)该反应中,氧化剂与还原剂的物质的量之比为___________ (前者比后者);盐酸在反应中表现出来的性质是___________ 。
(4)当生成标准状况下 时,转移的电子数目为
时,转移的电子数目为___________ ,被氧化的还原剂的物质的量为___________ 。
(5)也可以用 和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用
和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用 的原因:
的原因:___________ 。
(6)举例说明氯气的氧化性比硫单质强,___________ 。
 与浓盐酸共热制备
与浓盐酸共热制备 ,反应如下:
,反应如下: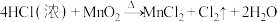
(1)该反应中被氧化的元素是
(2)用单线桥标明电子转移的方向与数目
(3)该反应中,氧化剂与还原剂的物质的量之比为
(4)当生成标准状况下
 时,转移的电子数目为
时,转移的电子数目为(5)也可以用
 和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用
和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用 的原因:
的原因:(6)举例说明氯气的氧化性比硫单质强,
您最近一年使用:0次
解题方法
2 . Cu2O溶于浓氨水中形成无色的[Cu(NH3)2]+,该无色溶液接触空气会很快变成深蓝色。
(1)[Cu(NH3)2]+中NH3的N原子提供___________,与中心离子形成___________。
| A.空轨道、离子键 | B.孤电子对、离子键 |
| C.空轨道、配位键 | D.孤电子对、配位键 |
| A.大于107° | B.小于107° | C.等于107° | D.等于120° |
完成并配平上述离子方程式。
您最近一年使用:0次
解题方法
3 . “太阳能热化学循环制氢”是将太阳能转化成化学能,通过多个化学过程产生H2.如常见的铁氧化物循环制氢过程如图所示。

(1)写出反应Ⅰ的化学方程式:
(2)若该反应生成标准状况下5.6 L氢气,转移电子数目为:
您最近一年使用:0次
名校
4 . 实验室制备 的原理是用亚氯酸钠固体与氯气反应:
的原理是用亚氯酸钠固体与氯气反应: 配平该氧化还原反应方程式,并用单线桥标出电子转移方向和数目
配平该氧化还原反应方程式,并用单线桥标出电子转移方向和数目_______ 。

 与
与 用作消毒剂时均被还原为
用作消毒剂时均被还原为 ,则
,则 的消毒能力是等质量的
的消毒能力是等质量的 的
的_______ 倍(保留小数点后2位,消毒能力可以用氧化剂转移电子数来衡量)。
 的原理是用亚氯酸钠固体与氯气反应:
的原理是用亚氯酸钠固体与氯气反应: 配平该氧化还原反应方程式,并用单线桥标出电子转移方向和数目
配平该氧化还原反应方程式,并用单线桥标出电子转移方向和数目
 与
与 用作消毒剂时均被还原为
用作消毒剂时均被还原为 ,则
,则 的消毒能力是等质量的
的消毒能力是等质量的 的
的
您最近一年使用:0次
名校
5 . Ⅰ.有钠、氢、氧、硫四种元素,用其中的一种或几种元素可以组成多种物质,写出符合下列要求的化学式(各写一个):
(1)酸式盐___________ ;
(2)非电解质___________ ;
(3)强电解质___________ ;
(4)弱电解质___________ 。
Ⅱ.完成下列问题
(5)配平下列反应________ ;
___________ ___________
___________ (浓)
(浓) ___________
___________ ___________
___________ ___________
___________ ___________
___________ 。
。
(6)该反应中还原产物为___________ ,若有 参加反应,则参加反应的
参加反应,则参加反应的 为
为___________  ,其中被氧化的
,其中被氧化的 为
为___________  ,转移电子的物质的量为
,转移电子的物质的量为___________  。
。
(1)酸式盐
(2)非电解质
(3)强电解质
(4)弱电解质
Ⅱ.完成下列问题
(5)配平下列反应
___________
 ___________
___________ (浓)
(浓) ___________
___________ ___________
___________ ___________
___________ ___________
___________ 。
。(6)该反应中还原产物为
 参加反应,则参加反应的
参加反应,则参加反应的 为
为 ,其中被氧化的
,其中被氧化的 为
为 ,转移电子的物质的量为
,转移电子的物质的量为 。
。
您最近一年使用:0次
名校
6 . Ⅰ.铁元素在地壳中含量居于第四位。铁是目前产量最大,使用最广泛的金属。
我国目前发现最早的人工冶铁制品是河南三门峡出土的西周晚期的玉柄铁剑。
(1)在钢铁厂的生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,不得留有水,请用化学方程式解释___________ 。
(2)电子工业中常用 溶液作为“腐蚀液”腐蚀覆铜板。为了检验反应后所得混合溶液中还有
溶液作为“腐蚀液”腐蚀覆铜板。为了检验反应后所得混合溶液中还有 ,可选择下列试剂中的
,可选择下列试剂中的___________ (填编号,下同)进行检验,现象是___________ 。
A.KSCN溶液 B.酸性 溶液 C.新制氯水
溶液 C.新制氯水
(3)高铁酸钠( )是一种新型绿色消毒剂,其一种制备原理如下,请将方程式补充完整并配平该方程式
)是一种新型绿色消毒剂,其一种制备原理如下,请将方程式补充完整并配平该方程式_______ 。

(4)在 和
和 的混合溶液中通入
的混合溶液中通入 气体,观察到白色沉淀生成,并且溶液的颜色变浅,经检验生成了二价铁,写出表示发生上述反应的化学方程
气体,观察到白色沉淀生成,并且溶液的颜色变浅,经检验生成了二价铁,写出表示发生上述反应的化学方程___________ 。
Ⅱ.某油脂厂废弃的油脂加氢镍催化剂(主要含Ni、Al、Fe的氧化物, 、C等)。采用如下工艺流程回收其中的镍制备硫酸镍晶体(
、C等)。采用如下工艺流程回收其中的镍制备硫酸镍晶体( ):
):

(5)“转化”时,加入 的目的是
的目的是___________ (用离子方程式表示),写出Al与NaOH溶液反应的化学方程式:___________ 。
(6)取ag铁粉投入600mL某浓度的稀 溶液中,充分反应后铁粉完全溶解,硝酸恰好完全反应,同时生成标准状况下NO气体6.72L(硝酸的还原产物只有一种)。反应后的溶液中加入足量NaOH溶液,将沉淀过滤、洗涤、充分灼烧得32g红棕色固体。试计算加入铁粉的质量a=
溶液中,充分反应后铁粉完全溶解,硝酸恰好完全反应,同时生成标准状况下NO气体6.72L(硝酸的还原产物只有一种)。反应后的溶液中加入足量NaOH溶液,将沉淀过滤、洗涤、充分灼烧得32g红棕色固体。试计算加入铁粉的质量a=___________ g。(写出计算过程)
我国目前发现最早的人工冶铁制品是河南三门峡出土的西周晚期的玉柄铁剑。
(1)在钢铁厂的生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,不得留有水,请用化学方程式解释
(2)电子工业中常用
 溶液作为“腐蚀液”腐蚀覆铜板。为了检验反应后所得混合溶液中还有
溶液作为“腐蚀液”腐蚀覆铜板。为了检验反应后所得混合溶液中还有 ,可选择下列试剂中的
,可选择下列试剂中的A.KSCN溶液 B.酸性
 溶液 C.新制氯水
溶液 C.新制氯水(3)高铁酸钠(
 )是一种新型绿色消毒剂,其一种制备原理如下,请将方程式补充完整并配平该方程式
)是一种新型绿色消毒剂,其一种制备原理如下,请将方程式补充完整并配平该方程式
(4)在
 和
和 的混合溶液中通入
的混合溶液中通入 气体,观察到白色沉淀生成,并且溶液的颜色变浅,经检验生成了二价铁,写出表示发生上述反应的化学方程
气体,观察到白色沉淀生成,并且溶液的颜色变浅,经检验生成了二价铁,写出表示发生上述反应的化学方程Ⅱ.某油脂厂废弃的油脂加氢镍催化剂(主要含Ni、Al、Fe的氧化物,
 、C等)。采用如下工艺流程回收其中的镍制备硫酸镍晶体(
、C等)。采用如下工艺流程回收其中的镍制备硫酸镍晶体( ):
):
(5)“转化”时,加入
 的目的是
的目的是(6)取ag铁粉投入600mL某浓度的稀
 溶液中,充分反应后铁粉完全溶解,硝酸恰好完全反应,同时生成标准状况下NO气体6.72L(硝酸的还原产物只有一种)。反应后的溶液中加入足量NaOH溶液,将沉淀过滤、洗涤、充分灼烧得32g红棕色固体。试计算加入铁粉的质量a=
溶液中,充分反应后铁粉完全溶解,硝酸恰好完全反应,同时生成标准状况下NO气体6.72L(硝酸的还原产物只有一种)。反应后的溶液中加入足量NaOH溶液,将沉淀过滤、洗涤、充分灼烧得32g红棕色固体。试计算加入铁粉的质量a=
您最近一年使用:0次
名校
解题方法
7 . I.五氧化二氮( )是一种绿色硝化剂,在军用炸药、火箭推进剂、医药等工业中得到广泛应用。常温下
)是一种绿色硝化剂,在军用炸药、火箭推进剂、医药等工业中得到广泛应用。常温下 为白色固体,可溶于二氯甲烷(
为白色固体,可溶于二氯甲烷( )等有机溶剂,微溶于水且与水反应生成硝酸,高于室温时不稳定。
)等有机溶剂,微溶于水且与水反应生成硝酸,高于室温时不稳定。
(1)1840年,Devill将干燥的氯气通入无水硝酸银中,首次制得了固体 。该反应的氧化产物为空气中的主要成分之一,写出反应的化学方程式:
。该反应的氧化产物为空气中的主要成分之一,写出反应的化学方程式:___________ 。
Ⅱ.某化学兴趣小组设计用臭氧( )氧化法制备
)氧化法制备 ,反应原理为
,反应原理为 。(已知常温常压下
。(已知常温常压下 )
)
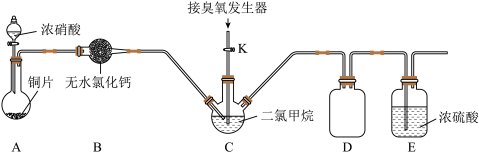
(2)装置D的作用是___________ ;装置E的作用是___________ 。
(3)实验时,先将三口烧瓶C浸入___________ (填字母编号)中,打开装置A中分液漏斗的活塞,随即关闭。一段时间后C中液体变为红棕色。然后打开活塞K,通过臭氧发生器向三口烧瓶中通入含有臭氧的氧气。
a.热水 b.冰水 c.自来水 d.饱和食盐水
(4)C中二氯甲烷( )的作用是
)的作用是___________ 。
(5)判断C中反应已结束的简单方法是___________ 。
(6)该装置存在一处明显缺陷,请指出___________ 。
 )是一种绿色硝化剂,在军用炸药、火箭推进剂、医药等工业中得到广泛应用。常温下
)是一种绿色硝化剂,在军用炸药、火箭推进剂、医药等工业中得到广泛应用。常温下 为白色固体,可溶于二氯甲烷(
为白色固体,可溶于二氯甲烷( )等有机溶剂,微溶于水且与水反应生成硝酸,高于室温时不稳定。
)等有机溶剂,微溶于水且与水反应生成硝酸,高于室温时不稳定。(1)1840年,Devill将干燥的氯气通入无水硝酸银中,首次制得了固体
 。该反应的氧化产物为空气中的主要成分之一,写出反应的化学方程式:
。该反应的氧化产物为空气中的主要成分之一,写出反应的化学方程式:Ⅱ.某化学兴趣小组设计用臭氧(
 )氧化法制备
)氧化法制备 ,反应原理为
,反应原理为 。(已知常温常压下
。(已知常温常压下 )
)
(2)装置D的作用是
(3)实验时,先将三口烧瓶C浸入
a.热水 b.冰水 c.自来水 d.饱和食盐水
(4)C中二氯甲烷(
 )的作用是
)的作用是(5)判断C中反应已结束的简单方法是
(6)该装置存在一处明显缺陷,请指出
您最近一年使用:0次
名校
8 . 汽车尾气中主要含有 、CO、NO等物质,治理方法之一是在汽车的排气管上安装“催化转化器”,其中CO和NO可以转化为两种无毒的气体,如图所示。
、CO、NO等物质,治理方法之一是在汽车的排气管上安装“催化转化器”,其中CO和NO可以转化为两种无毒的气体,如图所示。
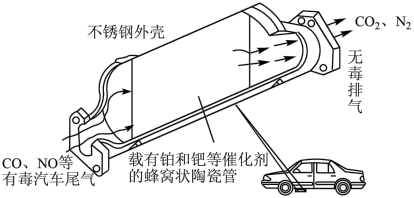
(1)下列关于汽车尾气处理的说法正确的是___________
(2)汽车尾气中的NO来源不合理的是___________ 。
A.氨和氧气在催化剂的作用下转化而成
B.氮气和氧气在火花塞放电时反应生成
C.氮气和氧气在高温条件下转化而成
(3)尽管催化转化器可以处理CO、NO,但是催化剂也容易将 转化为
转化为 ,从而引起酸雨问题。
,从而引起酸雨问题。 转化为
转化为 的化学方程式为
的化学方程式为___________ 。
 、CO、NO等物质,治理方法之一是在汽车的排气管上安装“催化转化器”,其中CO和NO可以转化为两种无毒的气体,如图所示。
、CO、NO等物质,治理方法之一是在汽车的排气管上安装“催化转化器”,其中CO和NO可以转化为两种无毒的气体,如图所示。
(1)下列关于汽车尾气处理的说法正确的是___________
A.这是一个产生 的置换反应 的置换反应 |
B.汽车尾气的主要污染成分包括CO、NO和 |
| C.尾气进入催化转化器前,必须有措施控制NO和CO的排出比例 |
| D.铂和钯等催化剂能够催化所有气体之间的反应 |
(2)汽车尾气中的NO来源不合理的是
A.氨和氧气在催化剂的作用下转化而成
B.氮气和氧气在火花塞放电时反应生成
C.氮气和氧气在高温条件下转化而成
(3)尽管催化转化器可以处理CO、NO,但是催化剂也容易将
 转化为
转化为 ,从而引起酸雨问题。
,从而引起酸雨问题。 转化为
转化为 的化学方程式为
的化学方程式为
您最近一年使用:0次
名校
9 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
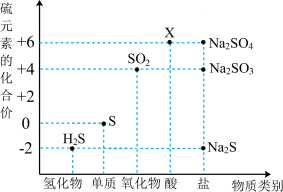
(1)X的浓溶液与碳在一定条件下可以发生反应,体现了X的___________ 性。从硫元素化合价变化的角度分析,图中只有还原性的物质有___________ (填化学式)。
(2)收集了一些含有S元素的酸雨,放置一段时间后,pH变小,小攀认为可能是因为酸雨中的亚硫酸被氧化为了___________ 。小登觉得可以设计实验验证这一推论,具体操作是___________ 。
(3)配平下列反应:___________
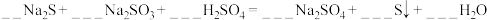 。
。
(4)如图是验证二氧化硫性质的实验装置。
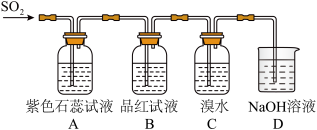
二氧化硫具有:①漂白性、②酸性氧化物性质、③还原性、④氧化性,上述装置中对应表现出的性质是:A中___________ (填序号,下同);B中___________ ;C中___________ 。D装置的作用是___________ 。

(1)X的浓溶液与碳在一定条件下可以发生反应,体现了X的
(2)收集了一些含有S元素的酸雨,放置一段时间后,pH变小,小攀认为可能是因为酸雨中的亚硫酸被氧化为了
(3)配平下列反应:
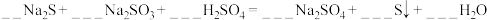 。
。(4)如图是验证二氧化硫性质的实验装置。

二氧化硫具有:①漂白性、②酸性氧化物性质、③还原性、④氧化性,上述装置中对应表现出的性质是:A中
您最近一年使用:0次
名校
10 . 蛇纹石是一类含水富镁硅酸盐矿物,主要成分为MgO和SiO2,含少量Fe、Ni的氧化物。可用于生产重要无机化工产品碱式碳酸镁[Mg2(OH)2CO3]。其制备流程如图所示:
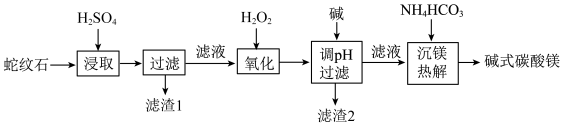
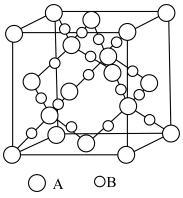
(1)滤渣1的主要成分从性质上来分,属于_______ 氧化物(填“酸性”“两性”或“碱性”),其用途很广泛,请写出一种:_______ 。如图表示该物质晶体的晶胞结构,1个该晶胞中含有_______ 个A-B键。
(2)滤渣2的主要成分是Fe(OH)3和Ni(OH)2,“氧化”过程中发现所用H2O2远高于理论用量,造成这一结果的主要原因有:①“氧化”过程中放热,温度升高加快了H2O2的分解速率、②_______ 。以下_______ (填序号)可以检验“氧化”过程已完全。
A.KSCN溶液 B.酸性KMnO4溶液 C.K3[Fe(CN)6]溶液 D.NaOH溶液
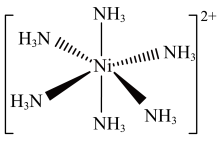
(3)Ni2+易形成[Ni(NH3)6]2+配合物,若[Ni(NH3)6]2+为正八面体构型(如图所示),则[Ni(CO)2(NH3)4]2+的结构有_______ 种。
(4)“沉镁热解”由连续的两步完成,第一步:沉镁生成正碳酸镁(MgCO3·3H2O),第二步:将正碳酸镁热解生成碱式碳酸镁。写出第一步的化学方程式:_______ 。
(5)用x吨含3MgO·2SiO2·2H2O(摩尔质量为a g/mol)为80%蛇纹石为原料,按以上流程制取[Mg2(OH)2CO3](摩尔质量为bg/mol),制得产品y吨,制取过程中镁元素的损失率为_______ ×100%(用含x、y、a、b的式子表示)。

(1)滤渣1的主要成分从性质上来分,属于

(2)滤渣2的主要成分是Fe(OH)3和Ni(OH)2,“氧化”过程中发现所用H2O2远高于理论用量,造成这一结果的主要原因有:①“氧化”过程中放热,温度升高加快了H2O2的分解速率、②
A.KSCN溶液 B.酸性KMnO4溶液 C.K3[Fe(CN)6]溶液 D.NaOH溶液
(3)Ni2+易形成[Ni(NH3)6]2+配合物,若[Ni(NH3)6]2+为正八面体构型(如图所示),则[Ni(CO)2(NH3)4]2+的结构有

(4)“沉镁热解”由连续的两步完成,第一步:沉镁生成正碳酸镁(MgCO3·3H2O),第二步:将正碳酸镁热解生成碱式碳酸镁。写出第一步的化学方程式:
(5)用x吨含3MgO·2SiO2·2H2O(摩尔质量为a g/mol)为80%蛇纹石为原料,按以上流程制取[Mg2(OH)2CO3](摩尔质量为bg/mol),制得产品y吨,制取过程中镁元素的损失率为
您最近一年使用:0次
2024-02-11更新
|
223次组卷
|
2卷引用:上海市宜川中学2023-2024学年高三上学期12月考试化学试题



