1 . 采用选择性催化还原技术(SCR)可以有效脱除烟气中的氮氧化物( )。
)。
(1)钒基催化剂(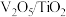 催化剂)可用于
催化剂)可用于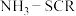 ,反应机理与催化剂表面
,反应机理与催化剂表面 的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示:
的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示: 的总反应化学方程式为
的总反应化学方程式为___________ ,该反应的中间体有___________ 种。
②若烟气中含有硫的氧化物,则会降低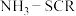 的速率,可能的原因是
的速率,可能的原因是___________ 。
(2)研究发现:当烟气中 和
和 的物质的量相同时,会发生快速SCR反应过程:
的物质的量相同时,会发生快速SCR反应过程: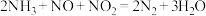 。臭氧对
。臭氧对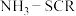 具有一定的辅助作用。臭氧先氧化
具有一定的辅助作用。臭氧先氧化 ,发生反应:
,发生反应: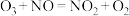 。在不同温度下,经过相同时间后测得
。在不同温度下,经过相同时间后测得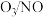 的物质的量之比与
的物质的量之比与 的脱除率关系如图乙所示。
的脱除率关系如图乙所示。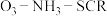 中
中 脱除率均有不同程度的降低,其原因是
脱除率均有不同程度的降低,其原因是___________ (写两条)。
②温度低于250℃,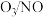 物质的量之比为0.5时,
物质的量之比为0.5时, 脱除率较高的原因是
脱除率较高的原因是___________ 。
③实验发现,向烟气中先通入 ,
, 脱除率低于先通入
脱除率低于先通入 ,可能的原因是
,可能的原因是___________
(3)以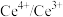 为媒介的间接电化学氧化法可以同时除去烟气中的
为媒介的间接电化学氧化法可以同时除去烟气中的 和
和 ,装置如图丙所示:
,装置如图丙所示:___________ , 参与反应的离子方程式为
参与反应的离子方程式为___________ 。
 )。
)。(1)钒基催化剂(
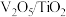 催化剂)可用于
催化剂)可用于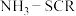 ,反应机理与催化剂表面
,反应机理与催化剂表面 的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示:
的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示: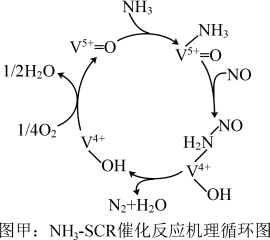
 的总反应化学方程式为
的总反应化学方程式为②若烟气中含有硫的氧化物,则会降低
 的速率,可能的原因是
的速率,可能的原因是(2)研究发现:当烟气中
 和
和 的物质的量相同时,会发生快速SCR反应过程:
的物质的量相同时,会发生快速SCR反应过程: 。臭氧对
。臭氧对 具有一定的辅助作用。臭氧先氧化
具有一定的辅助作用。臭氧先氧化 ,发生反应:
,发生反应: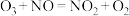 。在不同温度下,经过相同时间后测得
。在不同温度下,经过相同时间后测得 的物质的量之比与
的物质的量之比与 的脱除率关系如图乙所示。
的脱除率关系如图乙所示。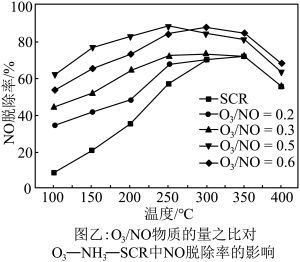
 中
中 脱除率均有不同程度的降低,其原因是
脱除率均有不同程度的降低,其原因是②温度低于250℃,
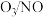 物质的量之比为0.5时,
物质的量之比为0.5时, 脱除率较高的原因是
脱除率较高的原因是③实验发现,向烟气中先通入
 ,
, 脱除率低于先通入
脱除率低于先通入 ,可能的原因是
,可能的原因是(3)以
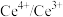 为媒介的间接电化学氧化法可以同时除去烟气中的
为媒介的间接电化学氧化法可以同时除去烟气中的 和
和 ,装置如图丙所示:
,装置如图丙所示: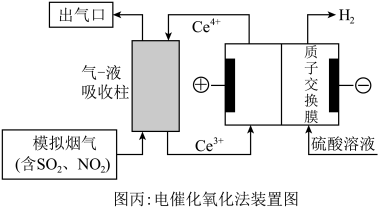
 参与反应的离子方程式为
参与反应的离子方程式为
您最近半年使用:0次
解题方法
2 . Co、La元素及其化合物在工业及生活方面有重要应用。回答下列问题:
(1)基态Co的价电子排布图_______ ,核外电子的空间运动状态有_______ 种。
(2)一定条件下, 、
、 、
、 和
和 反应可制得
反应可制得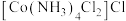 ,反应的方程式为
,反应的方程式为_______ ,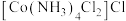 的配位数为
的配位数为_______ 。区别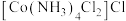 和
和 两种溶液的试剂是
两种溶液的试剂是_______ 。
(3)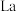 的八配位金属羰基化合物
的八配位金属羰基化合物 的结构如图所示,
的结构如图所示, 作配体,配位原子为C,而不是O,其原因是
作配体,配位原子为C,而不是O,其原因是_______ ,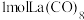 含
含_______  键。
键。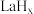 在储氢和超导等领域具有重要应用。高压下,
在储氢和超导等领域具有重要应用。高压下,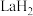 中的每个
中的每个 结合4个
结合4个 形成类似
形成类似 的结构独立存在,即得到晶体
的结构独立存在,即得到晶体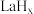 。则
。则
_______ 。晶体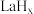 的密度为
的密度为_______  。(写出计算式即可)
。(写出计算式即可)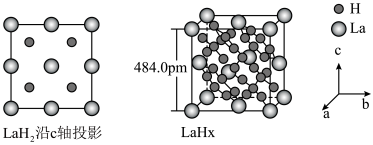
(1)基态Co的价电子排布图
(2)一定条件下,
 、
、 、
、 和
和 反应可制得
反应可制得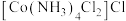 ,反应的方程式为
,反应的方程式为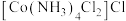 的配位数为
的配位数为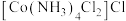 和
和 两种溶液的试剂是
两种溶液的试剂是(3)
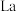 的八配位金属羰基化合物
的八配位金属羰基化合物 的结构如图所示,
的结构如图所示, 作配体,配位原子为C,而不是O,其原因是
作配体,配位原子为C,而不是O,其原因是 含
含 键。
键。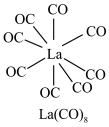
 在储氢和超导等领域具有重要应用。高压下,
在储氢和超导等领域具有重要应用。高压下,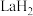 中的每个
中的每个 结合4个
结合4个 形成类似
形成类似 的结构独立存在,即得到晶体
的结构独立存在,即得到晶体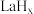 。则
。则
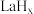 的密度为
的密度为 。(写出计算式即可)
。(写出计算式即可)
您最近半年使用:0次
解题方法
3 . 锂离子电池正极材料(主要成分为 ,还含有少量铝箔、
,还含有少量铝箔、 等杂质),从废旧锂离子正极材料中回收氧化钴的工艺流程如图所示:
等杂质),从废旧锂离子正极材料中回收氧化钴的工艺流程如图所示: ,
, ,
, 。
。
回答下列问题:
(1)废旧电池拆解提取正极材料前,需将其浸入 溶液中,其目的是
溶液中,其目的是________ 。
(2)滤液1的主要成分是________ (填化学式,下同)。滤液2的主要成分是________ 。
(3)“酸溶”时发生的主要反应的离子方程式________ ;不用盐酸替代硫酸的原因是________ 。
(4)不宜使用 沉钴的原因是
沉钴的原因是________ 。
(5)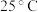 ,若“沉钴”开始时
,若“沉钴”开始时 ,为了获得纯净的
,为了获得纯净的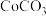 ,应控制溶液的
,应控制溶液的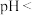
________ 。
(6)若最终得到产品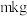 ,则可以重新制备
,则可以重新制备________  正极材料(含钴
正极材料(含钴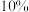 )。
)。
 ,还含有少量铝箔、
,还含有少量铝箔、 等杂质),从废旧锂离子正极材料中回收氧化钴的工艺流程如图所示:
等杂质),从废旧锂离子正极材料中回收氧化钴的工艺流程如图所示: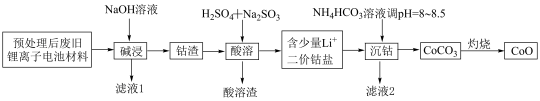
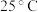 ,
, ,
, 。
。回答下列问题:
(1)废旧电池拆解提取正极材料前,需将其浸入
 溶液中,其目的是
溶液中,其目的是(2)滤液1的主要成分是
(3)“酸溶”时发生的主要反应的离子方程式
(4)不宜使用
 沉钴的原因是
沉钴的原因是(5)
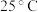 ,若“沉钴”开始时
,若“沉钴”开始时 ,为了获得纯净的
,为了获得纯净的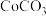 ,应控制溶液的
,应控制溶液的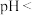
(6)若最终得到产品
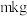 ,则可以重新制备
,则可以重新制备 正极材料(含钴
正极材料(含钴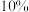 )。
)。
您最近半年使用:0次
4 . 以废料铅膏( 、
、 、
、 、
、 等)为原料,制备超细
等)为原料,制备超细 ,实现铅循环再利用的流程如下:
,实现铅循环再利用的流程如下: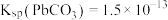 ,
,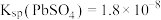 。②
。② 溶解在
溶解在 溶液中(杂质不溶于
溶液中(杂质不溶于 )的溶解度曲线如图所示:
)的溶解度曲线如图所示:
 、
、 、
、 、
、 等)为原料,制备超细
等)为原料,制备超细 ,实现铅循环再利用的流程如下:
,实现铅循环再利用的流程如下: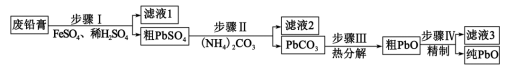
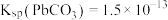 ,
,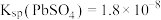 。②
。② 溶解在
溶解在 溶液中(杂质不溶于
溶液中(杂质不溶于 )的溶解度曲线如图所示:
)的溶解度曲线如图所示:
A.步骤Ⅰ发生的主要反应有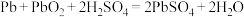 |
B.步骤Ⅱ,若滤出的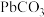 沉淀中混有 沉淀中混有 ,该滤液中 ,该滤液中 |
| C.过程中为提高产品产率,滤液3应循环使用 |
D.精制的操作是在 用碱溶解,然后趁热过滤、洗涤、干燥 用碱溶解,然后趁热过滤、洗涤、干燥 |
您最近半年使用:0次
名校
5 . 利用工业废气NO生产 的流程如图所示。已知装置Ⅰ和装置Ⅱ反应后溶液中
的流程如图所示。已知装置Ⅰ和装置Ⅱ反应后溶液中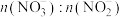 都为1∶1.下列说法错误的是
都为1∶1.下列说法错误的是
 的流程如图所示。已知装置Ⅰ和装置Ⅱ反应后溶液中
的流程如图所示。已知装置Ⅰ和装置Ⅱ反应后溶液中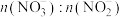 都为1∶1.下列说法错误的是
都为1∶1.下列说法错误的是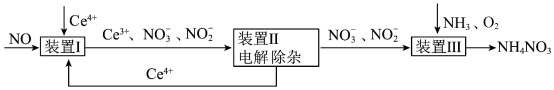
| A.装置江中若有5.6L(标准状况)NO参与反应,则转移1mol电子 |
B.装置Ⅰ中反应为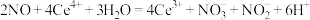 |
| C.装置Ⅲ中氧化剂和还原剂的物质的量之比为1∶2 |
D.装置Ⅲ中 和 和 的体积比3∶1时,可实现原子利用率最大化 的体积比3∶1时,可实现原子利用率最大化 |
您最近半年使用:0次
2024-04-10更新
|
84次组卷
|
2卷引用:山东省青岛第二中学2023-2024学年高一上学期第二次月考化学试卷
名校
解题方法
6 . 某小组为探究含硫化合物(NH4)2S2O8的性质,设计如下实验探究(NH4)2S2O8的氧化性。实验操作:向小试管中加入2mL0.2mol/LKI溶液,并滴入两滴淀粉溶液,无明显变化,再加入少量0.2mol/L(NH4)2S2O8溶液,试管中溶液立即变蓝。取上层清液检验,证明溶液中存在 。
。
(1)(NH4)2S2O8与KI反应的离子方程式为___________ 。
已知:I2可与S2O 发生反应:2S2O
发生反应:2S2O +I2=S4O
+I2=S4O +2I-。为了进一步探究S2O
+2I-。为了进一步探究S2O 与KI的反应速率,小组同学设计下表实验:
与KI的反应速率,小组同学设计下表实验:
(2)上述实验Ⅱ中的V1=___________ ;V2=___________ 。
加入Na2S2O3溶液后溶液变蓝的时间明显增长,小组同学对此提出两种猜想:
猜想1:(NH4)2S2O8与KI反应的速率远低于I2与Na2S2O3反应的速率;
猜想2:(NH4)2S2O8先与Na2S2O3反应,Na2S2O3消耗完后才与I-反应。
为验证上述猜想,小组同学补充下表实验:
(3)验证猜想1的实验设计为___________ (填“实验Ⅲ”或“实验Ⅳ”下同)。
(4)实验Ⅲ中下层溶液显浅紫色的原因为___________ 。
(5)由上述实验可知___________ (填“猜想1”或“猜想2”)成立。
 。
。(1)(NH4)2S2O8与KI反应的离子方程式为
已知:I2可与S2O
 发生反应:2S2O
发生反应:2S2O +I2=S4O
+I2=S4O +2I-。为了进一步探究S2O
+2I-。为了进一步探究S2O 与KI的反应速率,小组同学设计下表实验:
与KI的反应速率,小组同学设计下表实验:| 试验编号 | 0.2mol/LKI溶液/mL | 0.01mol/LNa2S2O3溶液/mL | 蒸馏水/mL | 0.4%的淀粉溶液/滴 | 0.2mol/L(NH4)2S2O8溶液/mL | 变色时间/s |
| Ⅰ | 4.0 | 0 | 4.0 | 2 | 2.0 | 立即 |
| Ⅱ | 4.0 | 1.0 | V1 | 2 | V2 | 30 |
加入Na2S2O3溶液后溶液变蓝的时间明显增长,小组同学对此提出两种猜想:
猜想1:(NH4)2S2O8与KI反应的速率远低于I2与Na2S2O3反应的速率;
猜想2:(NH4)2S2O8先与Na2S2O3反应,Na2S2O3消耗完后才与I-反应。
为验证上述猜想,小组同学补充下表实验:
| 试验编号 | 0.2mol/LKI溶液/mL | 0.001mol/L碘水/mL | 0.01mol/LNa2S2O3溶液/mL | CCl4/mL | 0.4%的淀粉溶液/滴 | 0.2mol/L(NH4)2S2O8溶液/mL | 实验现象 |
| Ⅲ | 2 | 0 | 20 | 10 | 0 | 0.2 | 下层溶液显浅紫色 |
| Ⅳ | 0 | 5 | 20 | 0 | 2 | 20 | 溶液先变蓝,后迅速褪色,一段时间后又变蓝 |
(4)实验Ⅲ中下层溶液显浅紫色的原因为
(5)由上述实验可知
您最近半年使用:0次
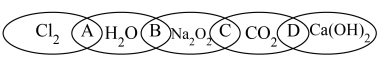
7 . 下图中有5种物质 、
、 、
、 、
、 、
、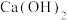 ,图中相交部分“A、B、C、D”代表两种物质相互反应的产物。
,图中相交部分“A、B、C、D”代表两种物质相互反应的产物。
回答下列问题:
(1)5种物质中属于酸性氧化物的是___________ (填化学式,下同),属于电解质的是___________ 。
(2)产物中含有难溶电解质的是___________ (填“A”、“B”、“C”或“D”)。
(3)过去工业曾采用 与
与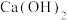 溶液反应制备NaOH,写出相应的离子方程式
溶液反应制备NaOH,写出相应的离子方程式___________ ;现代工业利用电解饱和食盐水制备NaOH,同时生成两种单质 和X,写出相应的化学方程式
和X,写出相应的化学方程式___________ 。
(4)阴阳离子数目比:
___________  (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
 、
、 、
、 、
、 、
、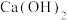 ,图中相交部分“A、B、C、D”代表两种物质相互反应的产物。
,图中相交部分“A、B、C、D”代表两种物质相互反应的产物。
回答下列问题:
(1)5种物质中属于酸性氧化物的是
(2)产物中含有难溶电解质的是
(3)过去工业曾采用
 与
与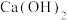 溶液反应制备NaOH,写出相应的离子方程式
溶液反应制备NaOH,写出相应的离子方程式 和X,写出相应的化学方程式
和X,写出相应的化学方程式(4)阴阳离子数目比:

 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
您最近半年使用:0次
解题方法
8 . 用盐酸洗钢材会产生“酸洗废液”(主要成分为FeCl2)。工业上用“酸洗废液”经高温氧化制取高纯氧化铁,同时产生的氯化氢气体可回收使用,发生的反应为aFeCl2 +bO2 + cH2O dFe2O3+8HCl(未配平)。下列说法正确的是
dFe2O3+8HCl(未配平)。下列说法正确的是
 dFe2O3+8HCl(未配平)。下列说法正确的是
dFe2O3+8HCl(未配平)。下列说法正确的是| A.a+b+d=7 |
| B.该反应中,每消耗3.2gO2,同时生成32 g Fe2O3 |
| C.该反应中,HCl既是氧化产物也是还原产物 |
| D.将生成的气体通入碳酸氢钙溶液中,会有碳酸钙沉淀生成 |
您最近半年使用:0次
名校
解题方法
9 . 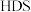 催化剂广泛用于石油炼制和化学工业生产中,通常利用加碱焙烧——水浸取法从
催化剂广泛用于石油炼制和化学工业生产中,通常利用加碱焙烧——水浸取法从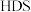 废催化剂(主要成分为
废催化剂(主要成分为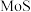 、
、 、
、 、
、 等)中提取贵重金属钒和钼,其工艺流程如图所示。
等)中提取贵重金属钒和钼,其工艺流程如图所示。
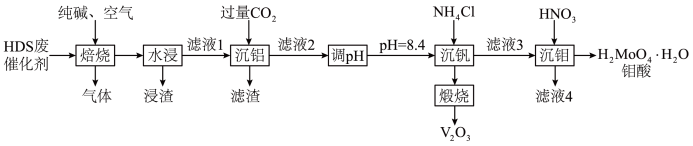
已知:Ⅰ.焙烧时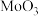 、
、 、
、 均可与纯碱反应生成对应的钠盐,而
均可与纯碱反应生成对应的钠盐,而 不行。
不行。
Ⅱ.高温下 易分解,分解产物含氨元素的气体有两种,二者均非氧化物。
易分解,分解产物含氨元素的气体有两种,二者均非氧化物。
Ⅲ.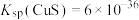 ;
; 、
、 。
。
请回答下列问题:
(1)请写出“焙烧”过程中
 ,及
,及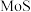 分别与纯碱反应的化学方程式:
分别与纯碱反应的化学方程式:(2)“浸渣”的成分为
 外,还含有
外,还含有(3)“沉钒”时提钒率随初始钒的浓度及氯化铵的加入量的关系如图所示,则选择的初始
 的加入量为
的加入量为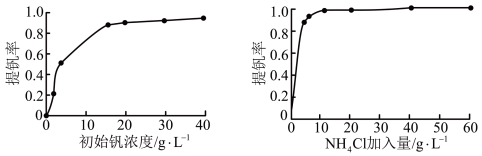
(4)在实际工业生产中,“沉钼”前要加入
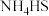 完全沉淀掉溶液中的
完全沉淀掉溶液中的 ,应维持反应后溶液中
,应维持反应后溶液中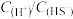 的范围是
的范围是(5)“沉钒”时生成
 沉淀,请写出“煅烧”中发生反应的化学方程式:
沉淀,请写出“煅烧”中发生反应的化学方程式:
您最近半年使用:0次
名校
10 . 物质类别和元素化合价是研究物质性质的两个重要角度。
Ⅰ.硫在不同价态之间的转化: 溶液
溶液 溶液
溶液
(1)反应①的转化说明
 的类别属于
的类别属于 溶液,从化合价的角度分析,反应②合理的是
溶液,从化合价的角度分析,反应②合理的是a. b.
b.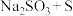 c.
c.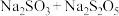
Ⅱ.某兴趣小组模拟工业制取 的装置(夹持和加热装置略)如图所示。
的装置(夹持和加热装置略)如图所示。
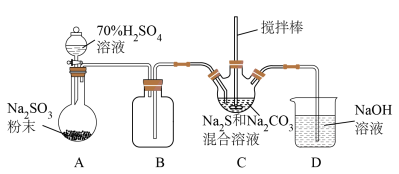
(2)装置A中发生反应的化学方程式为
(3)装置C发生的反应有①
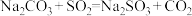 ;②……;③
;②……;③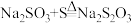 ,反应②的离子方程式为
,反应②的离子方程式为 ,应使三颈烧瓶中
,应使三颈烧瓶中 和
和 恰好完全反应,则三颈烧瓶中
恰好完全反应,则三颈烧瓶中 和
和 物质的量之比应为
物质的量之比应为(4)工业上常用
 溶液吸收尾气中的
溶液吸收尾气中的 ,氧化产物为
,氧化产物为 ,发生反应的离子方程式为
,发生反应的离子方程式为 可用于氰化物解毒,解毒原理为
可用于氰化物解毒,解毒原理为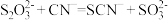 。体外模拟该解毒实验,检验该转化有
。体外模拟该解毒实验,检验该转化有 生成的实验操作是
生成的实验操作是
您最近半年使用:0次



