解题方法
1 . 金属钛( )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
(1) 元素在周期表中的分区是位于
元素在周期表中的分区是位于___________ 区。基态 原子中含有的未成对电子数是
原子中含有的未成对电子数是___________ 。
(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为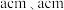 和
和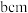 ,结构如下图所示。
,结构如下图所示。___________ , 位于距离最近的
位于距离最近的 构成的
构成的___________ 中心(填字母序号,下同)。
a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为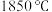 ,其晶体类型
,其晶体类型最不可 能是___________ 。
a.共价晶体 b.离子晶体 c.分子晶体
③若已知 该氧化物晶体体积为
该氧化物晶体体积为 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为___________  。
。
(3)以钓铁矿 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下: 元素在元素周期表中的位置是
元素在元素周期表中的位置是___________ 。
②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:___________ 。
③结合流程及下表数据,“分离”时所需控制的最低温度应为___________  。
。
④已知 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:___________ 。
 )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。(1)
 元素在周期表中的分区是位于
元素在周期表中的分区是位于 原子中含有的未成对电子数是
原子中含有的未成对电子数是(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为
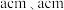 和
和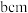 ,结构如下图所示。
,结构如下图所示。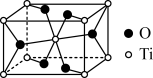
 位于距离最近的
位于距离最近的 构成的
构成的a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为
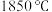 ,其晶体类型
,其晶体类型a.共价晶体 b.离子晶体 c.分子晶体
③若已知
 该氧化物晶体体积为
该氧化物晶体体积为 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为 。
。(3)以钓铁矿
 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下:
 元素在元素周期表中的位置是
元素在元素周期表中的位置是②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:
③结合流程及下表数据,“分离”时所需控制的最低温度应为
 。
。 |  |  | |
熔点/ | 1668 | 651 | 714 |
沸点/ | 3287 | 1107 | 1412 |
 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:
您最近一年使用:0次
2 . 合成氨的发展体现了化学科学与技术的不断进步。
(1)1898年,化学家用氮气、碳化钙(CaC2)与水蒸气反应制备氨:
ⅰ.碳化钙和氮气在1000℃的高温下产生氰氨化钙(CaCN2);
ⅱ.氰氨化钙与水蒸气反应生成氨气。
写出反应ⅱ的化学方程式:_____________ 。
(2)20世纪初,以N2和H2为原料的工业合成氨方法研制成功。其反应为:N2(g)+3H2(g)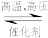 2NH3(g) △H=-92.4kJ/mol,压强对合成氨有较大影响。如图为不同压强下,以物质的量分数x(H2)=0.75、x(N2)=0.25进料(组成1),反应达平衡时x(NH3)与温度的计算结果。
2NH3(g) △H=-92.4kJ/mol,压强对合成氨有较大影响。如图为不同压强下,以物质的量分数x(H2)=0.75、x(N2)=0.25进料(组成1),反应达平衡时x(NH3)与温度的计算结果。___ p2(填“>”或“<”),简述理由:__________________ 。
ⅱ.在p1、x(NH3)=0.20时,氮气的转化率为_________ 。
ⅲ.合成氨原料气中存在不参与反应的Ar时会影响NH3的平衡含量。在p1时,以物质的量分数x(H2)=0.675、x(N2)=0.225、x(Ar)=0.10进料(组成2)。反应达平衡时:x(NH3)与温度的计算结果与组成1相比有一定变化,在图中用虚线画出相应曲线______ 。
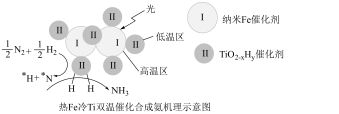
(3)我国科学家研制出Fe-TiO2-xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,纳米Fe的温度为547℃,而TiO2-xHy的温度为415℃),解决了温度对合成氨工业反应速率和平衡转化率影响矛盾的问题,其催化合成氨机理如图所示。__________ 。
(1)1898年,化学家用氮气、碳化钙(CaC2)与水蒸气反应制备氨:
ⅰ.碳化钙和氮气在1000℃的高温下产生氰氨化钙(CaCN2);
ⅱ.氰氨化钙与水蒸气反应生成氨气。
写出反应ⅱ的化学方程式:
(2)20世纪初,以N2和H2为原料的工业合成氨方法研制成功。其反应为:N2(g)+3H2(g)
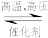 2NH3(g) △H=-92.4kJ/mol,压强对合成氨有较大影响。如图为不同压强下,以物质的量分数x(H2)=0.75、x(N2)=0.25进料(组成1),反应达平衡时x(NH3)与温度的计算结果。
2NH3(g) △H=-92.4kJ/mol,压强对合成氨有较大影响。如图为不同压强下,以物质的量分数x(H2)=0.75、x(N2)=0.25进料(组成1),反应达平衡时x(NH3)与温度的计算结果。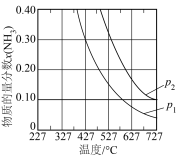
ⅱ.在p1、x(NH3)=0.20时,氮气的转化率为
ⅲ.合成氨原料气中存在不参与反应的Ar时会影响NH3的平衡含量。在p1时,以物质的量分数x(H2)=0.675、x(N2)=0.225、x(Ar)=0.10进料(组成2)。反应达平衡时:x(NH3)与温度的计算结果与组成1相比有一定变化,在图中用虚线画出相应曲线
(3)我国科学家研制出Fe-TiO2-xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,纳米Fe的温度为547℃,而TiO2-xHy的温度为415℃),解决了温度对合成氨工业反应速率和平衡转化率影响矛盾的问题,其催化合成氨机理如图所示。
您最近一年使用:0次
3 . 硫代硫酸钠(Na2S2O3)是重要的化工原料易溶于水,在中性或碱性环境下稳定,在酸性溶液水,分解产生S、SO2。
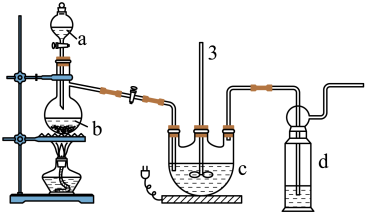
Ⅰ.Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示,其C中试剂为Na2S和Na2SO3的混合液。
(1)b中反应的离子方程式为_____ 。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是_____ 。
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是_____ 。
(4)制备得到的Na2S2O3中可能含有Na2SO3、Na2SO4等杂质。设计实验,检测产品中是否存在Na2SO4:取少量产品_____ 。
Ⅱ.探究Na2S2O3与金属阳离子的氧化还原反应。
资料:ⅰ.Fe3++3S2O
 Fe(S2O3)
Fe(S2O3) (紫黑色)
(紫黑色)
ⅱ.Ag2S2O3为白色沉淀,Ag2S2O3可溶于过量的S2O
(5)根据实验①的现象,初步判断最终Fe3+被S2O 还原为Fe2+,通过
还原为Fe2+,通过_____ (填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅰ的现象:_____ 。
(6)同浓度氧化性:Ag+>Fe3+。实验②中Ag+未发生氧化还原反应的原因是_____ 。
(7)进一步探究Ag+和S2O 反应。
反应。
实验③中白色絮状沉淀最后变为黑色沉淀(Ag2S)的化学方程式如下,填入合适的物质和系数:_____ 。
Ag2S2O3+_____=Ag2S+_____
(8)根据以上实验,Na2S2O3与金属阳离子发生氧化还原反应和_____ 有关(写出两条)。

Ⅰ.Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示,其C中试剂为Na2S和Na2SO3的混合液。
(1)b中反应的离子方程式为
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是
(4)制备得到的Na2S2O3中可能含有Na2SO3、Na2SO4等杂质。设计实验,检测产品中是否存在Na2SO4:取少量产品
Ⅱ.探究Na2S2O3与金属阳离子的氧化还原反应。
资料:ⅰ.Fe3++3S2O

 Fe(S2O3)
Fe(S2O3) (紫黑色)
(紫黑色)ⅱ.Ag2S2O3为白色沉淀,Ag2S2O3可溶于过量的S2O

| 装置 | 编号 | 试剂X | 实验现象 |
 | ① | Fe(NO3)3溶液 | 混合后溶液先变成紫黑色,30s后溶液几乎变为无色 |
| ② | AgNO3溶液 | 先生成白色絮状沉淀,振荡后,沉淀溶解,得到无色溶液 |
(5)根据实验①的现象,初步判断最终Fe3+被S2O
 还原为Fe2+,通过
还原为Fe2+,通过(6)同浓度氧化性:Ag+>Fe3+。实验②中Ag+未发生氧化还原反应的原因是
(7)进一步探究Ag+和S2O
 反应。
反应。| 装置 | 编号 | 试剂X | 实验现象 |
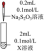 | ② | AgNO3溶液 | 先生成白色絮状沉淀,沉淀很快变成黄色、棕色,最后为黑色沉淀。 |
Ag2S2O3+_____=Ag2S+_____
(8)根据以上实验,Na2S2O3与金属阳离子发生氧化还原反应和
您最近一年使用:0次
4 . 下列方程式与所给事实相符的是
A.常温下,0.1mol·L-1 H3PO4溶液pH约为3.1:H3PO4=3H++PO |
B.还原铁粉与水蒸气反应有可燃性气体产生:3Fe+4H2O(g) Fe3O4+4H2 Fe3O4+4H2 |
| C.向H218O中加入Na2O2,产生无色气体:2H218O+2Na2O2=4Na++4OH-+18O2↑ |
D.向NH4HSO4溶液中滴加过量NaOH溶液,产生无色气体:NH +OH-=NH3↑+H2O +OH-=NH3↑+H2O |
您最近一年使用:0次
名校
解题方法
5 . 回答下列问题。
(1)依据物质的性质分析:CaO、Na2O、Fe2O3、CuO均属于______ (填“酸性氧化物”、“碱性氧化物”或“两性氧化物”),下列物质均能与它们发生反应的是______ (填字母)。
a.水 b.盐酸 c.氢氧化钠溶液
(2)木炭与浓硫酸发生反应: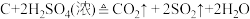 。作还原剂的物质是
。作还原剂的物质是______ ,硫元素的化合价______ (填“升高”或“降低”)。
(3)某反应中反应物与生成物的Fe3+、Mn2+、H+、 、H2O和一种未知离子X
、H2O和一种未知离子X
①已知 在反应中得到电子,则X是
在反应中得到电子,则X是______ 。
②该反应的离子方程式是______ 。
(1)依据物质的性质分析:CaO、Na2O、Fe2O3、CuO均属于
a.水 b.盐酸 c.氢氧化钠溶液
(2)木炭与浓硫酸发生反应:
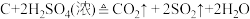 。作还原剂的物质是
。作还原剂的物质是(3)某反应中反应物与生成物的Fe3+、Mn2+、H+、
 、H2O和一种未知离子X
、H2O和一种未知离子X①已知
 在反应中得到电子,则X是
在反应中得到电子,则X是②该反应的离子方程式是
您最近一年使用:0次
解题方法
6 . 电解质在溶液中发生的反应属于离子反应。结合你的认识完成下列题目。
(1)从稀盐酸、Ba(OH)2溶液、Zn和CuSO4溶液中选出适当的物质,各写出实现下列要求的一个离子方程式。
①实验室制取H2的反应_______ ;
②金属与盐的置换反应_______ ;
③酸与碱的中和反应_______ ;
④生成沉淀的复分解反应_______ 。
(2)经检测,某工业废水显酸性,且废水中含有大量Na+、Cu2+、Cl-、SO 、NO
、NO 。
。
①下列离子中,不可能大量存在于该废水中的是_______ (填字母)。
A.K+ B. Ag+ C. Fe3+ D. CO
②若将该废水调节至碱性,原废水中存在的离子浓度下降的有_______ 。
③除去原废水中的Cu2+和SO ,所需试剂
,所需试剂_______ 。
(3)某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如图所示。
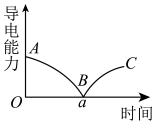
①写出Ba(OH)2溶液与稀硫酸反应的离子方程式_______ 。
②该小组的同学关于图的下列说法中,正确的是_______ (填字母)。
a.AB段溶液的导电能力不断减弱,说明电解质逐渐转变为非电解质
b.B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
c.BC段溶液的导电能力不断增大,主要是由于过量的Ba(OH)2电离出的离子导电
d.a时刻Ba(OH)2溶液与稀硫酸恰好完全中和
(4)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,配平其中一种方法的离子方程式:_______ 。
_______ClO-+_______Fe3++_______OH-=_______FeO +_______Cl-+_______H2O
+_______Cl-+_______H2O
(1)从稀盐酸、Ba(OH)2溶液、Zn和CuSO4溶液中选出适当的物质,各写出实现下列要求的一个离子方程式。
①实验室制取H2的反应
②金属与盐的置换反应
③酸与碱的中和反应
④生成沉淀的复分解反应
(2)经检测,某工业废水显酸性,且废水中含有大量Na+、Cu2+、Cl-、SO
 、NO
、NO 。
。①下列离子中,不可能大量存在于该废水中的是
A.K+ B. Ag+ C. Fe3+ D. CO

②若将该废水调节至碱性,原废水中存在的离子浓度下降的有
③除去原废水中的Cu2+和SO
 ,所需试剂
,所需试剂(3)某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如图所示。

①写出Ba(OH)2溶液与稀硫酸反应的离子方程式
②该小组的同学关于图的下列说法中,正确的是
a.AB段溶液的导电能力不断减弱,说明电解质逐渐转变为非电解质
b.B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
c.BC段溶液的导电能力不断增大,主要是由于过量的Ba(OH)2电离出的离子导电
d.a时刻Ba(OH)2溶液与稀硫酸恰好完全中和
(4)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,配平其中一种方法的离子方程式:
_______ClO-+_______Fe3++_______OH-=_______FeO
 +_______Cl-+_______H2O
+_______Cl-+_______H2O
您最近一年使用:0次
名校
解题方法
7 . 研究小组制备次氯酸钠(NaClO)、探究其性质并测定其物质的量浓度。
I.制备NaClO
实验装置如下图:

(1)A为氯气发生装置,反应为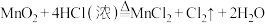 ,氧化剂与还原剂物质的量之比为
,氧化剂与还原剂物质的量之比为_________ 。
(2)B中饱和NaCl溶液的作用是________ 。
(3)C为NaClO制备装置,反应的离子方程式为_______ 。
Ⅱ.探究NaClO的性质
(4)从物质类别看,NaClO属于________ ,可能与某些酸反应。小组同学将红色纸条浸入NaClO溶液后,纸条褪色,向溶液中通入 后,褪色更加明显,说明NaClO与
后,褪色更加明显,说明NaClO与 和
和 生成
生成_______ (写化学式)。
(5)NaClO具有氧化性,预测依据是_______ 。小组同学向NaClO溶液中加入过量的KI溶液,加入适量稀硫酸,加入淀粉,溶液变蓝,无黄绿色气体产生。该反应的离子方程式为_______ 。
Ⅲ.测定NaClO溶液的物质的量浓度
步骤i:配制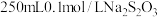 (摩尔质量为158g/mol)标准溶液。
(摩尔质量为158g/mol)标准溶液。
(6)计算需要 固体的质量是
固体的质量是_____ g。
(7)用到的仪器有:天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和_______ 。
(8)下列情况中,会使所配溶液浓度偏小的是___________ (填字母)。
a.配制溶液所用的容器中有蒸馏水 b.转移时,未洗涤烧杯和玻璃棒
c.定容时,眼睛仰视刻度线 d.摇匀后发现凹液面最低处低于刻度线
步骤ii:用 标准溶液通过实验测得250mLNaClO溶液与足量KI反应生成
标准溶液通过实验测得250mLNaClO溶液与足量KI反应生成 的物质的量为0.05mol。
的物质的量为0.05mol。
(9)计算NaClO溶液的物质的量浓度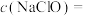
______ mol/L。
I.制备NaClO
实验装置如下图:

(1)A为氯气发生装置,反应为
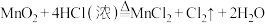 ,氧化剂与还原剂物质的量之比为
,氧化剂与还原剂物质的量之比为(2)B中饱和NaCl溶液的作用是
(3)C为NaClO制备装置,反应的离子方程式为
Ⅱ.探究NaClO的性质
(4)从物质类别看,NaClO属于
 后,褪色更加明显,说明NaClO与
后,褪色更加明显,说明NaClO与 和
和 生成
生成(5)NaClO具有氧化性,预测依据是
Ⅲ.测定NaClO溶液的物质的量浓度
步骤i:配制
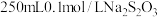 (摩尔质量为158g/mol)标准溶液。
(摩尔质量为158g/mol)标准溶液。(6)计算需要
 固体的质量是
固体的质量是(7)用到的仪器有:天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和
(8)下列情况中,会使所配溶液浓度偏小的是
a.配制溶液所用的容器中有蒸馏水 b.转移时,未洗涤烧杯和玻璃棒
c.定容时,眼睛仰视刻度线 d.摇匀后发现凹液面最低处低于刻度线
步骤ii:用
 标准溶液通过实验测得250mLNaClO溶液与足量KI反应生成
标准溶液通过实验测得250mLNaClO溶液与足量KI反应生成 的物质的量为0.05mol。
的物质的量为0.05mol。(9)计算NaClO溶液的物质的量浓度
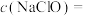
您最近一年使用:0次
解题方法
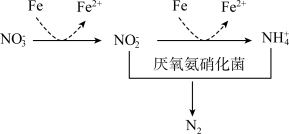
8 . 氮及其化合物在农业、医药、国防等领域应用广泛。请回答下列问题
(1)实验室加热 和
和  固体混合物制取
固体混合物制取  ,反应的化学方程式是
,反应的化学方程式是___________ 。
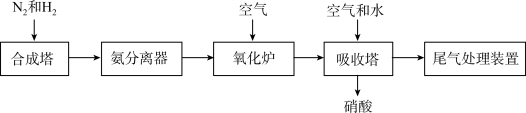
(2)工业合成氨及氨氧化制取硝酸的流程示意图如下。
①合成塔中生成 ,说明
,说明  具有
具有___________ (填“氧化性”或“还原性”)。
②氧化炉中 转化为
转化为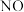 ,发生反应的化学方程式是
,发生反应的化学方程式是___________ 。
③吸收塔中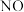 最终可转化为
最终可转化为  。通入空气是为了提供
。通入空气是为了提供___________ (填字母)。
a. b.
b. c.
c.
④尾气处理装置中,可用 将尾气中
将尾气中  还原为
还原为  。反应的化学方程式是
。反应的化学方程式是___________ 。
(3)氮元素含量过高会造成水体污染,添加铁粉能够提高氮的脱除率,工艺如下图所示。试从价态角度分析原因___________ 。
(1)实验室加热
 和
和  固体混合物制取
固体混合物制取  ,反应的化学方程式是
,反应的化学方程式是(2)工业合成氨及氨氧化制取硝酸的流程示意图如下。

①合成塔中生成
 ,说明
,说明  具有
具有②氧化炉中
 转化为
转化为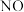 ,发生反应的化学方程式是
,发生反应的化学方程式是③吸收塔中
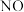 最终可转化为
最终可转化为  。通入空气是为了提供
。通入空气是为了提供a.
 b.
b. c.
c.
④尾气处理装置中,可用
 将尾气中
将尾气中  还原为
还原为  。反应的化学方程式是
。反应的化学方程式是(3)氮元素含量过高会造成水体污染,添加铁粉能够提高氮的脱除率,工艺如下图所示。试从价态角度分析原因

您最近一年使用:0次
名校
9 . 某小组同学探究不同条件下氯气与二价锰化合物的反应
资料:
ⅰ. 在一定条件下被
在一定条件下被  或
或 氧化成
氧化成  (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
ⅱ.浓碱条件下, 可被
可被  还原为
还原为  。
。
ⅲ. 的氧化性与溶液的酸碱性无关,
的氧化性与溶液的酸碱性无关, 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)
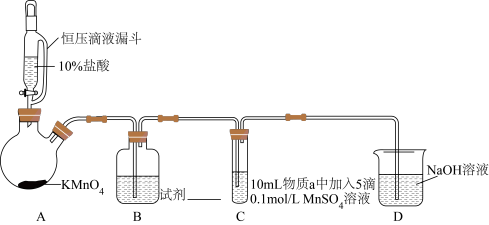
(1) 装置中制备
装置中制备  的化学反应方程式是
的化学反应方程式是__________ 。
(2) 中试剂是
中试剂是__________ 。
(3)通入 前,Ⅱ、Ⅲ中沉淀由白色变为黑色的化学方程式为
前,Ⅱ、Ⅲ中沉淀由白色变为黑色的化学方程式为__________ 。
(4)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符原因:
原因一:可能是通入 导致溶液的碱性减弱。
导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为  。
。
①化学方程式表示可能导致溶液碱性减弱的原因__________ ,但通过实验测定溶液的碱性变化很小。
②取Ⅲ中放置后的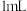 悬浊液,加入
悬浊液,加入 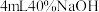 溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为__________ ,溶液绿色缓慢加深,原因是  被
被__________ (填化学式)氧化,可证明Ⅲ的悬浊液中氧化剂过量;
③取Ⅱ中放置后的 悬浊液,加入
悬浊液,加入  水,溶液紫色缓慢加深,发生的反应是
水,溶液紫色缓慢加深,发生的反应是__________ 。
资料:
ⅰ.
 在一定条件下被
在一定条件下被  或
或 氧化成
氧化成  (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。ⅱ.浓碱条件下,
 可被
可被  还原为
还原为  。
。ⅲ.
 的氧化性与溶液的酸碱性无关,
的氧化性与溶液的酸碱性无关, 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。实验装置如图(夹持装置略)

序号 | 物质 | C中实验现象 | |
通入 | 通入 | ||
Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
Ⅱ |
| 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
Ⅲ |
| 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(1)
 装置中制备
装置中制备  的化学反应方程式是
的化学反应方程式是(2)
 中试剂是
中试剂是(3)通入
 前,Ⅱ、Ⅲ中沉淀由白色变为黑色的化学方程式为
前,Ⅱ、Ⅲ中沉淀由白色变为黑色的化学方程式为(4)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符原因:
原因一:可能是通入
 导致溶液的碱性减弱。
导致溶液的碱性减弱。原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为  。
。①化学方程式表示可能导致溶液碱性减弱的原因
②取Ⅲ中放置后的
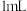 悬浊液,加入
悬浊液,加入 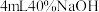 溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为 被
被③取Ⅱ中放置后的
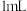 悬浊液,加入
悬浊液,加入  水,溶液紫色缓慢加深,发生的反应是
水,溶液紫色缓慢加深,发生的反应是
您最近一年使用:0次
名校
10 . 用含有 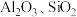 和少量
和少量 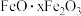 的铝灰制备
的铝灰制备  ,工艺流程如下(部分操作和条件略):
,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀 ,过滤;
,过滤;
Ⅱ.向滤液中加入过量 溶液,调节溶液的
溶液,调节溶液的  约为3,生成红褐色沉淀;
约为3,生成红褐色沉淀;
Ⅲ.静置,上层溶液呈紫红色;
Ⅳ.加入 至紫红色消失,过滤;
至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
资料: 是酸性氧化物,能与碱反应,不与酸反应。
是酸性氧化物,能与碱反应,不与酸反应。
(1) 溶解铝灰涉及的离子反应方程式有
溶解铝灰涉及的离子反应方程式有_________________ 、_________________ 。
(2)将 氧化
氧化  离子方程式补充完整:
离子方程式补充完整:_________________
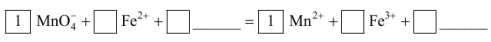
(3)已知:一定条件下, 可与
可与  反应生成
反应生成  。
。
①向Ⅲ的沉淀中加入浓 并加热,能说明沉淀中存在
并加热,能说明沉淀中存在  的现象是
的现象是_____________________________________ 。
②Ⅳ中加入 的目的是
的目的是_____________________________________ 。
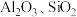 和少量
和少量 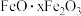 的铝灰制备
的铝灰制备  ,工艺流程如下(部分操作和条件略):
,工艺流程如下(部分操作和条件略):Ⅰ.向铝灰中加入过量稀
 ,过滤;
,过滤;Ⅱ.向滤液中加入过量
 溶液,调节溶液的
溶液,调节溶液的  约为3,生成红褐色沉淀;
约为3,生成红褐色沉淀;Ⅲ.静置,上层溶液呈紫红色;
Ⅳ.加入
 至紫红色消失,过滤;
至紫红色消失,过滤;Ⅴ.浓缩、结晶、分离,得到产品。
资料:
 是酸性氧化物,能与碱反应,不与酸反应。
是酸性氧化物,能与碱反应,不与酸反应。(1)
 溶解铝灰涉及的离子反应方程式有
溶解铝灰涉及的离子反应方程式有(2)将
 氧化
氧化  离子方程式补充完整:
离子方程式补充完整: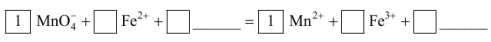
(3)已知:一定条件下,
 可与
可与  反应生成
反应生成  。
。①向Ⅲ的沉淀中加入浓
 并加热,能说明沉淀中存在
并加热,能说明沉淀中存在  的现象是
的现象是②Ⅳ中加入
 的目的是
的目的是
您最近一年使用:0次


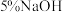 溶液
溶液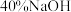 溶液
溶液

