名校
解题方法
1 . 氯气是氯碱工业的主要产品之一,是一种常用的消毒刹,其消毒原理是与水反应生成了次氯酸,次氯酸的强氧化性能杀死水中的病菌。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代。请回答:
(1)氯气与水反应的离子方程式为______________________________ 。
(2)将氯气通入淀粉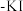 溶液中,溶液变蓝,写出反应的离子方程式
溶液中,溶液变蓝,写出反应的离子方程式____________________ ;继续通入氯气,蓝色消失,原因是: ,该反应体现了氯气的
,该反应体现了氯气的__________ 性。
(3)泳池用含氯物质消毒时,需要保证一定量的余氯,若水中的余氯以次氯酸形式存在,再加入 进行消毒反而会导致藻类生长,池水变绿。写出次氯酸与
进行消毒反而会导致藻类生长,池水变绿。写出次氯酸与 发生反应生成盐酸的化学方程式
发生反应生成盐酸的化学方程式____________________ 。
(4)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为_________________________ 。
(5)二氧化氯( )是国际上公认为安全、.无毒的绿色消毒剂。工业上制取
)是国际上公认为安全、.无毒的绿色消毒剂。工业上制取 的化学方程式如下:
的化学方程式如下: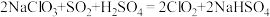 。按要求回答下列问题:
。按要求回答下列问题:
①该反应的离子方程式为____________________ 。
②另一种制备 的方法是用
的方法是用 与盐酸反应,同时有
与盐酸反应,同时有 生成,产物中
生成,产物中 与
与 的物质的量之比为
的物质的量之比为 ,则每生成
,则每生成 ,转移
,转移_________ 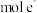 。
。
(1)氯气与水反应的离子方程式为
(2)将氯气通入淀粉
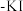 溶液中,溶液变蓝,写出反应的离子方程式
溶液中,溶液变蓝,写出反应的离子方程式 ,该反应体现了氯气的
,该反应体现了氯气的(3)泳池用含氯物质消毒时,需要保证一定量的余氯,若水中的余氯以次氯酸形式存在,再加入
 进行消毒反而会导致藻类生长,池水变绿。写出次氯酸与
进行消毒反而会导致藻类生长,池水变绿。写出次氯酸与 发生反应生成盐酸的化学方程式
发生反应生成盐酸的化学方程式(4)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为
(5)二氧化氯(
 )是国际上公认为安全、.无毒的绿色消毒剂。工业上制取
)是国际上公认为安全、.无毒的绿色消毒剂。工业上制取 的化学方程式如下:
的化学方程式如下: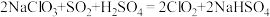 。按要求回答下列问题:
。按要求回答下列问题:①该反应的离子方程式为
②另一种制备
 的方法是用
的方法是用 与盐酸反应,同时有
与盐酸反应,同时有 生成,产物中
生成,产物中 与
与 的物质的量之比为
的物质的量之比为 ,则每生成
,则每生成 ,转移
,转移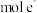 。
。
您最近一年使用:0次
名校
解题方法
2 . 高铁酸钾( ,其中Fe元素为+6价)是新型绿色水处理剂,其制备方法如下图所示(部分步骤已略去)。
,其中Fe元素为+6价)是新型绿色水处理剂,其制备方法如下图所示(部分步骤已略去)。
已知:在碱性溶液中的溶解度: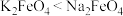
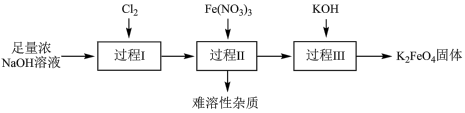
(1)过程Ⅰ的目的是制备 ,
, 中氯元素的化合价为
中氯元素的化合价为______ 。
(2)过程Ⅱ为碱性条件下制备高铁酸钠(Na2FeO4)。
①补全过程Ⅱ中发生反应的离子方程式:____
 。
。
②除 外,过程Ⅱ中还可能生成一种含铁元素的难溶性杂质,该物质的化学式为
外,过程Ⅱ中还可能生成一种含铁元素的难溶性杂质,该物质的化学式为_____ 。
(3)过程Ⅲ中,发生反应的化学方程式为______ 。
(4)过程Ⅰ~Ⅲ中,需要进行过滤操作的是______ (填序号)。
(5) 可将氨氮废水中的
可将氨氮废水中的 转化为
转化为 除去。从价态角度分析,
除去。从价态角度分析, 能处理氨氮废水的原因是
能处理氨氮废水的原因是______ 。
 ,其中Fe元素为+6价)是新型绿色水处理剂,其制备方法如下图所示(部分步骤已略去)。
,其中Fe元素为+6价)是新型绿色水处理剂,其制备方法如下图所示(部分步骤已略去)。已知:在碱性溶液中的溶解度:
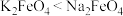

(1)过程Ⅰ的目的是制备
 ,
, 中氯元素的化合价为
中氯元素的化合价为(2)过程Ⅱ为碱性条件下制备高铁酸钠(Na2FeO4)。
①补全过程Ⅱ中发生反应的离子方程式:
 。
。②除
 外,过程Ⅱ中还可能生成一种含铁元素的难溶性杂质,该物质的化学式为
外,过程Ⅱ中还可能生成一种含铁元素的难溶性杂质,该物质的化学式为(3)过程Ⅲ中,发生反应的化学方程式为
(4)过程Ⅰ~Ⅲ中,需要进行过滤操作的是
(5)
 可将氨氮废水中的
可将氨氮废水中的 转化为
转化为 除去。从价态角度分析,
除去。从价态角度分析, 能处理氨氮废水的原因是
能处理氨氮废水的原因是
您最近一年使用:0次
名校
3 .  是一种高效多功能的新型消毒剂。
是一种高效多功能的新型消毒剂。
已知: 微溶于水,在酸性或中性溶液中快速分解产生
微溶于水,在酸性或中性溶液中快速分解产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)一种制备 的方法如下。
的方法如下。

①若以铅蓄电池为电源,则铂片应与___________ 极相连(填Pb或 )。
)。
②生成 的电极反应式:
的电极反应式:___________ 。
③阴极室KOH的浓度提高,结合电极反应式解释原因:___________ 。
(2)向含 的溶液中加入KOH固体,析出
的溶液中加入KOH固体,析出 固体,再用稀KOH溶液洗涤,得到
固体,再用稀KOH溶液洗涤,得到 粗品。用化学方程式解释不能用水洗涤
粗品。用化学方程式解释不能用水洗涤 的原因:
的原因:___________ 。
(3)电解1.5h后,测得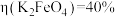 ,
,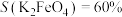
已知: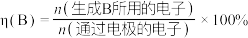
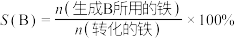
①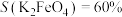 ,说明除
,说明除 之外,还有其他含铁物质生成。经检验,阳极产物中含铁物质仅有
之外,还有其他含铁物质生成。经检验,阳极产物中含铁物质仅有 和FeOOH,则
和FeOOH,则
___________ 。
②判断阳极有水(或 )放电,判断依据:
)放电,判断依据:
ⅰ.水(或 )有还原性;
)有还原性;
ⅱ.___________ 。
 是一种高效多功能的新型消毒剂。
是一种高效多功能的新型消毒剂。已知:
 微溶于水,在酸性或中性溶液中快速分解产生
微溶于水,在酸性或中性溶液中快速分解产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(1)一种制备
 的方法如下。
的方法如下。
①若以铅蓄电池为电源,则铂片应与
 )。
)。②生成
 的电极反应式:
的电极反应式:③阴极室KOH的浓度提高,结合电极反应式解释原因:
(2)向含
 的溶液中加入KOH固体,析出
的溶液中加入KOH固体,析出 固体,再用稀KOH溶液洗涤,得到
固体,再用稀KOH溶液洗涤,得到 粗品。用化学方程式解释不能用水洗涤
粗品。用化学方程式解释不能用水洗涤 的原因:
的原因:(3)电解1.5h后,测得
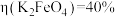 ,
,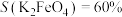
已知:
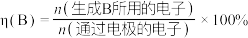
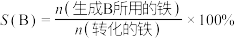
①
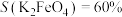 ,说明除
,说明除 之外,还有其他含铁物质生成。经检验,阳极产物中含铁物质仅有
之外,还有其他含铁物质生成。经检验,阳极产物中含铁物质仅有 和FeOOH,则
和FeOOH,则
②判断阳极有水(或
 )放电,判断依据:
)放电,判断依据:ⅰ.水(或
 )有还原性;
)有还原性;ⅱ.
您最近一年使用:0次
名校
解题方法
4 . 实验小组制备硫代硫酸钠(Na2S2O3)并探究其性质。
资料:ⅰ. 。
。
ⅱ.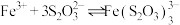 (紫黑色)。
(紫黑色)。
ⅲ. 是难溶于水、可溶于
是难溶于水、可溶于 溶液的白色固体。
溶液的白色固体。
(1)实验室可利用反应: 制备
制备 ,装置如下图。
,装置如下图。
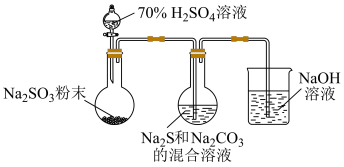
①用化学用语解释 和
和 的混合溶液呈碱性的原因:
的混合溶液呈碱性的原因: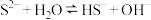 、
、___________ 。
②为了保证 的产量,实验中通入的
的产量,实验中通入的 不能过量。要控制
不能过量。要控制 的生成速率,可以采取的措施有:
的生成速率,可以采取的措施有:___________ (写出一条)。
(2)探究 溶液与不同金属的硫酸盐溶液间反应的多样性。
溶液与不同金属的硫酸盐溶液间反应的多样性。
①Ⅰ中产生白色沉淀的离子方程式为___________ 。
②经检验,现象Ⅱ中的沉淀有 和
和 ,用平衡移动原理解释Ⅱ中的现象:
,用平衡移动原理解释Ⅱ中的现象:___________ 。
③经检验,现象Ⅲ中的无色溶液中含有 。Ⅲ中溶液变为无色的离子方程式为
。Ⅲ中溶液变为无色的离子方程式为___________ 。
④从化学反应速率和限度的角度解释Ⅲ中 与
与 反应的实验现象:
反应的实验现象:___________ 。
以上实验说明: 溶液与金属阳离子反应的多样性和阳离子的性质有关。
溶液与金属阳离子反应的多样性和阳离子的性质有关。
资料:ⅰ.
 。
。ⅱ.
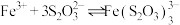 (紫黑色)。
(紫黑色)。ⅲ.
 是难溶于水、可溶于
是难溶于水、可溶于 溶液的白色固体。
溶液的白色固体。(1)实验室可利用反应:
 制备
制备 ,装置如下图。
,装置如下图。
①用化学用语解释
 和
和 的混合溶液呈碱性的原因:
的混合溶液呈碱性的原因: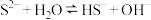 、
、②为了保证
 的产量,实验中通入的
的产量,实验中通入的 不能过量。要控制
不能过量。要控制 的生成速率,可以采取的措施有:
的生成速率,可以采取的措施有:(2)探究
 溶液与不同金属的硫酸盐溶液间反应的多样性。
溶液与不同金属的硫酸盐溶液间反应的多样性。| 实验 | 试剂 | 现象 | |
| 试管 | 滴管 | ||
 |  溶液 溶液 |  溶液(浓度约为 溶液(浓度约为 ) ) | Ⅰ.局部生成白色沉淀,振荡后沉淀溶解,得到无色溶液 |
 溶液 溶液 | Ⅱ.一段时间后,生成沉淀 | ||
 溶液 溶液 | Ⅲ.混合后溶液先变成紫黑色, 时溶液几乎变为无色 时溶液几乎变为无色 | ||
②经检验,现象Ⅱ中的沉淀有
 和
和 ,用平衡移动原理解释Ⅱ中的现象:
,用平衡移动原理解释Ⅱ中的现象:③经检验,现象Ⅲ中的无色溶液中含有
 。Ⅲ中溶液变为无色的离子方程式为
。Ⅲ中溶液变为无色的离子方程式为④从化学反应速率和限度的角度解释Ⅲ中
 与
与 反应的实验现象:
反应的实验现象:以上实验说明:
 溶液与金属阳离子反应的多样性和阳离子的性质有关。
溶液与金属阳离子反应的多样性和阳离子的性质有关。
您最近一年使用:0次
名校
5 . 硫化氢的转化是资源利用和环境保护的重要研究课题。将 和空气的混合气体通入
和空气的混合气体通入 和
和 的混合溶液中回收S,其转化如下图所示(
的混合溶液中回收S,其转化如下图所示( 不溶于水)。下列说法中,
不溶于水)。下列说法中,不正确 的是
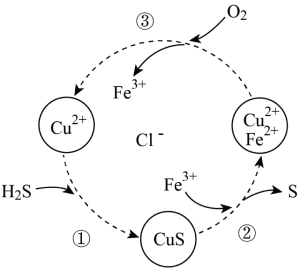
 和空气的混合气体通入
和空气的混合气体通入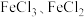 和
和 的混合溶液中回收S,其转化如下图所示(
的混合溶液中回收S,其转化如下图所示( 不溶于水)。下列说法中,
不溶于水)。下列说法中,
A.过程①中,生成 的反应为 的反应为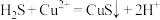 |
| B.过程②中,S是氧化产物 |
| C.过程③中,各元素化合价均未改变 |
D.回收S的总反应为 |
您最近一年使用:0次
6 . 某小组同学探究不同条件下氯气与二价锰化合物的反应
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
ii.浓碱条件下, 可被OH-还原为
可被OH-还原为 。
。
iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)
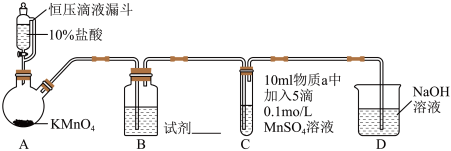
(1)实验室中利用MnO2和浓盐酸加热的反应来制取氯气,对比本实验A中的反应,说明氧化性MnO2_______ KMnO4(填“>”或“<”)。
(2)B中试剂是_______ 。(填序号)
①浓硫酸 ②饱和食盐水
(3)通入Cl2前,Ⅱ、Ⅲ中沉淀由白色[Mn(OH)2]变为棕黑色,补全发生反应的化学方程式:___________ 。
Mn(OH)2+_______=________+H2O
(4)对比实验I、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是:
①__________ ;
②在碱性条件下可以被氧化到更高价态。
(5)根据资料ii,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因___________ ,但通过实验测定,溶液的碱性变化很小。
②针对原因二小组同学做如下探究:
Ⅳ中溶液紫色迅速变为绿色的离子方程式为_________ 。
 +OH-=
+OH-= +___________+___________。
+___________+___________。
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、
 (绿色)、
(绿色)、 (紫色)。
(紫色)。ii.浓碱条件下,
 可被OH-还原为
可被OH-还原为 。
。iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)

| 序号 | I | Ⅱ | Ⅲ |
| 物质a | 水 | 5%NaOH溶液 | 40%NaOH溶液 |
| 通入Cl2前 C中实验现象 | 得到无色溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 |
| 通入Cl2后 C中实验现象 | 产生棕黑色沉淀,且放置后不发生变化 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(1)实验室中利用MnO2和浓盐酸加热的反应来制取氯气,对比本实验A中的反应,说明氧化性MnO2
(2)B中试剂是
①浓硫酸 ②饱和食盐水
(3)通入Cl2前,Ⅱ、Ⅲ中沉淀由白色[Mn(OH)2]变为棕黑色,补全发生反应的化学方程式:
Mn(OH)2+_______=________+H2O
(4)对比实验I、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是:
①
②在碱性条件下可以被氧化到更高价态。
(5)根据资料ii,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①用化学方程式表示可能导致溶液碱性减弱的原因
②针对原因二小组同学做如下探究:
| 序号 | Ⅳ | Ⅴ |
| 操作 | 取Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液 | 取Ⅲ中放置后的1mL悬浊液,加入4mL水, |
| 现象 | 溶液紫色迅速变为绿色,且绿色缓慢加深 | 溶液紫色缓慢加深 |
 +OH-=
+OH-= +___________+___________。
+___________+___________。
您最近一年使用:0次
7 . 为探究Na2O2的强氧化性,某小组设计了如图所示的实验。
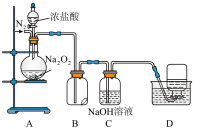
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,A中剧烈反应,有黄绿色气体产生。
③待产生连续气泡后,将装置D中的导管末端伸入集气瓶中,收集到无色气体。
④反应一段时间后,关闭分液漏斗的活塞,再通一段时间N2,直至装置中气体变为无色。
回答下列问题:
(1)D中气体能使带火星的木条复燃,该气体是_______ 。该气体不可能由HCl还原Na2O2所得,从氧化还原角度说明理由:_______ 。
(2)B中湿润的淀粉KI试纸变蓝。
①甲同学根据A中气体的颜色推测试纸变蓝时发生的反应是(写离子方程式)_______ 。
②乙同学认为使试纸变蓝的原因还可能是_______ 。
(3)资料显示,Na2O2也能与干燥HCl反应产生Cl2,写出反应的化学方程式_______ 。

实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,A中剧烈反应,有黄绿色气体产生。
③待产生连续气泡后,将装置D中的导管末端伸入集气瓶中,收集到无色气体。
④反应一段时间后,关闭分液漏斗的活塞,再通一段时间N2,直至装置中气体变为无色。
回答下列问题:
(1)D中气体能使带火星的木条复燃,该气体是
(2)B中湿润的淀粉KI试纸变蓝。
①甲同学根据A中气体的颜色推测试纸变蓝时发生的反应是(写离子方程式)
②乙同学认为使试纸变蓝的原因还可能是
(3)资料显示,Na2O2也能与干燥HCl反应产生Cl2,写出反应的化学方程式
您最近一年使用:0次
名校
8 . 氧化钻(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。
某铜钻矿石主要含有CoO(OH)、CoCO3、Cu(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺过程如下:
Ⅰ、将粉碎的矿石用过量的稀H2SO4和Na2SO4溶液浸泡。
Ⅱ、浸出液除去含铜的化合物后,向溶液中先加入NaClO3溶液,再加入一定浓度的Na2CO3溶液,过滤,分离除去沉淀a[主要成分是Na2Fe6(SO4)4(OH)12]。
Ⅲ、向上述滤液中加入足量NaF溶液,过滤,分离除去沉淀b.
Ⅳ、Ⅲ中滤液加入浓Na2CO3溶液,获得CoCO3沉淀。
V、将CoCO3溶解在盐酸中,再加入(NH4)2C2O4溶液,产生CoC2O4·2H2O沉淀。分离出沉淀,将其在400℃~600℃煅烧,即得Co2O3
请回答:
(1)I中,稀硫酸溶解CoCO3的化学方程式是_____ 。
(2)根据图1、图2分析:
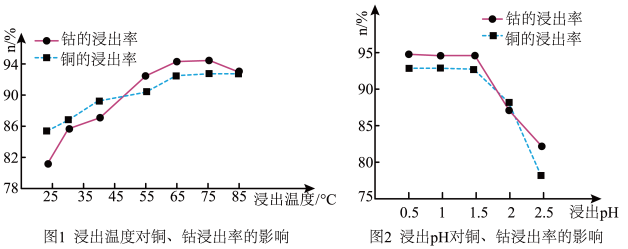
矿石粉末浸泡的适宜条件应是_____ 。
(3)Ⅱ中,漫出液中的金属离子与NaClO3反应的离子方程式:_____ 。
ClO +_____+_____ =Cl-+_____+_____
+_____+_____ =Cl-+_____+_____
(4)Ⅱ中,检验铁元素完全除去的试剂是_____ 。实验现象是 _____ 。
(5)Ⅱ、Ⅳ中,加Na2CO3的作用分别是_____ 、_____ 。
(6)V中,分离出纯净的CoC2O4⋅2H2O的操作是_____ 。
某铜钻矿石主要含有CoO(OH)、CoCO3、Cu(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺过程如下:
Ⅰ、将粉碎的矿石用过量的稀H2SO4和Na2SO4溶液浸泡。
Ⅱ、浸出液除去含铜的化合物后,向溶液中先加入NaClO3溶液,再加入一定浓度的Na2CO3溶液,过滤,分离除去沉淀a[主要成分是Na2Fe6(SO4)4(OH)12]。
Ⅲ、向上述滤液中加入足量NaF溶液,过滤,分离除去沉淀b.
Ⅳ、Ⅲ中滤液加入浓Na2CO3溶液,获得CoCO3沉淀。
V、将CoCO3溶解在盐酸中,再加入(NH4)2C2O4溶液,产生CoC2O4·2H2O沉淀。分离出沉淀,将其在400℃~600℃煅烧,即得Co2O3
请回答:
(1)I中,稀硫酸溶解CoCO3的化学方程式是
(2)根据图1、图2分析:

矿石粉末浸泡的适宜条件应是
(3)Ⅱ中,漫出液中的金属离子与NaClO3反应的离子方程式:
ClO
 +_____+_____ =Cl-+_____+_____
+_____+_____ =Cl-+_____+_____(4)Ⅱ中,检验铁元素完全除去的试剂是
(5)Ⅱ、Ⅳ中,加Na2CO3的作用分别是
(6)V中,分离出纯净的CoC2O4⋅2H2O的操作是
您最近一年使用:0次
名校
解题方法
9 . 工业制硝酸的尾气中含N2O、NO和NO2等氧化物是空气污染物,含有氢氧化物的尾气需处理后才能排放。
Ⅰ、工业制硝酸:
(1)氨催化氧化法是工业制硝酸的基础反应,写出氨催化氧化的化学方程式为_____ 。
Ⅱ、含氮氧化物的尾气处理:
(2)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂使N2O分解,N2O分解的化学方程式为_____ 。
(3)用NaClO溶液吸收尾气。用NaClO溶液代替NaOH溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为NO3-的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。

①在酸性NaClO溶液中,HClO氧化NO生成NO3-时发生反应的离子方程式为_____ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是_____ 。
Ⅰ、工业制硝酸:
(1)氨催化氧化法是工业制硝酸的基础反应,写出氨催化氧化的化学方程式为
Ⅱ、含氮氧化物的尾气处理:
(2)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂使N2O分解,N2O分解的化学方程式为
(3)用NaClO溶液吸收尾气。用NaClO溶液代替NaOH溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为NO3-的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。

①在酸性NaClO溶液中,HClO氧化NO生成NO3-时发生反应的离子方程式为
②NaClO溶液的初始pH越小,NO转化率越高。其原因是
您最近一年使用:0次
10 . 某校化学兴趣小组为验证 的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的红色纸条,b为湿润的红色纸条。
的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的红色纸条,b为湿润的红色纸条。
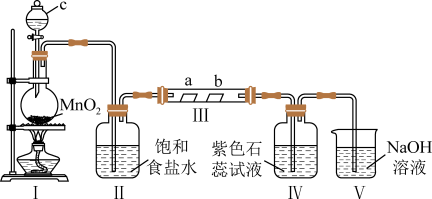
(1)装置Ⅰ中仪器c的名称是______ ,实验室用 和浓盐酸制备
和浓盐酸制备 的化学方程式为
的化学方程式为______ 。
(2)装置Ⅱ的作用是______ 。
(3)若实验中产生的 足量,装置Ⅳ中的实验现象
足量,装置Ⅳ中的实验现象______ 。
(4)写出装置Ⅴ中反应的离子方程式______ 。
(5)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加图中的______ 装置(填序号)。
①
 溶液 ②
溶液 ② 碱石灰
碱石灰
③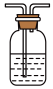
 溶液 ④
溶液 ④ 浓硫酸
浓硫酸
(6)可用 和
和 制备的漂粉精
制备的漂粉精
①漂粉精常用于游泳池的消毒,起消毒作用的是 。漂粉精在水中释放
。漂粉精在水中释放 的途径主要是:
的途径主要是:
______ (把反应补充完整)。
②池水的酸碱性对漂粉精的消毒效果影响明显。
a.若池水碱性过强,杀毒作用会______ (填“增强”或“减弱”)。
b.若池水酸性过强,会刺激眼睛和皮肤。有时加入 、
、 以降低酸性,起到降低酸性作用的离子分别是
以降低酸性,起到降低酸性作用的离子分别是______ (填离子符号)。
③漂白精中的 在碱性条件下能够制备新型净水剂——高铁酸钾
在碱性条件下能够制备新型净水剂——高铁酸钾 ,补全下面的离子方程式:
,补全下面的离子方程式:______ 。




 ______=
______=

 ______+
______+ ______
______
 的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的红色纸条,b为湿润的红色纸条。
的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的红色纸条,b为湿润的红色纸条。
(1)装置Ⅰ中仪器c的名称是
 和浓盐酸制备
和浓盐酸制备 的化学方程式为
的化学方程式为(2)装置Ⅱ的作用是
(3)若实验中产生的
 足量,装置Ⅳ中的实验现象
足量,装置Ⅳ中的实验现象(4)写出装置Ⅴ中反应的离子方程式
(5)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加图中的
①

 溶液 ②
溶液 ② 碱石灰
碱石灰③

 溶液 ④
溶液 ④ 浓硫酸
浓硫酸(6)可用
 和
和 制备的漂粉精
制备的漂粉精①漂粉精常用于游泳池的消毒,起消毒作用的是
 。漂粉精在水中释放
。漂粉精在水中释放 的途径主要是:
的途径主要是:
②池水的酸碱性对漂粉精的消毒效果影响明显。
a.若池水碱性过强,杀毒作用会
b.若池水酸性过强,会刺激眼睛和皮肤。有时加入
 、
、 以降低酸性,起到降低酸性作用的离子分别是
以降低酸性,起到降低酸性作用的离子分别是③漂白精中的
 在碱性条件下能够制备新型净水剂——高铁酸钾
在碱性条件下能够制备新型净水剂——高铁酸钾 ,补全下面的离子方程式:
,补全下面的离子方程式:



 ______=
______=

 ______+
______+ ______
______
您最近一年使用:0次



