名校
解题方法
1 . 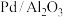 是常见的汽车尾气催化剂。一种废
是常见的汽车尾气催化剂。一种废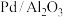 纳米催化剂主要成分及含量:Pd 0.3%,
纳米催化剂主要成分及含量:Pd 0.3%, 92.8%,
92.8%, 5.0%,Co、Pt和炭共约1.0%。采用如下工艺从中提取金属Co和Pd。
5.0%,Co、Pt和炭共约1.0%。采用如下工艺从中提取金属Co和Pd。

(1)“酸浸②”时,Pt和Pd分别转化为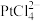 和
和 ,写出Pd转化为
,写出Pd转化为 的离子方程式
的离子方程式_______ 。
(2)“酸浸②”时,可用NaClO替代 ,写出用NaClO酸浸Pd的离子方程式
,写出用NaClO酸浸Pd的离子方程式_______ 。
(3)酸浸②在一定温度下充分浸取钯,得到氯亚钯酸(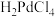 )溶液,钯的浸出率与反应的温度、HCl浓度的关系如图所示。最佳的浸取温度和HCl浓度分别为
)溶液,钯的浸出率与反应的温度、HCl浓度的关系如图所示。最佳的浸取温度和HCl浓度分别为_______ 。

(4)“络合”过程后得到 和
和 ,“沉淀”时,搅拌滴加盐酸调节pH将
,“沉淀”时,搅拌滴加盐酸调节pH将 转化为
转化为 沉淀,结合平衡移动原理解释实现该转化的原因
沉淀,结合平衡移动原理解释实现该转化的原因_______ 。
(5)已知:常温下, ,
, 。若滤液①中
。若滤液①中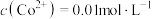 ,则分离出
,则分离出 沉淀需调节pH不低于
沉淀需调节pH不低于_______ (当离子浓度小于 时认为已沉淀完全),调节pH可以选择的最佳物质是
时认为已沉淀完全),调节pH可以选择的最佳物质是_______ (填序号)
A. B.NaOH C.CoO D.
B.NaOH C.CoO D.
(6)方法2氰化浸出中Pd转化为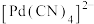 的离子方程式为
的离子方程式为_______ ;判断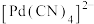 中的配位原子,并解释原因
中的配位原子,并解释原因_______ 。
 是常见的汽车尾气催化剂。一种废
是常见的汽车尾气催化剂。一种废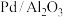 纳米催化剂主要成分及含量:Pd 0.3%,
纳米催化剂主要成分及含量:Pd 0.3%, 92.8%,
92.8%, 5.0%,Co、Pt和炭共约1.0%。采用如下工艺从中提取金属Co和Pd。
5.0%,Co、Pt和炭共约1.0%。采用如下工艺从中提取金属Co和Pd。
(1)“酸浸②”时,Pt和Pd分别转化为
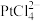 和
和 ,写出Pd转化为
,写出Pd转化为 的离子方程式
的离子方程式(2)“酸浸②”时,可用NaClO替代
 ,写出用NaClO酸浸Pd的离子方程式
,写出用NaClO酸浸Pd的离子方程式(3)酸浸②在一定温度下充分浸取钯,得到氯亚钯酸(
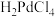 )溶液,钯的浸出率与反应的温度、HCl浓度的关系如图所示。最佳的浸取温度和HCl浓度分别为
)溶液,钯的浸出率与反应的温度、HCl浓度的关系如图所示。最佳的浸取温度和HCl浓度分别为
(4)“络合”过程后得到
 和
和 ,“沉淀”时,搅拌滴加盐酸调节pH将
,“沉淀”时,搅拌滴加盐酸调节pH将 转化为
转化为 沉淀,结合平衡移动原理解释实现该转化的原因
沉淀,结合平衡移动原理解释实现该转化的原因(5)已知:常温下,
 ,
, 。若滤液①中
。若滤液①中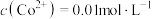 ,则分离出
,则分离出 沉淀需调节pH不低于
沉淀需调节pH不低于 时认为已沉淀完全),调节pH可以选择的最佳物质是
时认为已沉淀完全),调节pH可以选择的最佳物质是A.
 B.NaOH C.CoO D.
B.NaOH C.CoO D.
(6)方法2氰化浸出中Pd转化为
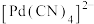 的离子方程式为
的离子方程式为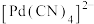 中的配位原子,并解释原因
中的配位原子,并解释原因
您最近一年使用:0次
名校
2 . 去除废水中含氮离子是目前水质改善的热点研究课题,常见的化学方法是用 将含氮离子还原为氮气或先用臭氧、双氧水、次氯酸钠等氧化
将含氮离子还原为氮气或先用臭氧、双氧水、次氯酸钠等氧化 ,再用还原剂除去。去除废水中含有的
,再用还原剂除去。去除废水中含有的 、
、 的一种原理如下:
的一种原理如下: (Ⅰ),
(Ⅰ), (Ⅱ)。下列说法不正确的是
(Ⅱ)。下列说法不正确的是
 将含氮离子还原为氮气或先用臭氧、双氧水、次氯酸钠等氧化
将含氮离子还原为氮气或先用臭氧、双氧水、次氯酸钠等氧化 ,再用还原剂除去。去除废水中含有的
,再用还原剂除去。去除废水中含有的 、
、 的一种原理如下:
的一种原理如下: (Ⅰ),
(Ⅰ), (Ⅱ)。下列说法不正确的是
(Ⅱ)。下列说法不正确的是A.氧化性由强至弱的顺序为 |
B.用镁将水中的 还原成 还原成 的离子方程式为 的离子方程式为 |
C.根据上述资料可知 与 与 不共存,反应为 不共存,反应为 |
D.等物质的量 分别与臭氧、双氧水、次氯酸钠完全反应转移电子数之比为3∶1∶1 分别与臭氧、双氧水、次氯酸钠完全反应转移电子数之比为3∶1∶1 |
您最近一年使用:0次
2023-12-06更新
|
366次组卷
|
2卷引用:北京市首都师范大学附属中学2023-2024学年高三上学期12月阶段练习化学试题
解题方法
3 . 资料显示,酸性介质中, 和
和 反应转化为
反应转化为 和
和 。小组探究利用该反应测定
。小组探究利用该反应测定 含量的条件。
含量的条件。
(1)实验Ⅱ中反应的离子方程式是___________ 。
(2)实验Ⅰ的条件下 能将
能将 氧化为
氧化为 ,推测实验Ⅰ未出现紫色的原因:
,推测实验Ⅰ未出现紫色的原因:________ 。
(3)经检验,棕黑色沉淀为 ,针对实验Ⅲ中的现象,提出以下假设:
,针对实验Ⅲ中的现象,提出以下假设:
假设1: 的浓度较低,不足以将
的浓度较低,不足以将 氧化为
氧化为
假设2:溶液中存在还原剂 ,将生成的
,将生成的 ,还原为
,还原为
①甲同学分析上述实验设计,认为假设1不成立,理由是___________ 。
②针对假设2,乙同学设计实验Ⅳ证实了推测合理。
请写出实验操作和现象:___________ 。
③实验Ⅲ中生成 的离子方程式是
的离子方程式是___________ ,从化学反应原理的角度分析实验Ⅲ未得到紫色溶液的原因:___________ 。
(4)资料表明 可作为
可作为 和
和 反应转化为
反应转化为 的催化剂。丙同学设计实验Ⅲ的对比实验进行了证实。向
的催化剂。丙同学设计实验Ⅲ的对比实验进行了证实。向___________ 中滴加2滴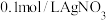 溶液,再加入
溶液,再加入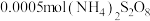 固体,加热至沸腾,观察到溶液变为紫色。
固体,加热至沸腾,观察到溶液变为紫色。
(5)根据上述实验,要利用 将
将 转化为
转化为 的反应来快速测定
的反应来快速测定 的含量,应控制的反应条件有;加热至沸腾、
的含量,应控制的反应条件有;加热至沸腾、___________ 。
 和
和 反应转化为
反应转化为 和
和 。小组探究利用该反应测定
。小组探究利用该反应测定 含量的条件。
含量的条件。| 实验 | 序号 | 物质a | 实验现象 |
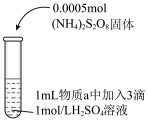 | Ⅰ |  溶液 溶液 | 无明显变化 |
| Ⅱ |  溶液 溶液 | 加热至沸腾, 后溶液变为紫色 后溶液变为紫色 | |
| Ⅲ |  溶液 溶液 | 加热至沸腾,生成大量棕黑色沉淀,静置,上层溶液未变紫色 |
(1)实验Ⅱ中反应的离子方程式是
(2)实验Ⅰ的条件下
 能将
能将 氧化为
氧化为 ,推测实验Ⅰ未出现紫色的原因:
,推测实验Ⅰ未出现紫色的原因:(3)经检验,棕黑色沉淀为
 ,针对实验Ⅲ中的现象,提出以下假设:
,针对实验Ⅲ中的现象,提出以下假设:假设1:
 的浓度较低,不足以将
的浓度较低,不足以将 氧化为
氧化为
假设2:溶液中存在还原剂
 ,将生成的
,将生成的 ,还原为
,还原为
①甲同学分析上述实验设计,认为假设1不成立,理由是
②针对假设2,乙同学设计实验Ⅳ证实了推测合理。
请写出实验操作和现象:
③实验Ⅲ中生成
 的离子方程式是
的离子方程式是(4)资料表明
 可作为
可作为 和
和 反应转化为
反应转化为 的催化剂。丙同学设计实验Ⅲ的对比实验进行了证实。向
的催化剂。丙同学设计实验Ⅲ的对比实验进行了证实。向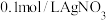 溶液,再加入
溶液,再加入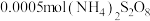 固体,加热至沸腾,观察到溶液变为紫色。
固体,加热至沸腾,观察到溶液变为紫色。(5)根据上述实验,要利用
 将
将 转化为
转化为 的反应来快速测定
的反应来快速测定 的含量,应控制的反应条件有;加热至沸腾、
的含量,应控制的反应条件有;加热至沸腾、
您最近一年使用:0次
名校
4 . 回答下列问题:
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为: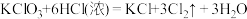 。
。
(1)请用“双线桥”表示上述反应电子转移的方向和数目___________ 。
(2)反应中,氧化剂为___________ ,氧化产物为:___________ 。
(3)浓盐酸在反应中体现出来的性质有___________ (填序号)。
①还原性 ②酸性 ③氧化性 ④碱性
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为 ,该反应中还原剂是
,该反应中还原剂是___________ 。(填化学式)
(5)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。
、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:___________ 。
②每生成1个 转移
转移___________ 个电子。
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为:
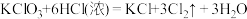 。
。(1)请用“双线桥”表示上述反应电子转移的方向和数目
(2)反应中,氧化剂为
(3)浓盐酸在反应中体现出来的性质有
①还原性 ②酸性 ③氧化性 ④碱性
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为
 ,该反应中还原剂是
,该反应中还原剂是(5)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。
、Cl-、H2O。①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1个
 转移
转移
您最近一年使用:0次
名校
5 . 高铁酸钾 是一种新型净水剂,制备流程如下:
是一种新型净水剂,制备流程如下:

资料:ⅰ. 可溶于水,微溶于
可溶于水,微溶于 溶液,难溶于乙醇,
溶液,难溶于乙醇, 易溶于乙醇
易溶于乙醇
ⅱ.在碱性溶液中的溶解度: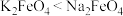
ⅲ. 在碱性溶液中稳定,中性和酸性溶液中不稳定
在碱性溶液中稳定,中性和酸性溶液中不稳定
(1) 具有强氧化性,其中铁元素的化合价为
具有强氧化性,其中铁元素的化合价为___________ 价。
(2)过程I的目的是制备 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(3)过程Ⅱ为碱性条件下制备高铁酸钠 ,补全过程Ⅱ中发生反应的离子方程式:
,补全过程Ⅱ中发生反应的离子方程式:___________ 。

(4)为提高原料利用率,过程Ⅲ的产物中可循环利用的物质是___________ 。
(5)粗 转化为纯
转化为纯 的操作包含洗涤,去除固体表面的
的操作包含洗涤,去除固体表面的 ,可以用
,可以用___________ 洗涤。
(6) 与稀硫酸反应生成
与稀硫酸反应生成 和
和 ,通过测定生成
,通过测定生成 的体积,可计算
的体积,可计算 的纯度。取
的纯度。取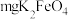 产品与稀硫酸反应,测得生成
产品与稀硫酸反应,测得生成 的体积为
的体积为 (标准状况)。
(标准状况)。
①计算 的纯度
的纯度
___________ (列算式)。 (物质的纯度
(物质的纯度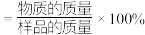 )
)
②若将稀硫酸换成稀盐酸,生成的气体中含有 ,导致
,导致 的纯度的计算值偏大,原因是
的纯度的计算值偏大,原因是___________ 。
 是一种新型净水剂,制备流程如下:
是一种新型净水剂,制备流程如下:
资料:ⅰ.
 可溶于水,微溶于
可溶于水,微溶于 溶液,难溶于乙醇,
溶液,难溶于乙醇, 易溶于乙醇
易溶于乙醇ⅱ.在碱性溶液中的溶解度:
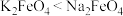
ⅲ.
 在碱性溶液中稳定,中性和酸性溶液中不稳定
在碱性溶液中稳定,中性和酸性溶液中不稳定(1)
 具有强氧化性,其中铁元素的化合价为
具有强氧化性,其中铁元素的化合价为(2)过程I的目的是制备
 ,反应的离子方程式为
,反应的离子方程式为(3)过程Ⅱ为碱性条件下制备高铁酸钠
 ,补全过程Ⅱ中发生反应的离子方程式:
,补全过程Ⅱ中发生反应的离子方程式:
(4)为提高原料利用率,过程Ⅲ的产物中可循环利用的物质是
(5)粗
 转化为纯
转化为纯 的操作包含洗涤,去除固体表面的
的操作包含洗涤,去除固体表面的 ,可以用
,可以用(6)
 与稀硫酸反应生成
与稀硫酸反应生成 和
和 ,通过测定生成
,通过测定生成 的体积,可计算
的体积,可计算 的纯度。取
的纯度。取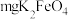 产品与稀硫酸反应,测得生成
产品与稀硫酸反应,测得生成 的体积为
的体积为 (标准状况)。
(标准状况)。①计算
 的纯度
的纯度
 (物质的纯度
(物质的纯度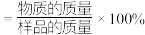 )
)②若将稀硫酸换成稀盐酸,生成的气体中含有
 ,导致
,导致 的纯度的计算值偏大,原因是
的纯度的计算值偏大,原因是
您最近一年使用:0次
名校
6 . 某MOFs多孔材料孔径大小和形状恰好将N2O4“固定”,能高选择性吸附NO2.废气中的NO2被吸附后,经处理能全部转化为HNO3.原理示意图如下。
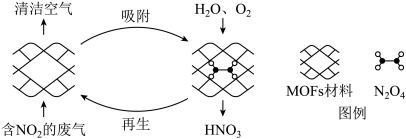
已知:N2O4(g) 2NO2(g)△H>0
2NO2(g)△H>0
下列说法不正确的是

已知:N2O4(g)
 2NO2(g)△H>0
2NO2(g)△H>0下列说法不正确的是
| A.温度升高时利于NO2吸附 |
B.多孔材料“固定”N2O4,促进2NO2(g) N2O4(g)平衡正向移动 N2O4(g)平衡正向移动 |
| C.转化为HNO3的反应是2N2O4+O2+2H2O=4HNO3 |
| D.每获得0.lmol HNO3时,转移电子的数目为6.02×1022 |
您最近一年使用:0次
2022·北京·高考真题
7 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。
ⅱ、浓碱条件下,MnO 可被OH-还原为MnO
可被OH-还原为MnO 。
。
ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
(1)B中试剂是_____ 。
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为_____ 。
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是_____ 。
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO 氧化为MnO
氧化为MnO 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:_____ ,但通过实验测定溶液的碱性变化很小。
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____ ,溶液绿色缓慢加深,原因是MnO2被_____ (填化学式)氧化,可证明实验Ⅲ的悬浊液中氧化剂过量。
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是_____ 。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:_____ 。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO
 (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。ⅱ、浓碱条件下,MnO
 可被OH-还原为MnO
可被OH-还原为MnO 。
。ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
| 实验 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO
 氧化为MnO
氧化为MnO 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
2023-11-29更新
|
866次组卷
|
29卷引用:2022年北京市高考真题化学试题(部分试题)
(已下线)2022年北京市高考真题化学试题(部分试题)2022年北京市高考真题化学试题(已下线)2022年北京高考真题变式题1-14(已下线)2022年北京高考真题化学试题变式题(实验探究题)北京一零一中学2023-2024学年高三上学期11月统练五化学试题北京市日坛中学2023-2024学年高三上学期10月检测化学试题北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)四川省成都市树德中学2022-2023学年高三上学期入学考试理综化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题(已下线)专题三 离子反应-实战高考·二轮复习核心突破突破超重点 高效突破综合实验 实验4 创新探究实验角度1控制变量法探究(已下线)题型46 实验原理探究型综合实验(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)微专题 物质性质综合实验探究江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题
名校
解题方法
8 . Ⅰ.写出下列反应的离子方程式:
(1)磁性氧化铁溶于稀盐酸:___________ 。
(2)用硫氰酸钾溶液检验待测液中的
___________ 。
(3)用酸性高锰酸钾溶液检验待测液中的
___________ 。
Ⅱ.根据信息配平下列反应的离子方程式
(4)将 固体(黄色,微溶)加入
固体(黄色,微溶)加入 和
和 的混合溶液里,加热,溶液显紫色(
的混合溶液里,加热,溶液显紫色( 无色)。请根据题中信息配平该反应的离子方程式:
无色)。请根据题中信息配平该反应的离子方程式:___________
___________ ___________
___________ ___________=___________
___________=___________ ___________
___________ ___________
___________ ___________
___________
(5) 虽然具有净水作用,但是腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比
虽然具有净水作用,但是腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比 高效,且腐蚀性小。完成
高效,且腐蚀性小。完成 氧化
氧化 的离子方程式:
的离子方程式:___________
___________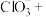 ___________
___________ ___________=___________
___________=___________ ___________
___________ ___________
___________
(1)磁性氧化铁溶于稀盐酸:
(2)用硫氰酸钾溶液检验待测液中的

(3)用酸性高锰酸钾溶液检验待测液中的

Ⅱ.根据信息配平下列反应的离子方程式
(4)将
 固体(黄色,微溶)加入
固体(黄色,微溶)加入 和
和 的混合溶液里,加热,溶液显紫色(
的混合溶液里,加热,溶液显紫色( 无色)。请根据题中信息配平该反应的离子方程式:
无色)。请根据题中信息配平该反应的离子方程式:___________
 ___________
___________ ___________=___________
___________=___________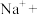 ___________
___________ ___________
___________ ___________
___________(5)
 虽然具有净水作用,但是腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比
虽然具有净水作用,但是腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比 高效,且腐蚀性小。完成
高效,且腐蚀性小。完成 氧化
氧化 的离子方程式:
的离子方程式:___________
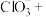 ___________
___________ ___________=___________
___________=___________ ___________
___________ ___________
___________
您最近一年使用:0次
解题方法
9 . 以钛铁矿(主要含 钛元素化合价为+4)为原料制备铵铁蓝
钛元素化合价为+4)为原料制备铵铁蓝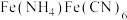 的一种流程示意图如下。
的一种流程示意图如下。
已知:钛铁铁矿遇酸以 形式存在于溶液中,且易水解为
形式存在于溶液中,且易水解为

(1)钛铁矿粉碎的目的是___________ 。
(2)请结合化学用语解释向酸浸液中加入“生铁”的目的是___________ 。
(3)滤渣中的主要成分是___________ 。
(4)在“沉铁”步骤产生的白色沉淀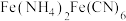 ,
,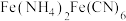 中Fe的化合价是
中Fe的化合价是___________ 。
(5)流程中 的作用是
的作用是___________ ,该步发生反应的离子方程式是___________ 。
(6)铵铁蓝溶液的颜色受铵铁蓝溶液中游离 时的质量分数影响,
时的质量分数影响, 的质量分数越高,铵铁蓝的颜色越鲜艳,铵铁蓝制备中
的质量分数越高,铵铁蓝的颜色越鲜艳,铵铁蓝制备中 的质量分数受条件影响如下图所示:
的质量分数受条件影响如下图所示:

 浓度对
浓度对 质量分数的影响
质量分数的影响

“沉铁”步骤中混合溶液pH对 质量分数的影响
质量分数的影响
要得到颜色鲜艳的铵铁蓝还需控制的条件是___________ 。
 钛元素化合价为+4)为原料制备铵铁蓝
钛元素化合价为+4)为原料制备铵铁蓝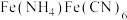 的一种流程示意图如下。
的一种流程示意图如下。已知:钛铁铁矿遇酸以
 形式存在于溶液中,且易水解为
形式存在于溶液中,且易水解为

(1)钛铁矿粉碎的目的是
(2)请结合化学用语解释向酸浸液中加入“生铁”的目的是
(3)滤渣中的主要成分是
(4)在“沉铁”步骤产生的白色沉淀
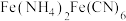 ,
,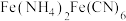 中Fe的化合价是
中Fe的化合价是(5)流程中
 的作用是
的作用是(6)铵铁蓝溶液的颜色受铵铁蓝溶液中游离
 时的质量分数影响,
时的质量分数影响, 的质量分数越高,铵铁蓝的颜色越鲜艳,铵铁蓝制备中
的质量分数越高,铵铁蓝的颜色越鲜艳,铵铁蓝制备中 的质量分数受条件影响如下图所示:
的质量分数受条件影响如下图所示:
 浓度对
浓度对 质量分数的影响
质量分数的影响
“沉铁”步骤中混合溶液pH对
 质量分数的影响
质量分数的影响要得到颜色鲜艳的铵铁蓝还需控制的条件是
您最近一年使用:0次
名校
解题方法
10 . 下列方程式与所给事实不相符 的是
A. 通过灼热铁粉: 通过灼热铁粉: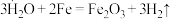 |
B.用 作抗胃酸药: 作抗胃酸药: |
C. 与 与 反应: 反应: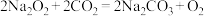 |
D. 通入酸性 通入酸性 溶液中: 溶液中: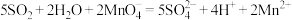 |
您最近一年使用:0次
2023-11-25更新
|
476次组卷
|
3卷引用:北京市通州区2023-2024学年高三上学期期中质量检测化学试题
北京市通州区2023-2024学年高三上学期期中质量检测化学试题(已下线)题型03 离子方程式正误判断 离子共存、检验和推断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)湖南省邵东市第三中学2023-2024学年高一上学期第三次月考化学试题



