名校
解题方法
1 . 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)基态Na原子的价层电子轨道表示式为___________ 。
(2)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na。电解反应方程式如下: ,加入
,加入 的目的是
的目的是___________ 。
(3) 的电子式为
的电子式为___________ 。在25℃和101kPa时,Na与 反应生成1mol
反应生成1mol 放热510.9kJ,写出该反应的热化学方程式:
放热510.9kJ,写出该反应的热化学方程式:___________ 。 可作供氧剂,写出
可作供氧剂,写出 与CO2反应的化学方程式
与CO2反应的化学方程式___________ 。若有1mol 参加反应则转移电子的物质的量为
参加反应则转移电子的物质的量为___________ mol。
(4)采用空气和Na为原料可直接制备 。空气与熔融金属Na反应前需依次通过
。空气与熔融金属Na反应前需依次通过___________ 、___________ (填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d. 溶液
溶液
(5)向酸性KMnO4溶液中加入 粉末,观察到溶液褪色,发生如下反应: ______MnO
粉末,观察到溶液褪色,发生如下反应: ______MnO +_____H++_____Na2O2=_____Mn2+_____O2↑+_____H2O+_____Na+,配平该离子方程式:
+_____H++_____Na2O2=_____Mn2+_____O2↑+_____H2O+_____Na+,配平该离子方程式:___________ ,该反应说明 具有
具有___________ 性(选填“氧化”,“还原”或“漂白”)。
(6)钠的某氧化物晶胞如下图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为___________ 。

(7)天然碱的主要成分为 ,1mol
,1mol 经充分加热得到
经充分加热得到 的质量为
的质量为___________ g。
(1)基态Na原子的价层电子轨道表示式为
(2)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na。电解反应方程式如下:
 ,加入
,加入 的目的是
的目的是(3)
 的电子式为
的电子式为 反应生成1mol
反应生成1mol 放热510.9kJ,写出该反应的热化学方程式:
放热510.9kJ,写出该反应的热化学方程式: 可作供氧剂,写出
可作供氧剂,写出 与CO2反应的化学方程式
与CO2反应的化学方程式 参加反应则转移电子的物质的量为
参加反应则转移电子的物质的量为(4)采用空气和Na为原料可直接制备
 。空气与熔融金属Na反应前需依次通过
。空气与熔融金属Na反应前需依次通过a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.
 溶液
溶液(5)向酸性KMnO4溶液中加入
 粉末,观察到溶液褪色,发生如下反应: ______MnO
粉末,观察到溶液褪色,发生如下反应: ______MnO +_____H++_____Na2O2=_____Mn2+_____O2↑+_____H2O+_____Na+,配平该离子方程式:
+_____H++_____Na2O2=_____Mn2+_____O2↑+_____H2O+_____Na+,配平该离子方程式: 具有
具有(6)钠的某氧化物晶胞如下图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为

(7)天然碱的主要成分为
 ,1mol
,1mol 经充分加热得到
经充分加热得到 的质量为
的质量为
您最近一年使用:0次
名校
2 . 某工业铜沉淀渣主要成分为Cu、Cu2Se 和Cu2Te,还含有Ag等稀贵金属。回收铜(CuSO4)、硒(Se)、碲(Te)的主要流程如下:

(1)“铜沉淀渣”中硒元素化合价为___________ 。
(2)经过“硫酸化焙烧”, Cu、Cu2Se 和Cu2Te 转变为CuSO4, 其中Cu2Te 硫酸化焙烧反应如下,请补全方程式_________

(3)焙烧产生的SeO2、SO2与“吸收塔”中的H2O 反应生成粗硒及某一含硫化合物,该含硫化合物化学式为___________ 。
(4)水浸固体”过程中补充少量 NaCl固体,可减少固体中的银(Ag2SO4)进入浸出液中,结合化学用语,从平衡移动角度解释其原因___________ 。
(5)“滤液2”经过___________ 、___________ 、 过滤、洗涤、 干燥可以得到硫酸铜晶体。

(1)“铜沉淀渣”中硒元素化合价为
(2)经过“硫酸化焙烧”, Cu、Cu2Se 和Cu2Te 转变为CuSO4, 其中Cu2Te 硫酸化焙烧反应如下,请补全方程式

(3)焙烧产生的SeO2、SO2与“吸收塔”中的H2O 反应生成粗硒及某一含硫化合物,该含硫化合物化学式为
(4)水浸固体”过程中补充少量 NaCl固体,可减少固体中的银(Ag2SO4)进入浸出液中,结合化学用语,从平衡移动角度解释其原因
(5)“滤液2”经过
您最近一年使用:0次
名校
解题方法
3 . 某小组为了探究影响 溶液与
溶液与 溶液在酸性条件下反应速率的因素,设计如表所示的实验方案。
溶液在酸性条件下反应速率的因素,设计如表所示的实验方案。
下列说法不正确的是
 溶液与
溶液与 溶液在酸性条件下反应速率的因素,设计如表所示的实验方案。
溶液在酸性条件下反应速率的因素,设计如表所示的实验方案。| 实验 | 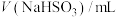 ( (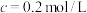 ) ) | 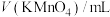 ( (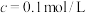 ) ) | 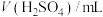 ( (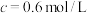 ) ) | 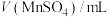 ( (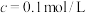 ) ) |  /mL /mL | 褪色时间t/min |
| 1 | 3.0 | 2.0 | 1.0 | 0.0 | 2.0 | 8 |
| 2 | 3.0 | 2.0 | 2.0 | 0.0 | a | 6 |
| 3 | 4.0 | 2.0 | 2.0 | 0.0 | 0.0 | 4 |
| 4 | 3.0 | 2.0 | 1.0 | 0.5 | b | 3 |
| A.a=1.0,b=1.5 |
| B.溶液的酸碱性会影响该反应的化学反应速率 |
C.该反应的离子方程式为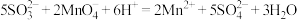 |
D.需先将 、 、 、 、 、 、 混合后,再与 混合后,再与 溶液混合、计时 溶液混合、计时 |
您最近一年使用:0次
2023-10-22更新
|
112次组卷
|
2卷引用:北京市顺义区第一中学2023-2024学年高二上学期10月月考化学试题
4 . 软锰矿(主要成分为MnO2)可用于工业上制取高锰酸钾(KMnO4),工艺如下:
I.将软锰矿粉碎后,与KOH固体混合,通入氯气充分焙烧,生成暗绿色熔融态物质。
II.冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
IV.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料:K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液中易发生歧化反应。
(1)KMnO4中Mn的化合价为___________ 。
(2)I中,粉碎软锰矿的目的是___________ 。
(3)I中,生成K2MnO4的化学方程式是___________ 。
(4)Ⅱ中,浸取时用稀KOH溶液的原因是___________ 。
(5)Ⅲ中,发生如下反应,配平该离子反应:___________
MnO +CO2+H2O→MnO
+CO2+H2O→MnO +MnO2↓+HCO
+MnO2↓+HCO
氧化产物和还原产物的物质的量之比为___________ 。
I.将软锰矿粉碎后,与KOH固体混合,通入氯气充分焙烧,生成暗绿色熔融态物质。
II.冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
IV.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料:K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液中易发生歧化反应。
(1)KMnO4中Mn的化合价为
(2)I中,粉碎软锰矿的目的是
(3)I中,生成K2MnO4的化学方程式是
(4)Ⅱ中,浸取时用稀KOH溶液的原因是
(5)Ⅲ中,发生如下反应,配平该离子反应:
MnO
 +CO2+H2O→MnO
+CO2+H2O→MnO +MnO2↓+HCO
+MnO2↓+HCO
氧化产物和还原产物的物质的量之比为
您最近一年使用:0次
名校
5 . 氮氧化物会造成环境污染,我国科学家正着力研究SCR技术( 选择性催化还原氮氧化物)对燃煤电厂烟气进行脱硝处理。
选择性催化还原氮氧化物)对燃煤电厂烟气进行脱硝处理。
(1)氮氧化物(以NO为主)直接排放到空气中会形成硝酸型酸雨,反应的化学方程式为___________ 。
(2) 催化还原NO的化学方程式为
催化还原NO的化学方程式为___________ 。
(3)铁基催化剂在260~300℃范围内实现SCR技术的过程如下:
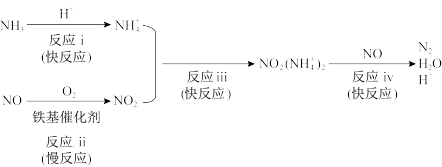
①反应ⅳ中消耗的二价阳离子NO2(NH )与NO的物质的量之比为
)与NO的物质的量之比为___________ 。
②适当增大催化剂用量可以明显加快脱硝速率,结合上述过程解释原因:___________ 。
③向反应体系中添加 可显著提高NO脱除率。原因如下:
可显著提高NO脱除率。原因如下:
 与NO发生反应
与NO发生反应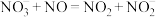 ;
;
 与
与 发生反应ⅲ和反应ⅳ转化为
发生反应ⅲ和反应ⅳ转化为 ;
;
 与
与 发生反应
发生反应___________ (填离子方程式)转化为 。
。
(4)相比于铁基催化剂,使用锰基催化剂(活性物质为 )时,烟气中含有的
)时,烟气中含有的 会明显降低NO脱除率。采用滴定法测定烟气中
会明显降低NO脱除率。采用滴定法测定烟气中 的含量,烟气中其他气体不干扰测定。
的含量,烟气中其他气体不干扰测定。
将废气中的 用1%的
用1%的 完全吸收,吸收液用如图所示装置滴定,共消耗a mL c mol/L NaOH标准液。
完全吸收,吸收液用如图所示装置滴定,共消耗a mL c mol/L NaOH标准液。

① 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
②废气中残留 在标准状况下的体积为
在标准状况下的体积为___________ 。(写出表达式)
 选择性催化还原氮氧化物)对燃煤电厂烟气进行脱硝处理。
选择性催化还原氮氧化物)对燃煤电厂烟气进行脱硝处理。(1)氮氧化物(以NO为主)直接排放到空气中会形成硝酸型酸雨,反应的化学方程式为
(2)
 催化还原NO的化学方程式为
催化还原NO的化学方程式为(3)铁基催化剂在260~300℃范围内实现SCR技术的过程如下:

①反应ⅳ中消耗的二价阳离子NO2(NH
 )与NO的物质的量之比为
)与NO的物质的量之比为②适当增大催化剂用量可以明显加快脱硝速率,结合上述过程解释原因:
③向反应体系中添加
 可显著提高NO脱除率。原因如下:
可显著提高NO脱除率。原因如下: 与NO发生反应
与NO发生反应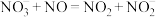 ;
; 与
与 发生反应ⅲ和反应ⅳ转化为
发生反应ⅲ和反应ⅳ转化为 ;
; 与
与 发生反应
发生反应 。
。(4)相比于铁基催化剂,使用锰基催化剂(活性物质为
 )时,烟气中含有的
)时,烟气中含有的 会明显降低NO脱除率。采用滴定法测定烟气中
会明显降低NO脱除率。采用滴定法测定烟气中 的含量,烟气中其他气体不干扰测定。
的含量,烟气中其他气体不干扰测定。将废气中的
 用1%的
用1%的 完全吸收,吸收液用如图所示装置滴定,共消耗a mL c mol/L NaOH标准液。
完全吸收,吸收液用如图所示装置滴定,共消耗a mL c mol/L NaOH标准液。
①
 与
与 反应的化学方程式为
反应的化学方程式为②废气中残留
 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
名校
解题方法
6 . 某钴矿石的主要成分有CoO、 、MnO、
、MnO、 、MgO和
、MgO和 等。由该矿石粉制备
等。由该矿石粉制备 固体的方法如下(部分催化剂已略)。
固体的方法如下(部分催化剂已略)。
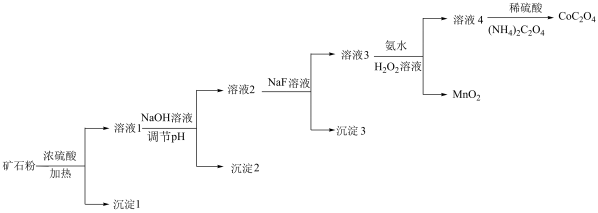
已知:金属离子沉淀的pH:
(1) 溶于浓硫酸,生成
溶于浓硫酸,生成 和一种可使带火星的木条复燃的气体,该气体是
和一种可使带火星的木条复燃的气体,该气体是___________ 。
(2)向溶液1中加入NaOH溶液将pH调至3,目的是___________ 。
(3)向溶液2中加入NaF溶液,去除的离子是___________ 。
(4)向溶液3中加入氨水和过氧化氢溶液,将 转化为
转化为 。补充完整下列离子方程式:
。补充完整下列离子方程式:_______
___________ +___________
+___________ ___________
___________ ___________
___________ ___________
___________
(5)溶液4中,若将1 mol 全部转化为
全部转化为 沉淀,需要消耗
沉淀,需要消耗
___________ mol。
(6)关于上述流程,下列说法正确的是___________ (填序号)。
a.若矿石粉中存在少量FeO,经上述流程也可制得纯度相同的
b.向溶液3中加入氨水,作用仅是调节溶液的pH
c.流程中,仅通过调节溶液的pH无法将金属元素完全分离
 、MnO、
、MnO、 、MgO和
、MgO和 等。由该矿石粉制备
等。由该矿石粉制备 固体的方法如下(部分催化剂已略)。
固体的方法如下(部分催化剂已略)。
已知:金属离子沉淀的pH:
 |  |  |  |  | |
| 开始沉淀时 | 1.5 | 6.3 | 8.9 | 8.2 | 7.4 |
| 完全沉淀时 | 2.8 | 8.3 | 10.9 | 10.2 | 9.4 |
 溶于浓硫酸,生成
溶于浓硫酸,生成 和一种可使带火星的木条复燃的气体,该气体是
和一种可使带火星的木条复燃的气体,该气体是(2)向溶液1中加入NaOH溶液将pH调至3,目的是
(3)向溶液2中加入NaF溶液,去除的离子是
(4)向溶液3中加入氨水和过氧化氢溶液,将
 转化为
转化为 。补充完整下列离子方程式:
。补充完整下列离子方程式:___________
 +___________
+___________ ___________
___________ ___________
___________ ___________
___________(5)溶液4中,若将1 mol
 全部转化为
全部转化为 沉淀,需要消耗
沉淀,需要消耗
(6)关于上述流程,下列说法正确的是
a.若矿石粉中存在少量FeO,经上述流程也可制得纯度相同的

b.向溶液3中加入氨水,作用仅是调节溶液的pH
c.流程中,仅通过调节溶液的pH无法将金属元素完全分离
您最近一年使用:0次
2023-10-15更新
|
175次组卷
|
7卷引用:北京市西城区2021届高三上学期期末考试化学试题
北京市西城区2021届高三上学期期末考试化学试题(已下线)北京市第四中学2021-2022学年高三上学期期中考试化学试题北京一零一中2021-2022学年高一下学期期末考试(等级考)化学试题北京市首都师范大学附属中学2023-2024学年高三上学期10月月考化学试题北京市清华大学附属中学2023-2024学年高三上学期10月统练(四)化学试题北京市顺义区第一中学2023-2024学年高三上学期期中考试化学试题(已下线)大题01 化学工艺流程题(一)-【考前抓大题】备战2021年高考化学(全国通用)
名校
7 . 在酸性条件下,可发生如下反应:3ClO-+2M(OH)3+4OH-=2MO +3Cl-+5H2O,MO
+3Cl-+5H2O,MO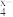 中M的化合价是
中M的化合价是
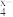 +3Cl-+5H2O,MO
+3Cl-+5H2O,MO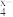 中M的化合价是
中M的化合价是| A.+4 | B.+5 | C.+6 | D.+7 |
您最近一年使用:0次
2023-10-14更新
|
34次组卷
|
2卷引用:北京市第八十中学2023-2024学年高一上学期10月月考化学试题
解题方法
8 . 下列反应的离子方程式书写正确的是
A.将少量氯气通入 溶液中: 溶液中: |
B.将少量 溶液滴入 溶液滴入 溶液中: 溶液中: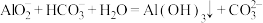 |
C.海带灰浸出液中滴加几滴硫酸酸化的过氧化氢溶液: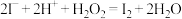 |
D.Cu溶于稀硝酸: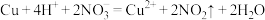 |
您最近一年使用:0次
9 . 含氯物质在日常生活中具有许多重要用途,回答下列问题:
(1)亚氯酸钠( )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
(2)我国从2000年起逐步用 气体替代氯气进行消毒,实验室常用
气体替代氯气进行消毒,实验室常用 、草酸(
、草酸( )和稀硫酸制备
)和稀硫酸制备 ,草酸被氧化成
,草酸被氧化成 ,则该反应的离子方程式为
,则该反应的离子方程式为___________ 。
(3)工业上可利用 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列物质:
),反应体系中涉及下列物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:___________ 。
(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、 的混合液,经测定溶液中
的混合液,经测定溶液中 与
与 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的 的分子个数比为
的分子个数比为___________ 。
(5)请完成该过程的化学方程式并配平。
______ _______
_______ ______
______ _______
_______ _______
_______ ______(________)
______(________) ___________
若反应生成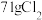 ,被氧化的HCl质量为
,被氧化的HCl质量为___________ 。
(6)已知氧化性: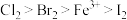 ,则:
,则:
① 溶液中通入一定量的
溶液中通入一定量的 ,发生反应的离子方程式为:
,发生反应的离子方程式为: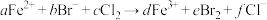 ,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是___________ 。
A.2;4;3;2;2;6 B.0;2;1;0;1;2
C.2;2;2;2;1;4 D.2;6;4;2;3;8
② 、
、 和
和 的个数之比为2:2:5,在溶液中反应的离子反应方程式为
的个数之比为2:2:5,在溶液中反应的离子反应方程式为___________ 。
(7)实验室用下列方法均可制取氯气
①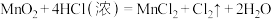
②
③
④
若各反应转移的电子数相同,①②③④生成的氯气质量比为___________ 。
(1)亚氯酸钠(
 )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________A.NaCl、 | B.NaCl、NaClO |
C. 、 、 | D.NaCl、 |
 气体替代氯气进行消毒,实验室常用
气体替代氯气进行消毒,实验室常用 、草酸(
、草酸( )和稀硫酸制备
)和稀硫酸制备 ,草酸被氧化成
,草酸被氧化成 ,则该反应的离子方程式为
,则该反应的离子方程式为(3)工业上可利用
 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列物质:
),反应体系中涉及下列物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、
 的混合液,经测定溶液中
的混合液,经测定溶液中 与
与 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的 的分子个数比为
的分子个数比为(5)请完成该过程的化学方程式并配平。
______
 _______
_______ ______
______ _______
_______ _______
_______ ______(________)
______(________) 若反应生成
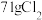 ,被氧化的HCl质量为
,被氧化的HCl质量为(6)已知氧化性:
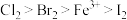 ,则:
,则:①
 溶液中通入一定量的
溶液中通入一定量的 ,发生反应的离子方程式为:
,发生反应的离子方程式为: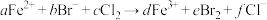 ,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是A.2;4;3;2;2;6 B.0;2;1;0;1;2
C.2;2;2;2;1;4 D.2;6;4;2;3;8
②
 、
、 和
和 的个数之比为2:2:5,在溶液中反应的离子反应方程式为
的个数之比为2:2:5,在溶液中反应的离子反应方程式为(7)实验室用下列方法均可制取氯气
①
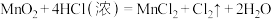
②

③

④

若各反应转移的电子数相同,①②③④生成的氯气质量比为
您最近一年使用:0次
2023-10-11更新
|
815次组卷
|
3卷引用:结构与性质
名校
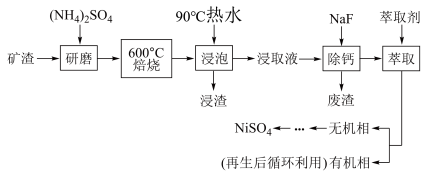
10 . NiSO4主要用于电镀工业,作为电镀镍和化学镍的主要原料,也用于生产其他镍盐(如氧化镍、硫酸镍铵、碳酸镍等),从矿渣[含NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如图:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有___________ (写化学式)。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为___________ 。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol•L﹣1),当溶液中c(F﹣)=2.0×10-3.5mol•L-1时,除钙率为___________ [Ksp(CaF2)=4.0×10-11]。
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相)+2RH(有机相) FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为
FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为 ___________ 。在 ___________ (填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。 。
。___________ ,离子交换膜(b)为 ___________ (填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为___________ 。
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol•L﹣1),当溶液中c(F﹣)=2.0×10-3.5mol•L-1时,除钙率为
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相)+2RH(有机相)
 FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为
FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为 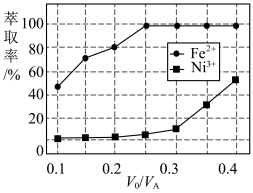
 。
。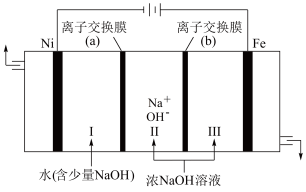
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为
您最近一年使用:0次
2023-10-03更新
|
555次组卷
|
7卷引用:北京专家2020届高三高考模拟试卷(二)化学试题



