1 . (Ⅰ)已知A为常见的金属单质。B俗称磁性氯化铁。根据如图所示的关系:
B:_______ D:_______ 。
(2)写出③的离子方程式:_______ 。
(3)写出④的化学方程式:_______ 。
(4)写出⑤的化学方程式:_______ 。
(5)写出E→F的现象_______ 。
写出E→F的化学方程式_______ 。
(Ⅱ)某兴趣小组同学为探究黑木耳中的含铁量,进行如下实验。已知:
ⅰ.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质等。每100克黑木耳含铁高达185毫克。
ⅱ.紫色的 溶液在酸性条件下有强氧化性,其还原产物是无色的
溶液在酸性条件下有强氧化性,其还原产物是无色的 。
。
ⅲ. 与铁氰化钾(
与铁氰化钾(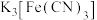 )溶液反应生成蓝色沉淀。
)溶液反应生成蓝色沉淀。
为确定黑木耳中含有铁元素,甲同学设计实验方案如图。_______ 。
(7)步骤④检验 所用试剂是
所用试剂是_______ 溶液。
(8)下列有关上述实验得出的结论正确的是_______ (填字母符号)。
a.黑木耳中一定含 和
和
b.滤液A中一定含 和
和
c.白色沉淀中一定含
为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
(10)步骤⑦中观察到的实验现象是_______ ,反应的离子方程式是_______ 。

B:
(2)写出③的离子方程式:
(3)写出④的化学方程式:
(4)写出⑤的化学方程式:
(5)写出E→F的现象
写出E→F的化学方程式
(Ⅱ)某兴趣小组同学为探究黑木耳中的含铁量,进行如下实验。已知:
ⅰ.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质等。每100克黑木耳含铁高达185毫克。
ⅱ.紫色的
 溶液在酸性条件下有强氧化性,其还原产物是无色的
溶液在酸性条件下有强氧化性,其还原产物是无色的 。
。ⅲ.
 与铁氰化钾(
与铁氰化钾(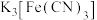 )溶液反应生成蓝色沉淀。
)溶液反应生成蓝色沉淀。为确定黑木耳中含有铁元素,甲同学设计实验方案如图。
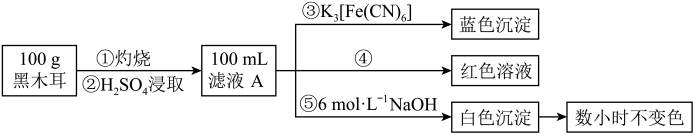
(7)步骤④检验
 所用试剂是
所用试剂是(8)下列有关上述实验得出的结论正确的是
a.黑木耳中一定含
 和
和
b.滤液A中一定含
 和
和
c.白色沉淀中一定含

为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
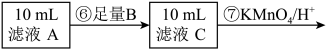
| A.Na | B.Zn | C.Fe | D.Cu |
(10)步骤⑦中观察到的实验现象是
您最近一年使用:0次
解题方法
2 . 现有下列物质:①氨气 ②碳酸钙固体 ③盐酸 ④二氧化碳 ⑤酒精 ⑥熔融氢氧化钾 ⑦铜 ⑧氯水 ⑨KHSO4溶液。(请填写序号)
(1)属于电解质的有__________________ 。
(2)属于非解质的有__________________ 。
(3)能导电的物质有__________ 。
(4)在水溶液中能发生离子方程式:H+ + OH- =H2O,写出相关化学方程式(任写一个即可):__________________________________________ 。
(5)物质盐酸的电离方程式:______________________ ;物质硫酸氢钾的电离方程式:__________________ 。
(6)Cl2与⑥可能会发生如下反应,配平该方程式_______ 。
_______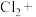 _______KOH=_______
_______KOH=_______ _______
_______ _______
_______ 。
。
(1)属于电解质的有
(2)属于非解质的有
(3)能导电的物质有
(4)在水溶液中能发生离子方程式:H+ + OH- =H2O,写出相关化学方程式(任写一个即可):
(5)物质盐酸的电离方程式:
(6)Cl2与⑥可能会发生如下反应,配平该方程式
_______
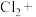 _______KOH=_______
_______KOH=_______ _______
_______ _______
_______ 。
。
您最近一年使用:0次
3 . 按要求回答下列问题:
Ⅰ.现有以下物质:①氮气 ②CO2 ③氯化氢气体 ④铜片 ⑤硫酸钡晶体 ⑥蔗糖 ⑦酒精 ⑧熔化的KNO3 ⑨NaHSO4溶液,请回答下列问题:
(1)以上物质中能导电的是_______ (填序号,下同)。
(2)以上物质中属于电解质的是_______ 。
(3)以上物质中属于非电解质的是_______ 。
Ⅱ.有下列几种物质:Na2SO3、Na2SO4、KIO3、K2SO4 、I2 等组成一个氧化还原反应。
(4)将化学方程式补全并进行配平_______ :
_____KIO3 + _____Na2SO3 + __________ —— _____Na2SO4 + _____K2SO4 + _____I2 + _____H2O
(5)在该反应中,还原剂是_______ (填化学式,下同),还原产物是_______ 。
Ⅲ.是“84”消毒液的有效成分,请回答下列问题:
(6)NaClO中Cl元素的化合价是_______ 价。
(7)曾有报道,在清洗卫生间时,因混合使用“洁厕灵”(主要成分是稀盐酸)与“84”消毒液而发生氯气中毒事件。用离子方程式表示原因:_______ 。
Ⅰ.现有以下物质:①氮气 ②CO2 ③氯化氢气体 ④铜片 ⑤硫酸钡晶体 ⑥蔗糖 ⑦酒精 ⑧熔化的KNO3 ⑨NaHSO4溶液,请回答下列问题:
(1)以上物质中能导电的是
(2)以上物质中属于电解质的是
(3)以上物质中属于非电解质的是
Ⅱ.有下列几种物质:Na2SO3、Na2SO4、KIO3、K2SO4 、I2 等组成一个氧化还原反应。
(4)将化学方程式补全并进行配平
_____KIO3 + _____Na2SO3 + __________ —— _____Na2SO4 + _____K2SO4 + _____I2 + _____H2O
(5)在该反应中,还原剂是
Ⅲ.是“84”消毒液的有效成分,请回答下列问题:
(6)NaClO中Cl元素的化合价是
(7)曾有报道,在清洗卫生间时,因混合使用“洁厕灵”(主要成分是稀盐酸)与“84”消毒液而发生氯气中毒事件。用离子方程式表示原因:
您最近一年使用:0次
名校
解题方法
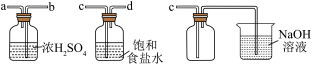
4 . 氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,以下为制备两种消毒剂的方法,请回答下列问题:
(1)实验室用舍勒的方法制取 时选用图中装置
时选用图中装置_____ (填“A”或“ ”),反应的离子方程式为
”),反应的离子方程式为_____ 。装置 中管
中管 的作用是
的作用是_____ 。

(2)实验室制取干燥、纯净的 ,所需图装置的接口连接顺序为:发生装置→
,所需图装置的接口连接顺序为:发生装置→_____ (填字母)。
(3)反应停止后,实验小组检验烧瓶中还有 和盐酸。小组同学探究不继续产生
和盐酸。小组同学探究不继续产生 的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
【提出猜想】
猜想1: 降低,氧化剂
降低,氧化剂_____ (填化学式)氧化性减弱。
猜想2:_____ 减弱。
猜想3: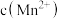 增大,氧化剂氧化性减弱。
增大,氧化剂氧化性减弱。
【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
【实验拓展】经过探究,小组同学认为硫酸、 固体和
固体和 混合加热也可制取
混合加热也可制取 。
。
请配平该反应的方程式:_____
_____ (浓)
(浓) _
_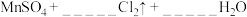 ,
,
(4)“地康法”制取氯气总反应的化学方程式为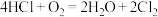 ,其反应原理如图所示:
,其反应原理如图所示:
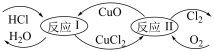
反应Ⅰ: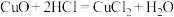
反应Ⅱ:……
反应Ⅱ的化学方程式为_____ 。
(1)实验室用舍勒的方法制取
 时选用图中装置
时选用图中装置 ”),反应的离子方程式为
”),反应的离子方程式为 中管
中管 的作用是
的作用是
(2)实验室制取干燥、纯净的
 ,所需图装置的接口连接顺序为:发生装置→
,所需图装置的接口连接顺序为:发生装置→
(3)反应停止后,实验小组检验烧瓶中还有
 和盐酸。小组同学探究不继续产生
和盐酸。小组同学探究不继续产生 的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。【提出猜想】
猜想1:
 降低,氧化剂
降低,氧化剂猜想2:
猜想3:
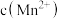 增大,氧化剂氧化性减弱。
增大,氧化剂氧化性减弱。【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
| 序号 | 实验操作 | 有、无氯气 | 结论 |
| 1 | 加入浓硫酸,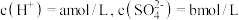 | 有氯气 | 猜想1正确 |
| 2 | 加入氯化钠固体,使 | 有氯气 | 猜想2正确 |
| 3 | 加入浓硫酸和 固体,使 固体,使 | 猜想3正确 |
 固体和
固体和 混合加热也可制取
混合加热也可制取 。
。请配平该反应的方程式:
_____
 (浓)
(浓) _
_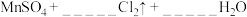 ,
,(4)“地康法”制取氯气总反应的化学方程式为
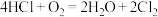 ,其反应原理如图所示:
,其反应原理如图所示:
反应Ⅰ:
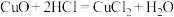
反应Ⅱ:……
反应Ⅱ的化学方程式为
您最近一年使用:0次
5 . 下列是都分短周期中第二、第三周期元素的原子半径及主要化合价.
回答下列问题:
(1)⑦在元素周期表中的位置是(周期、族)______________ 。
(2)七种元素的最高价氧化物的水化物中,酸性最强的是______________ ,碱性最强的是______________ (填化学式)。
(3)②、⑤、⑦的离子半径由大到小的顺序是______________ (填离子符号)。
(4)①、⑤、⑦按原子个数比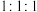 组成的盐是“84”消毒液的主要成分,与洁厕灵混合使用易发生中毒事件.从氧化还原反应的角度分析其原因是(用化学方程式表示)
组成的盐是“84”消毒液的主要成分,与洁厕灵混合使用易发生中毒事件.从氧化还原反应的角度分析其原因是(用化学方程式表示)______________ 。
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
原子半径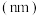 | 0.186 | 0.160 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 |  |  |  | +5、-3 | +7、-1 | +5、-3 | 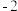 |
(1)⑦在元素周期表中的位置是(周期、族)
(2)七种元素的最高价氧化物的水化物中,酸性最强的是
(3)②、⑤、⑦的离子半径由大到小的顺序是
(4)①、⑤、⑦按原子个数比
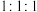 组成的盐是“84”消毒液的主要成分,与洁厕灵混合使用易发生中毒事件.从氧化还原反应的角度分析其原因是(用化学方程式表示)
组成的盐是“84”消毒液的主要成分,与洁厕灵混合使用易发生中毒事件.从氧化还原反应的角度分析其原因是(用化学方程式表示)
您最近一年使用:0次
6 . 把图2中的物质补充到图1中,可得到一个完整的氧化还原型离子方程式(未配平)。
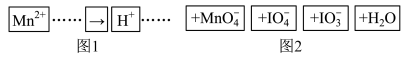
对该氧化还原反应型离子方程式,说法不正确的是
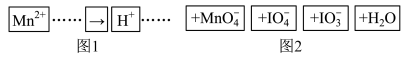
对该氧化还原反应型离子方程式,说法不正确的是
A. 作氧化剂具有氧化性 作氧化剂具有氧化性 |
| B.氧化剂和还原剂的个数之比为5:2 |
C.若有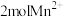 参加反应时则转移电子的个数为 参加反应时则转移电子的个数为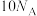 |
D.氧化性: |
您最近一年使用:0次
2024-02-02更新
|
105次组卷
|
2卷引用:天津市第四十七中学2023-2024学年高一上学期12月月考化学试题
名校
7 . 下列实验中,离子方程式书写不正确的是
A. 与稀硫酸混合: 与稀硫酸混合: |
| B.向FeSO4溶液中加入铁氰化钾溶液: Fe2+ +K++[Fe(CN)6]3-=KFe[ Fe(CN)6]↓ |
C.过量的Fe与稀硝酸反应: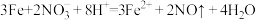 |
D.用Cu电极电解CuSO4溶液:2Cu2++2H2O 4H++O2↑+Cu 4H++O2↑+Cu |
您最近一年使用:0次
名校
8 . 亚硝酸钠( )是重要的防腐剂。某化学兴趣小组尝试制备亚硝酸钠,查阅资料:
)是重要的防腐剂。某化学兴趣小组尝试制备亚硝酸钠,查阅资料: 为弱酸,在酸性溶液中,
为弱酸,在酸性溶液中, 可将
可将 还原为
还原为 且无气体生成。
且无气体生成。
(一)亚硝酸钠固体含量的测定及性质验证
称取 固体样品(杂质不与酸性
固体样品(杂质不与酸性 溶液反应)4.000g溶于水配成250
溶液反应)4.000g溶于水配成250 溶液,取25.00
溶液,取25.00 溶液于锥形瓶中,用0.1000
溶液于锥形瓶中,用0.1000 酸性
酸性 溶液进行滴定,实验所得数据如下表所示:
溶液进行滴定,实验所得数据如下表所示:
(1)第一组实验数据出现异常,造成这种异常的原因可能是____ (填字母)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
(2)酸性高锰酸钾滴定 的离子反应方程式
的离子反应方程式__________ 。
(3)滴定时将高锰酸钾标准溶液注入______ (填“酸”或“碱”)式滴定管中,该实验滴定终点的现象是_____ 。
(4)根据表中数据,计算所得固体中亚硝酸钠( )的质量分数
)的质量分数_______ 。
(5)亚硝酸钠易溶于水,将0.2 的亚硝酸钠溶液和0.1
的亚硝酸钠溶液和0.1 的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为
的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为________ 。
(二)反应废液的处理
反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用 溶液调成中性,再用电化学降解法进行处理。25℃时,反应进行10min,溶液的
溶液调成中性,再用电化学降解法进行处理。25℃时,反应进行10min,溶液的 由7变为12.电化学降解
由7变为12.电化学降解 的原理如下图所示。
的原理如下图所示。
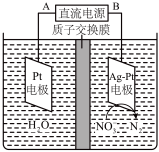
(6)电源正极为_____ (填A或B),阴极反应式为___________ 。
 )是重要的防腐剂。某化学兴趣小组尝试制备亚硝酸钠,查阅资料:
)是重要的防腐剂。某化学兴趣小组尝试制备亚硝酸钠,查阅资料: 为弱酸,在酸性溶液中,
为弱酸,在酸性溶液中, 可将
可将 还原为
还原为 且无气体生成。
且无气体生成。(一)亚硝酸钠固体含量的测定及性质验证
称取
 固体样品(杂质不与酸性
固体样品(杂质不与酸性 溶液反应)4.000g溶于水配成250
溶液反应)4.000g溶于水配成250 溶液,取25.00
溶液,取25.00 溶液于锥形瓶中,用0.1000
溶液于锥形瓶中,用0.1000 酸性
酸性 溶液进行滴定,实验所得数据如下表所示:
溶液进行滴定,实验所得数据如下表所示:| 滴定次数 | 1 | 2 | 3 | 4 |
 溶液体积/ 溶液体积/ | 20.60 | 20.02 | 20.00 | 19.98 |
(1)第一组实验数据出现异常,造成这种异常的原因可能是
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
(2)酸性高锰酸钾滴定
 的离子反应方程式
的离子反应方程式(3)滴定时将高锰酸钾标准溶液注入
(4)根据表中数据,计算所得固体中亚硝酸钠(
 )的质量分数
)的质量分数(5)亚硝酸钠易溶于水,将0.2
 的亚硝酸钠溶液和0.1
的亚硝酸钠溶液和0.1 的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为
的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为(二)反应废液的处理
反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用
 溶液调成中性,再用电化学降解法进行处理。25℃时,反应进行10min,溶液的
溶液调成中性,再用电化学降解法进行处理。25℃时,反应进行10min,溶液的 由7变为12.电化学降解
由7变为12.电化学降解 的原理如下图所示。
的原理如下图所示。
(6)电源正极为
您最近一年使用:0次
9 . 二氧化氯ClO2是一种黄绿色气体,在工业上常用作水处理剂、漂白剂。在处理废水时,ClO2可将废水中的CN-(其中C为+2价)氧化成CO2和N2,其离子方程式为xClO2+yCN-=2CO2+N2+2Cl-。下列说法错误 的是
| A.x=y=2 |
| B.氧化性:ClO2>CO2 |
| C.氧化产物与还原产物的个数比为3:2 |
| D.当生成1molN2分子时,转移6mol电子 |
您最近一年使用:0次
2024-01-18更新
|
129次组卷
|
3卷引用: 天津市武清区杨村第一中学2023-2024学年高一上学期第三次阶段检测化学试题
名校
解题方法
10 . 某兴趣小组设计如图实验装置制备次磷酸钠(NaH2PO2)。
已知:①白磷(P4)在空气中可自燃,与过量烧碱溶液混合,80~ 90℃生成NaH2PO2和PH3。
②PH3是一种有强还原性的有毒气体,空气中可自燃,可与NaClO溶液反应生成NaH2PO2。
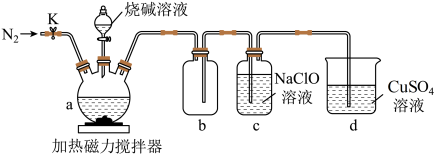
(1)仪器a的名称是___________ ,a 中发生反应的化学方程式是___________ 。
(2)仪器b组成的装置的作用是___________ ,检查装置气密性后,应先打开K通入N2一段时间,目的是___________ 。
(3)下列有关说法正确的是___________ 。
A.次磷酸(H3PO2)是三元酸
B.为加快反应速率,投料前应先在通风橱内将白磷碾成薄片状
C.d中所盛硫酸铜溶液,可用酸性高锰酸钾溶液代替
(4)①仪器c中充分反应后生成NaH2PO2和NaCl,经过一系列操作可获得固体NaH2PO2,相关物质的溶解度(S)如下:
从下列选项a-g中选择合理的仪器或操作,补全如下步骤。
取仪器c中溶液,用蒸发皿___________→___________(趁热过滤)→用烧杯(冷却结晶)→用漏斗(过滤得到NaH2PO2)→___________→干燥→NaH2PO2粗品。___________
选项:a.溶解 b.过滤 c.洗涤 d.普通三角漏斗 e.保温漏斗 f.蒸发浓缩至有大量晶体析出 g.蒸发浓缩至溶液表面出现晶膜
②写出c中发生反应的离子方程式___________ 。
(5)产品纯度的测定:
取产品mg配成250mL溶液,取25mL于锥形瓶中,然后用0.01 KMnO4标准溶液滴定至终点(还原产物是Mn2+,氧化产物是
KMnO4标准溶液滴定至终点(还原产物是Mn2+,氧化产物是 ),达到滴定终点时消耗VmL标准溶液,产品的纯度为
),达到滴定终点时消耗VmL标准溶液,产品的纯度为___________ 。
已知:①白磷(P4)在空气中可自燃,与过量烧碱溶液混合,80~ 90℃生成NaH2PO2和PH3。
②PH3是一种有强还原性的有毒气体,空气中可自燃,可与NaClO溶液反应生成NaH2PO2。

(1)仪器a的名称是
(2)仪器b组成的装置的作用是
(3)下列有关说法正确的是
A.次磷酸(H3PO2)是三元酸
B.为加快反应速率,投料前应先在通风橱内将白磷碾成薄片状
C.d中所盛硫酸铜溶液,可用酸性高锰酸钾溶液代替
(4)①仪器c中充分反应后生成NaH2PO2和NaCl,经过一系列操作可获得固体NaH2PO2,相关物质的溶解度(S)如下:
| S(25℃) | S(100℃) | |
| NaCl | 37 | 39 |
| NaH2PO2 | 100 | 667 |
取仪器c中溶液,用蒸发皿___________→___________(趁热过滤)→用烧杯(冷却结晶)→用漏斗(过滤得到NaH2PO2)→___________→干燥→NaH2PO2粗品。
选项:a.溶解 b.过滤 c.洗涤 d.普通三角漏斗 e.保温漏斗 f.蒸发浓缩至有大量晶体析出 g.蒸发浓缩至溶液表面出现晶膜
②写出c中发生反应的离子方程式
(5)产品纯度的测定:
取产品mg配成250mL溶液,取25mL于锥形瓶中,然后用0.01
 KMnO4标准溶液滴定至终点(还原产物是Mn2+,氧化产物是
KMnO4标准溶液滴定至终点(还原产物是Mn2+,氧化产物是 ),达到滴定终点时消耗VmL标准溶液,产品的纯度为
),达到滴定终点时消耗VmL标准溶液,产品的纯度为
您最近一年使用:0次



