名校
1 . 下列反应的离子方程式正确的是
A.碘化亚铁溶液与等物质的量的氯气: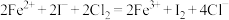 |
B.过量铁粉加入稀硝酸中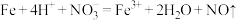 |
C.NaOH溶液与少量H2C2O4溶液反应: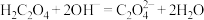 |
D.CuSO4溶液与过量浓氨水反应的离子方程式: |
您最近一年使用:0次
解题方法
2 . 以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下:_______ (填化学式)。
②每有1mol NaClO3参加反应,理论上可生成ClO2的物质的量为_______ mol。
(2)反应2在如图1装置中发生(该反应放出大量的热,且温度高于60℃时NaClO2分解生成NaClO3和NaCl)_______ 。
②实际反应中发现消耗的NaOH比理论值偏少,原因可能是_______ 。
③通常会将该装置放置于冰水浴中,其目的是_______ 。
a.提高ClO2吸收率 b.防止NaClO2分解 c.提高反应速度
(3)ClO2是一种广谱型消毒剂,对一切经水体传播的病原微生物均有很好的杀灭效果。用ClO2处理过的水中ClO2、 的含量可用连续碘量法进行测定。ClO2被I-还原为
的含量可用连续碘量法进行测定。ClO2被I-还原为 或Cl-的转化率与溶液的
或Cl-的转化率与溶液的 关系如图2所示。
关系如图2所示。
滴定步骤:①准确量取100mL水样加到碘量瓶中,调节水样的 为
为 ,加入足量的KI晶体,充分反应后,用0.1mol / L Na2S2O3溶液滴定至淡黄色,加入淀粉溶液,滴定至终点,消耗Na2S2O3溶液45mL。②调节溶液的pH< 2.0,
,加入足量的KI晶体,充分反应后,用0.1mol / L Na2S2O3溶液滴定至淡黄色,加入淀粉溶液,滴定至终点,消耗Na2S2O3溶液45mL。②调节溶液的pH< 2.0, 可以被I-完全转化为Cl-,继续用0.1mol / L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液200mL。
可以被I-完全转化为Cl-,继续用0.1mol / L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液200mL。
根据上述数据,测得该水样中的 浓度是多少
浓度是多少_____ ?
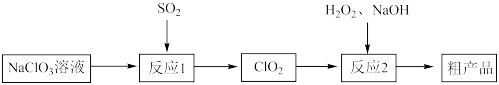
②每有1mol NaClO3参加反应,理论上可生成ClO2的物质的量为
(2)反应2在如图1装置中发生(该反应放出大量的热,且温度高于60℃时NaClO2分解生成NaClO3和NaCl)
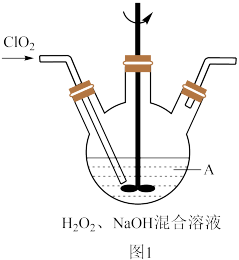
②实际反应中发现消耗的NaOH比理论值偏少,原因可能是
③通常会将该装置放置于冰水浴中,其目的是
a.提高ClO2吸收率 b.防止NaClO2分解 c.提高反应速度
(3)ClO2是一种广谱型消毒剂,对一切经水体传播的病原微生物均有很好的杀灭效果。用ClO2处理过的水中ClO2、
 的含量可用连续碘量法进行测定。ClO2被I-还原为
的含量可用连续碘量法进行测定。ClO2被I-还原为 或Cl-的转化率与溶液的
或Cl-的转化率与溶液的 关系如图2所示。
关系如图2所示。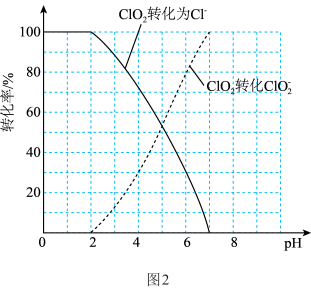
滴定步骤:①准确量取100mL水样加到碘量瓶中,调节水样的
 为
为 ,加入足量的KI晶体,充分反应后,用0.1mol / L Na2S2O3溶液滴定至淡黄色,加入淀粉溶液,滴定至终点,消耗Na2S2O3溶液45mL。②调节溶液的pH< 2.0,
,加入足量的KI晶体,充分反应后,用0.1mol / L Na2S2O3溶液滴定至淡黄色,加入淀粉溶液,滴定至终点,消耗Na2S2O3溶液45mL。②调节溶液的pH< 2.0, 可以被I-完全转化为Cl-,继续用0.1mol / L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液200mL。
可以被I-完全转化为Cl-,继续用0.1mol / L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液200mL。根据上述数据,测得该水样中的
 浓度是多少
浓度是多少
您最近一年使用:0次
3 . 硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物和两种非金属氧化物。
(1)组装好实验装置后,要进行的下一步操作是___________ ;实验开始时通入氮气的目的是___________ 。
(2)B中实验现象证明分解产物中含有___________ (写化学式)。依据实验2硬质玻璃管中加热冷却后的固体性质确定分解产物有___________ (写化学式)。
(3)某同学欲通过下列实验验证分解产物中含有的另一种非金属氧化物。
①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为
___________ 。___________ ,该现象体现了该物质的___________ 性。
③写出该条件下硫酸亚铁受热分解的化学方程式___________ 。
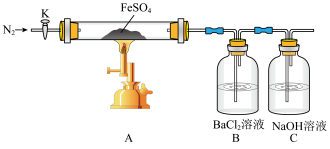
| 序号 | 操作步骤 | 实验现象 |
| 1 | 打开K,通入一段时间的 ,关闭活塞K,加热A中的玻璃管一段时间 ,关闭活塞K,加热A中的玻璃管一段时间 | B中产生大量白色沉淀 |
| 2 | A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却 | 硬质玻璃管中最终可以看到棕色固体物质 |
(2)B中实验现象证明分解产物中含有
(3)某同学欲通过下列实验验证分解产物中含有的另一种非金属氧化物。
①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为


③写出该条件下硫酸亚铁受热分解的化学方程式
您最近一年使用:0次
2023高一上·全国·专题练习
解题方法
4 . 配平下列方程式。
(1)____S+____KOH=____K2S+____K2SO3+____H2O;___________ 。
(2)____ +____H++____Cl-=____Mn2++____Cl2↑+____H2O;
+____H++____Cl-=____Mn2++____Cl2↑+____H2O;___________ 。
(1)____S+____KOH=____K2S+____K2SO3+____H2O;
(2)____
 +____H++____Cl-=____Mn2++____Cl2↑+____H2O;
+____H++____Cl-=____Mn2++____Cl2↑+____H2O;
您最近一年使用:0次
名校
5 . 海洋资源丰富,海水水资源的利用和海水化学资源(主要为 NaCl 和 MgSO4等物质及K、Br 等元素)的利用具有非常广阔的前景。
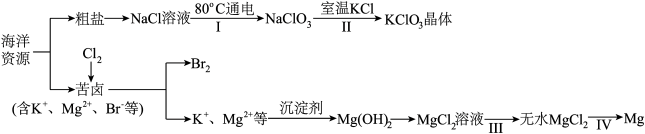
回答下列问题:
(1)Br 元素价电子排布式___________
(2)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填标号)。
(3)步骤Ⅰ利用电解法制备,写出阳极发生的反应方程式:___________ ,步骤Ⅱ中能析出 KClO3晶体而无其他晶体析出的原因是___________ 。
(4)氯碱工业中产生的氯气有很多用途,将氯气 Cl2和H2O(g)通过灼热的炭层,生成 HCl 和CO2,当有 1 mol Cl2参与反应时释放出 145.0 kJ 热量,写出该反应的热化学方程式___________ 。
(5)利用氯气制出的三氯化硼(BCl3)是一种重要的化工原料,BCl3的空间构型为___________ 。
(6)工业上还可以用 NaClO 在碱性条件下把 Ni(OH)2转化为 Ni2O3,其离子方程式为___________ 。
(7)写出在含有 amolFeBr2的溶液中,通入 amolCl2的离子方程式___________ 。

回答下列问题:
(1)Br 元素价电子排布式
(2)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填标号)。
A.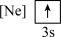 | B.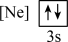 |
C.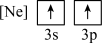 | D.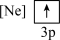 |
(4)氯碱工业中产生的氯气有很多用途,将氯气 Cl2和H2O(g)通过灼热的炭层,生成 HCl 和CO2,当有 1 mol Cl2参与反应时释放出 145.0 kJ 热量,写出该反应的热化学方程式
(5)利用氯气制出的三氯化硼(BCl3)是一种重要的化工原料,BCl3的空间构型为
(6)工业上还可以用 NaClO 在碱性条件下把 Ni(OH)2转化为 Ni2O3,其离子方程式为
(7)写出在含有 amolFeBr2的溶液中,通入 amolCl2的离子方程式
您最近一年使用:0次
名校
6 . 现有下列短周期元素性质的有关数据:
(1)根据元素周期律确定a至h8种元素在周期表中的位置,将它们的元素编号填入如表相应的空格内_______ 。
(2)上述元素形成的氢化物中,分子间存在氢键的有_______ (填氢化物的化学式)。
(3)氢化铝锂(LiAlH4)是一种易燃易爆具有极强还原性的物质,它在有机合成上应用广泛。在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH)。
①氢化铝锂易水解(与水反应),最初得三种产物,请写出其水解反应化学方程式:_______ 。
②与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,请画出这种还原剂的电子式:_______ ,写出该物质受热分解的反应方程式:_______ 。
| 元素编号 | a | b | c | d | e | f | g | h |
| 原子半径/nm | 0.037 | 0.071 | 0.075 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最低 | +1 | -1 | -3 | +3 | -2 | +3 | +1 | +1 |
| Ⅰ族 | Ⅱ族 | Ⅲ族 | Ⅳ族 | Ⅴ族 | Ⅵ族 | Ⅶ族 | Ⅷ族 | |
| 第一周期 | _____ | |||||||
| 第二周期 | _____ | _____ | _____ | _____ | ||||
| 第三周期 | _____ | _____ | _____ |
(3)氢化铝锂(LiAlH4)是一种易燃易爆具有极强还原性的物质,它在有机合成上应用广泛。在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH)。
①氢化铝锂易水解(与水反应),最初得三种产物,请写出其水解反应化学方程式:
②与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,请画出这种还原剂的电子式:
您最近一年使用:0次
名校
解题方法
7 . 某研究小组以工厂废渣(Fe3O4、Al2O3、SiO2)为原料制取Fe2O3工艺流程如图。回答下列问题:

(1)“碱浸”时可能发生反应的化学方程式为_______ 。“酸溶”时发生反应的化学方程式为_______ 。
(2)“操作a”的名称为_______ ,用到的玻璃仪器有玻璃棒、_______ 。
(3)“氧化”的目的是_______ 。_______ (填能或否)用H2O2代替O2。
(4)“沉铁”步骤可观察到现象是_______ 。
(5)操作c中所发生的化学反应方程式为_______ 。

(1)“碱浸”时可能发生反应的化学方程式为
(2)“操作a”的名称为
(3)“氧化”的目的是
(4)“沉铁”步骤可观察到现象是
(5)操作c中所发生的化学反应方程式为
您最近一年使用:0次
8 . I.化学兴趣小组对以下实验进行探究:
(1)牙膏摩擦剂由碳酸钙、氢氧化铝组成;写出氢氧化铝与NaOH溶液反应的离子方程式______ 。
II.现欲探究铁及其化合物的氧化性或还原性,请完成以下实验报告:
(2)称取用磨砂纸打磨后的铁钉2.8g放入50.0mL稀硫酸中,充分反应后若2.8g纯净的Fe全部参加反应。反应中转移______ mol电子。
(3)下列有关Fe2+的说法不正确的是_______ (选填序号)。
III.卤族元素是典型的非金属元素,已知稀溴水与稀铁盐(含Fe3+)溶液的颜色相近;Cl2能将Fe2+氧化为Fe3+;Fe3+能将I-氧化为I2。请完成以下实验报告:
(4)关于F、Cl、Br、I的比较,不正确的是_______ (选填序号)。
(5)稀溴水的颜色为_______ 。
(6)将Fe2+逐滴滴加到稀溴水溶液中,再加入几滴淀粉碘化钾溶液。溶液变为蓝色,不能证明证明Br2能将Fe2+氧化为Fe3+,因为Br2与I-作用产生的碘可以使淀粉变蓝,写出Br2与I-作用的离子方程式_______ 。另将Fe2+逐滴滴加到另一份稀溴水溶液中,加入几滴______ 溶液,溶液变为红色,证明Br2能将Fe2+氧化为Fe3+。
(7)另取20mLFeSO4溶液,向其中通入Cl2。若Fe2+恰好完全转化为Fe3+,消耗的Cl2在标准状况下的体积为0.336L,则该FeSO4溶液的物质的量浓度为______ mol/L。
(1)牙膏摩擦剂由碳酸钙、氢氧化铝组成;写出氢氧化铝与NaOH溶液反应的离子方程式
II.现欲探究铁及其化合物的氧化性或还原性,请完成以下实验报告:
(2)称取用磨砂纸打磨后的铁钉2.8g放入50.0mL稀硫酸中,充分反应后若2.8g纯净的Fe全部参加反应。反应中转移
(3)下列有关Fe2+的说法不正确的是
| A.可以先加KSCN溶液再加氯水来检验Fe2+ |
| B.可以先加铁粉再加KSCN溶液来检验Fe2+ |
| C.能使酸性KMnO4溶液紫色褪去 |
| D.能观察到溶液颜色为浅绿色 |
III.卤族元素是典型的非金属元素,已知稀溴水与稀铁盐(含Fe3+)溶液的颜色相近;Cl2能将Fe2+氧化为Fe3+;Fe3+能将I-氧化为I2。请完成以下实验报告:
(4)关于F、Cl、Br、I的比较,不正确的是
| A.它们的原子核外电子层数随核电荷数的增加而增多 |
| B.单质(F2、Cl2、Br2、I2)的氧化性随核电荷数的增加而减弱 |
| C.被其他卤素单质从卤化物中置换出来的可能性随原子序数的增加而增大 |
| D.它们的氢化物的稳定性随原子序数的增加而增强 |
(6)将Fe2+逐滴滴加到稀溴水溶液中,再加入几滴淀粉碘化钾溶液。溶液变为蓝色,不能证明证明Br2能将Fe2+氧化为Fe3+,因为Br2与I-作用产生的碘可以使淀粉变蓝,写出Br2与I-作用的离子方程式
(7)另取20mLFeSO4溶液,向其中通入Cl2。若Fe2+恰好完全转化为Fe3+,消耗的Cl2在标准状况下的体积为0.336L,则该FeSO4溶液的物质的量浓度为
您最近一年使用:0次
解题方法
9 . 有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
(1)岩脑砂的制备:

①利用装置A制取实验所需的氨气,写出反应的化学方程式:___________ 。
②该实验中用浓盐酸与MnO2反应制取所需氯气,写出该反应的离子方程式:___________ 。则装置E中的试剂是(填写试剂名称)___________ 。
③为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序__________
a→d→c→___________←j←i←h←g←b。
④证明氨气和氯气反应有岩脑砂生成,需要的检验试剂中,除了蒸馏水、稀HNO3、NaOH溶液外,还需要___________ 、 ___________ 等两种。
(2)氨气和氯气反应制取岩脑砂时同时生成N2。
①氨气和氯气反应生成N2的化学方程式是___________ 。
②在制取到16.05 g NH4Cl时,同时生成___________ L的N2(标准状况下)。
(1)岩脑砂的制备:

①利用装置A制取实验所需的氨气,写出反应的化学方程式:
②该实验中用浓盐酸与MnO2反应制取所需氯气,写出该反应的离子方程式:
③为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序
a→d→c→___________←j←i←h←g←b。
④证明氨气和氯气反应有岩脑砂生成,需要的检验试剂中,除了蒸馏水、稀HNO3、NaOH溶液外,还需要
(2)氨气和氯气反应制取岩脑砂时同时生成N2。
①氨气和氯气反应生成N2的化学方程式是
②在制取到16.05 g NH4Cl时,同时生成
您最近一年使用:0次
2023-06-06更新
|
188次组卷
|
2卷引用:天津市红桥区2022-2023学年高三上学期期中考试化学试题
名校
解题方法
10 . 下列叙述对应的离子方程式正确的是
A.向饱和NaOH溶液通入过量 析出白色晶体: 析出白色晶体: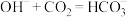 |
B.白色沉淀CuCl溶于 - - 溶液得到深蓝色溶液: 溶液得到深蓝色溶液:  |
C.向 溶液中滴入酸化的 溶液中滴入酸化的 溶液产生白色沉淀: 溶液产生白色沉淀: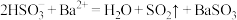 |
D.向 溶液中滴入 溶液中滴入 溶液产生黑色沉淀和气泡: 溶液产生黑色沉淀和气泡:  |
您最近一年使用:0次
2023-05-24更新
|
2423次组卷
|
10卷引用:T2-离子反应
(已下线)T2-离子反应湖南省部分名校联盟2023届高三5月冲刺压轴大联考化学试题(已下线)专题04 离子方程式与离子共存-2023年高考化学真题题源解密(新高考专用)化学02(15+4模式)2024年1月“九省联考”考前化学猜想卷湖南省衡阳市第八中学2023-2024学年高三上学期1月月考化学(已下线)热点03 离子方程式的正误判断、离子共存江西省宜春市丰城市第九中学2023-2024学年高三上学期期末考试化学试题2024届湖南省长沙市第一中高三下学期高考适应性演练(一)化学试题江西省宜春市上高县2023-2024学年高三下学期5月月考化学试题2024届湖北省荆州中学高三下学期第三次适应性考试化学试卷



