海洋资源丰富,海水水资源的利用和海水化学资源(主要为 NaCl 和 MgSO4等物质及K、Br 等元素)的利用具有非常广阔的前景。
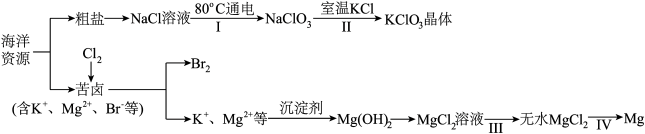
回答下列问题:
(1)Br 元素价电子排布式___________
(2)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填标号)。
(3)步骤Ⅰ利用电解法制备,写出阳极发生的反应方程式:___________ ,步骤Ⅱ中能析出 KClO3晶体而无其他晶体析出的原因是___________ 。
(4)氯碱工业中产生的氯气有很多用途,将氯气 Cl2和H2O(g)通过灼热的炭层,生成 HCl 和CO2,当有 1 mol Cl2参与反应时释放出 145.0 kJ 热量,写出该反应的热化学方程式___________ 。
(5)利用氯气制出的三氯化硼(BCl3)是一种重要的化工原料,BCl3的空间构型为___________ 。
(6)工业上还可以用 NaClO 在碱性条件下把 Ni(OH)2转化为 Ni2O3,其离子方程式为___________ 。
(7)写出在含有 amolFeBr2的溶液中,通入 amolCl2的离子方程式___________ 。

回答下列问题:
(1)Br 元素价电子排布式
(2)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填标号)。
A.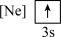 | B.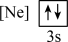 |
C.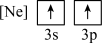 | D.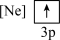 |
(4)氯碱工业中产生的氯气有很多用途,将氯气 Cl2和H2O(g)通过灼热的炭层,生成 HCl 和CO2,当有 1 mol Cl2参与反应时释放出 145.0 kJ 热量,写出该反应的热化学方程式
(5)利用氯气制出的三氯化硼(BCl3)是一种重要的化工原料,BCl3的空间构型为
(6)工业上还可以用 NaClO 在碱性条件下把 Ni(OH)2转化为 Ni2O3,其离子方程式为
(7)写出在含有 amolFeBr2的溶液中,通入 amolCl2的离子方程式
更新时间:2023-07-06 08:02:05
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某兴趣小组同学为探究黑木耳中含铁量,进行如下实验.
已知:i.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素C)等.每100g黑木耳含铁量高达185mg.
ii. 与亚铁离子反应生成特征蓝色沉淀.
与亚铁离子反应生成特征蓝色沉淀.
Ⅰ.为确定黑木耳中含有铁元素,甲同学设计实验方案如下.

(1)步骤①中的黑木耳放在_________ 中加热
(2)步骤④检验 所用试剂是
所用试剂是_________ (填名称)溶液
(3)下列有关上述实验得出的结论是_________ (填字母)
a.黑木耳中一定含
b.白色沉淀中一定含
c.滤液A中一定含 和
和
Ⅱ.为测定黑木耳中铁元素的含量,乙同学设计实验方案如下
(4)可选做试剂B的物质是_________ (填字母)
a. b. Zn c. Fe d.Cu
b. Zn c. Fe d.Cu
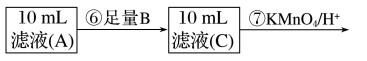
(5)步骤⑦中观察到的实验现象是_________ ,反应的离子方程式是__________________
(6)若乙同学实验操作规范,但测得含铁量远大于实际的含量,其可能的原因是__________________
已知:i.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素C)等.每100g黑木耳含铁量高达185mg.
ii.
 与亚铁离子反应生成特征蓝色沉淀.
与亚铁离子反应生成特征蓝色沉淀.Ⅰ.为确定黑木耳中含有铁元素,甲同学设计实验方案如下.

(1)步骤①中的黑木耳放在
(2)步骤④检验
 所用试剂是
所用试剂是(3)下列有关上述实验得出的结论是
a.黑木耳中一定含

b.白色沉淀中一定含

c.滤液A中一定含
 和
和
Ⅱ.为测定黑木耳中铁元素的含量,乙同学设计实验方案如下
(4)可选做试剂B的物质是
a.
 b. Zn c. Fe d.Cu
b. Zn c. Fe d.Cu
(5)步骤⑦中观察到的实验现象是
(6)若乙同学实验操作规范,但测得含铁量远大于实际的含量,其可能的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
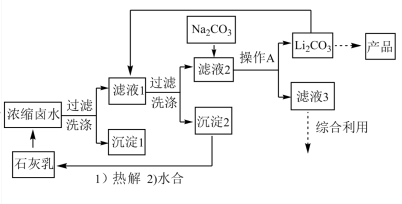
【推荐2】全球对锂资源的需求不断增长,“盐湖提锂”越来越受到重视。某兴趣小组取盐湖水进行浓缩和初步除杂后,得到浓缩卤水(含有 、
、 、
、 和少量
和少量 、
、 ),并设计了以下流程通过制备碳酸锂来提取锂。
),并设计了以下流程通过制备碳酸锂来提取锂。
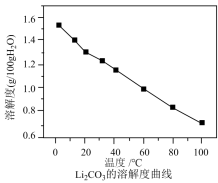
25℃时相关物质的参数如下,回答下列问题:
 的溶解度:
的溶解度:
(1)“沉淀1”为_______ 。
(2)向“滤液1”中加入适量固体 的目的是
的目的是_______ 。
(3)为提高 的析出量和纯度,“操作A”依次为
的析出量和纯度,“操作A”依次为_______ 、_______ 、洗涤。
(4)有同学建议用“侯氏制碱法”的原理制备 。查阅资料后,发现文献对常温下的
。查阅资料后,发现文献对常温下的 有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究
有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究 的性质,将饱和
的性质,将饱和 溶液与饱和
溶液与饱和 溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。上述现象说明,在该实验条件下
溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。上述现象说明,在该实验条件下
_______ (填“稳定”或“不稳定”),有关反应的离子方程式为_______ 。
(5)他们结合(4)的探究结果,拟将原流程中向“滤液2”加入 改为通入
改为通入 。这一改动能否达到相同的效果,作出你的判断并给出理由:
。这一改动能否达到相同的效果,作出你的判断并给出理由:_______ 。
(6)在高温条件下, 、葡萄糖
、葡萄糖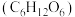 和
和 可制备电极材料
可制备电极材料 ,同时生成CO和H2O,该反应的化学方程式为
,同时生成CO和H2O,该反应的化学方程式为_______ 。
 、
、 、
、 和少量
和少量 、
、 ),并设计了以下流程通过制备碳酸锂来提取锂。
),并设计了以下流程通过制备碳酸锂来提取锂。
25℃时相关物质的参数如下,回答下列问题:
 的溶解度:
的溶解度:
| 化合物 |  |
 |  |
 | 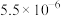 |
 | 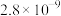 |
 | 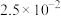 |

(1)“沉淀1”为
(2)向“滤液1”中加入适量固体
 的目的是
的目的是(3)为提高
 的析出量和纯度,“操作A”依次为
的析出量和纯度,“操作A”依次为(4)有同学建议用“侯氏制碱法”的原理制备
 。查阅资料后,发现文献对常温下的
。查阅资料后,发现文献对常温下的 有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究
有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究 的性质,将饱和
的性质,将饱和 溶液与饱和
溶液与饱和 溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。上述现象说明,在该实验条件下
溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。上述现象说明,在该实验条件下
(5)他们结合(4)的探究结果,拟将原流程中向“滤液2”加入
 改为通入
改为通入 。这一改动能否达到相同的效果,作出你的判断并给出理由:
。这一改动能否达到相同的效果,作出你的判断并给出理由:(6)在高温条件下,
 、葡萄糖
、葡萄糖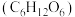 和
和 可制备电极材料
可制备电极材料 ,同时生成CO和H2O,该反应的化学方程式为
,同时生成CO和H2O,该反应的化学方程式为
您最近一年使用:0次
【推荐3】黄钠铁矾渣的主要成分如下表所示,利用其制备镍锌铁氧体(Ni0.5Zn0.5Fe2O4)的工艺流程如下图所示:
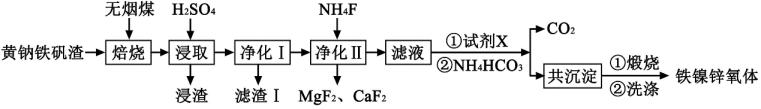
已知:i.浸取液中的阳离子有Fe2+、Ni2+、Mg2+、Al3+、Ca2+;
ii.晶体完整度与晶体中Ni、Zn、Fe的比例有关;
iii.Zn(OH)2是两性氢氧化物。
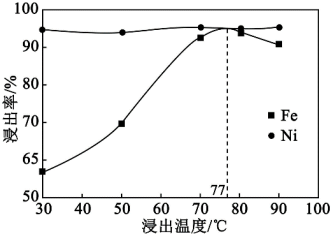
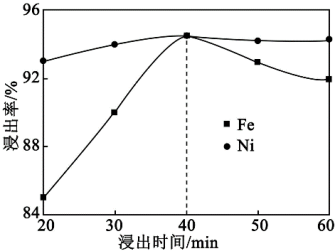
(1)无烟煤的主要作用是___________ ,控制其他条件不变,Fe和Ni的浸出率与浸出温度和浸出时间的关系如下图所示,则浸出过程中最适宜的条件是___________
(2)浸渣的主要成分除SiO2外还有___________
(3)净化I的目的是___________
(4)为按计量制得镍锌铁氧体,加入试剂X是为了引入___________ (填离子符号)。
(5)在Fe2+、Ni2+、Zn2+共沉淀过程中,若以Me代表Fe、Ni、Zn元素,则生成MeCO3·2Me(OH)2·H2O沉淀的离子方程式为___________ 。
(6)检验沉淀已洗涤干净的操作和现象是___________ 。
(7)经测定,加入NH4HCO3调节pH=7.2时晶体完整度最高,pH不宜过高的原因是______ 。
| 元素 | Fe(III) | Ni | Mg | Al | Pb | SiO2 | Ba | Ca |
| 百分含量/% | 28.750 | 2.625 | 0.031 | 0.452 | 0.086 | 0.369 | 8.785 | 0.198 |

已知:i.浸取液中的阳离子有Fe2+、Ni2+、Mg2+、Al3+、Ca2+;
ii.晶体完整度与晶体中Ni、Zn、Fe的比例有关;
iii.Zn(OH)2是两性氢氧化物。
(1)无烟煤的主要作用是


(2)浸渣的主要成分除SiO2外还有
(3)净化I的目的是
(4)为按计量制得镍锌铁氧体,加入试剂X是为了引入
(5)在Fe2+、Ni2+、Zn2+共沉淀过程中,若以Me代表Fe、Ni、Zn元素,则生成MeCO3·2Me(OH)2·H2O沉淀的离子方程式为
(6)检验沉淀已洗涤干净的操作和现象是
(7)经测定,加入NH4HCO3调节pH=7.2时晶体完整度最高,pH不宜过高的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】饮用水中含砷会导致砷中毒,金属冶炼过程产生的含砷有毒废物需处理与检测。冶炼废水中砷元素主要以亚砷酸 形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:
形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图: 与过量的
与过量的 存在反应:
存在反应: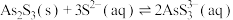 ;
;
②亚砷酸 盐的溶解性大于相应的砷酸
盐的溶解性大于相应的砷酸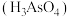 盐。
盐。
(1)①实验操作1和2是___________ 。
②“一级沉砷”先加入硫化钠主要发生的离子反应是:___________ 。
③一级沉砷后再加入硫酸亚铁的主要作用是:___________ 。
(2)“二级沉砷”先加入双氧水发生的反应有:___________ 。沉淀 的成分是
的成分是___________ 。
(3)关于地下水中砷的来源有多种假设,其中一种认为富含砷的黄铁矿 被氧化为
被氧化为 ,同时生成
,同时生成 ,导致砷脱离矿体进入地下水。
,导致砷脱离矿体进入地下水。 被
被 氧化的离子方程式是
氧化的离子方程式是___________ 。
(4)测定某 溶液(含少量
溶液(含少量 )中
)中 浓度的一种方法如下:
浓度的一种方法如下:
已知:用 标准溶液滴定弱酸溶液,一般要求弱酸的
标准溶液滴定弱酸溶液,一般要求弱酸的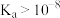 。
。
i.调 :取
:取 待测液,向其中滴入适量
待测液,向其中滴入适量 溶液调节
溶液调节 ,中和
,中和 。
。
ii.氧化:向上述溶液中加入适量碘水,将 氧化为
氧化为 。
。
iii.滴定:用 标准溶液滴定ⅱ中得到的
标准溶液滴定ⅱ中得到的 溶液至终点,消耗
溶液至终点,消耗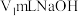 标准溶液。
标准溶液。___________ 。
②若无i,会导致测定的 浓度
浓度___________ (填“偏高”或“偏低”)。
③通过计算可知亚砷酸的浓度为___________ 。
 形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:
形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图: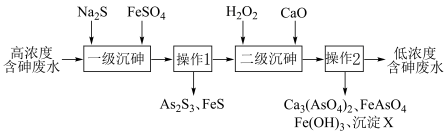
 与过量的
与过量的 存在反应:
存在反应: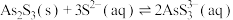 ;
;②亚砷酸
 盐的溶解性大于相应的砷酸
盐的溶解性大于相应的砷酸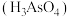 盐。
盐。(1)①实验操作1和2是
②“一级沉砷”先加入硫化钠主要发生的离子反应是:
③一级沉砷后再加入硫酸亚铁的主要作用是:
(2)“二级沉砷”先加入双氧水发生的反应有:
 的成分是
的成分是(3)关于地下水中砷的来源有多种假设,其中一种认为富含砷的黄铁矿
 被氧化为
被氧化为 ,同时生成
,同时生成 ,导致砷脱离矿体进入地下水。
,导致砷脱离矿体进入地下水。 被
被 氧化的离子方程式是
氧化的离子方程式是(4)测定某
 溶液(含少量
溶液(含少量 )中
)中 浓度的一种方法如下:
浓度的一种方法如下:已知:用
 标准溶液滴定弱酸溶液,一般要求弱酸的
标准溶液滴定弱酸溶液,一般要求弱酸的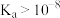 。
。i.调
 :取
:取 待测液,向其中滴入适量
待测液,向其中滴入适量 溶液调节
溶液调节 ,中和
,中和 。
。ii.氧化:向上述溶液中加入适量碘水,将
 氧化为
氧化为 。
。iii.滴定:用
 标准溶液滴定ⅱ中得到的
标准溶液滴定ⅱ中得到的 溶液至终点,消耗
溶液至终点,消耗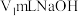 标准溶液。
标准溶液。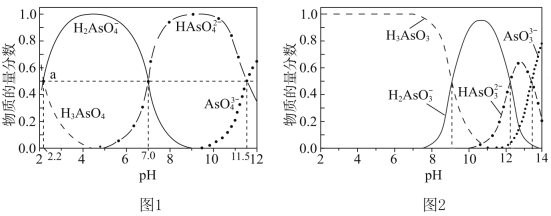
②若无i,会导致测定的
 浓度
浓度③通过计算可知亚砷酸的浓度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】黄铜矿不仅可用于火法炼铜,也可用于湿法炼铜,湿法可同时生产铜、磁性氧化铁和用于橡胶工业的一种固体物质A,流程如图:
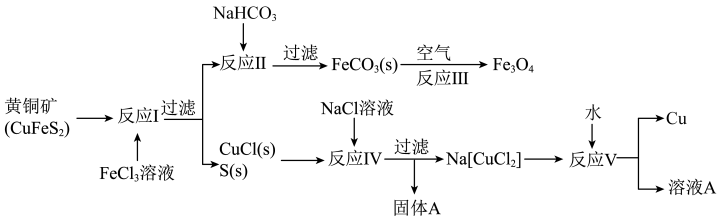
(1)写出反应I的离子方程式________________________ 。
(2)工业生产中的过滤操作多采用倾析法分离出固体物质,下列适合用倾析法的有__________ 。
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)在反应Ⅱ中,计算NaHCO3饱和溶液(其中CO32-平衡浓度为1.2×10-3 mol·L-1)可产生FeCO3沉淀时的最小Fe2+浓度是_________ 。(已知FeCO3的Ksp=3.0×10-11)
(4)反应Ⅲ是在设备底部鼓入空气,高温氧化煅烧法来制备磁性氧化铁,写出对应的化学方程式________________________________________ 。
(5)固体物质A的成分是_________ (写名称),溶液B中所含溶质是__________ (写化学式)。
(6)潮湿的FeCO3固体若不及时灼烧处理会在空气中逐渐变红褐色的Fe(OH)3固体,写出相关的化学方程式:_____________________________________________ 。
(7)本流程中可实现循环使用的物质除了水外,还有____________ 。

(1)写出反应I的离子方程式
(2)工业生产中的过滤操作多采用倾析法分离出固体物质,下列适合用倾析法的有
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)在反应Ⅱ中,计算NaHCO3饱和溶液(其中CO32-平衡浓度为1.2×10-3 mol·L-1)可产生FeCO3沉淀时的最小Fe2+浓度是
(4)反应Ⅲ是在设备底部鼓入空气,高温氧化煅烧法来制备磁性氧化铁,写出对应的化学方程式
(5)固体物质A的成分是
(6)潮湿的FeCO3固体若不及时灼烧处理会在空气中逐渐变红褐色的Fe(OH)3固体,写出相关的化学方程式:
(7)本流程中可实现循环使用的物质除了水外,还有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示:
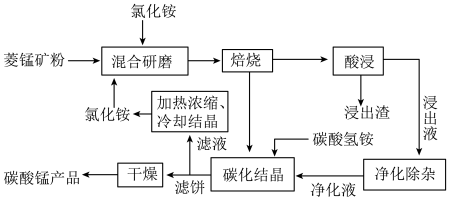
已知:
①菱锰矿的主要成分是 ,其中含Fe、Ca、Mg、Al等元素。
,其中含Fe、Ca、Mg、Al等元素。
② 、
、 沉淀完全的pH分别为
沉淀完全的pH分别为 、
、 ,
, 、
、 开始沉淀的pH分别为
开始沉淀的pH分别为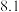 、
、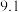 。
。
 焙烧过程中主要反应为
焙烧过程中主要反应为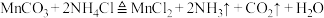 。
。
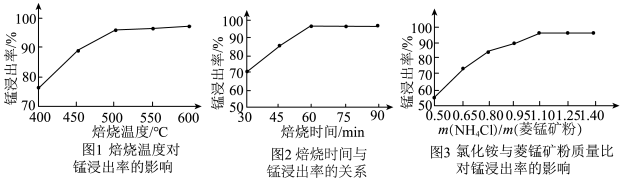
 结合图1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、
结合图1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、 分别为
分别为______ 、______ 、______ 。
 对浸出液净化除杂时,需先加入
对浸出液净化除杂时,需先加入 将
将 转化为
转化为 ,再调节溶液pH的范围为
,再调节溶液pH的范围为______ ,将 和
和 变为沉淀而除去,然后加入
变为沉淀而除去,然后加入 将
将 、
、 变为氟化物沉淀除去。
变为氟化物沉淀除去。
 “碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为
“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为______ 。
 上述流程中可循环使用的物质是
上述流程中可循环使用的物质是______ 。
 现用滴定法测定浸出液中
现用滴定法测定浸出液中 的含量。实验步骤:称取
的含量。实验步骤:称取 g试样,向其中加入稍过量的磷酸和硝酸,加热使反应
g试样,向其中加入稍过量的磷酸和硝酸,加热使反应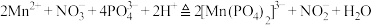 充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应
充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应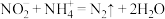 以除去
以除去 ;加入稀硫酸酸化,用
;加入稀硫酸酸化,用
 10.00mL硫酸亚铁铵标准溶液进行滴定,发生的反应为
10.00mL硫酸亚铁铵标准溶液进行滴定,发生的反应为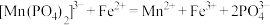 ;用
;用
 10.00mL酸性
10.00mL酸性 溶液恰好除去过量的
溶液恰好除去过量的 。
。
 酸性
酸性 溶液与
溶液与 反应
反应 还原产物是
还原产物是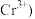 的离子方程式为
的离子方程式为______ 。
 试样中锰的质量分数为
试样中锰的质量分数为______ 。

已知:
①菱锰矿的主要成分是
 ,其中含Fe、Ca、Mg、Al等元素。
,其中含Fe、Ca、Mg、Al等元素。②
 、
、 沉淀完全的pH分别为
沉淀完全的pH分别为 、
、 ,
, 、
、 开始沉淀的pH分别为
开始沉淀的pH分别为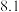 、
、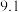 。
。 焙烧过程中主要反应为
焙烧过程中主要反应为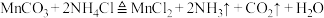 。
。 结合图1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、
结合图1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、 分别为
分别为
 对浸出液净化除杂时,需先加入
对浸出液净化除杂时,需先加入 将
将 转化为
转化为 ,再调节溶液pH的范围为
,再调节溶液pH的范围为 和
和 变为沉淀而除去,然后加入
变为沉淀而除去,然后加入 将
将 、
、 变为氟化物沉淀除去。
变为氟化物沉淀除去。 “碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为
“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为 上述流程中可循环使用的物质是
上述流程中可循环使用的物质是 现用滴定法测定浸出液中
现用滴定法测定浸出液中 的含量。实验步骤:称取
的含量。实验步骤:称取 g试样,向其中加入稍过量的磷酸和硝酸,加热使反应
g试样,向其中加入稍过量的磷酸和硝酸,加热使反应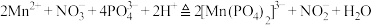 充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应
充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应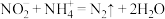 以除去
以除去 ;加入稀硫酸酸化,用
;加入稀硫酸酸化,用
 10.00mL硫酸亚铁铵标准溶液进行滴定,发生的反应为
10.00mL硫酸亚铁铵标准溶液进行滴定,发生的反应为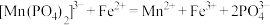 ;用
;用
 10.00mL酸性
10.00mL酸性 溶液恰好除去过量的
溶液恰好除去过量的 。
。 酸性
酸性 溶液与
溶液与 反应
反应 还原产物是
还原产物是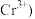 的离子方程式为
的离子方程式为 试样中锰的质量分数为
试样中锰的质量分数为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】X、Y、Z、M、Q、R是元素周期表前四周期元素,且原子序数依次增大,其相关信息如下表:
请用化学用语填空:
(1)请写出Q元素基态原子的外围电子排布图:_______ 。
(2)X、Y、Z、M四种元素的原子半径由大到小的顺序是__________ (用元素符号表示)。
(3)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是__________ 。
(4)写出Z元素的原子核外电子排布式_________ 。
(5)Q元素原子的未成对电子个数是________ 个。
| 元素 | 相关信息 |
| X | 原子核外有6种不同运动状态的电子 |
| Y | 基态原子中s电子总数与p电子总数相等 |
| Z | 原子半径在同周期元素中最大 |
| M | 逐级电离能(kJ/mol)依次为 578、1 817、2 745、11 575、14 830、18 376 |
| Q | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
| R | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
(1)请写出Q元素基态原子的外围电子排布图:
(2)X、Y、Z、M四种元素的原子半径由大到小的顺序是
(3)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是
(4)写出Z元素的原子核外电子排布式
(5)Q元素原子的未成对电子个数是
您最近一年使用:0次
【推荐2】我国科学家使用了新的铝铍埋藏测年法测量北京猿人的生存年代。这种方法的测量对象是石英(二氧化硅),它是砂石的主要成分。当宇宙射线打到地面时,会将石英中的硅原子和氧原子打破,生成铝和铍的同位素。只要测出一块石头中26Al和10Be的含量,就能推算出它被埋入地下的时间。完成下列填空:
(1)写出Be的核外电子排布式_______ 。用电子式表示BeCl2形成过程_______ 。
(2)写出Al的原子结构示意图_______ 。铝原子核外有_______ 种运动状态不同的电子;铝原子核外有_______ 种能量不同的电子。有一种与26Al中子数相同的硅的核素,写出该核素符号_______ ,该硅电负性_______ (填“大于”或“小于”)Al 。
(3)Be所在的周期中,最外层有2个未成对电子的元素的符号是_______ 、_______ 。
(4)比较Al3+、S2-和Cl-半径由大到小的顺序_______ ;这3种元素最高价氧化物对应的水化物中酸性最强的酸是_______ (写化学式)。
(5)Cl的非金属性大于S,请写出可以验证该结论的一个化学方程式:_______ 。
(1)写出Be的核外电子排布式
(2)写出Al的原子结构示意图
(3)Be所在的周期中,最外层有2个未成对电子的元素的符号是
(4)比较Al3+、S2-和Cl-半径由大到小的顺序
(5)Cl的非金属性大于S,请写出可以验证该结论的一个化学方程式:
您最近一年使用:0次
【推荐3】四氯化钛( )主要用于制取海绵钛和钛白粉,也可用作催化剂。工业上以钛铁矿、焦炭、氯气为原料,在高温条件下制取
)主要用于制取海绵钛和钛白粉,也可用作催化剂。工业上以钛铁矿、焦炭、氯气为原料,在高温条件下制取 ,反应的化学方程式为
,反应的化学方程式为
 。请回答下列问题:
。请回答下列问题:
(1)基态钛原子的电子排布式为___________ ,其未成对电子数为___________ 。
(2)已知:H、 、
、 的电负性分别为2.1、3.0、1.5,则
的电负性分别为2.1、3.0、1.5,则 中
中 和
和 之间的化学键类型为
之间的化学键类型为___________ , 中
中 的化合价为
的化合价为___________ 。
(3)基态碳原子中,能量最高的电子位于___________ 轨道,该轨道有___________ 个伸展方向,轨道形状为___________ 。
(4)若用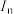 表示元素的第n电离能,碳元素的电离能变化趋势如图所示:
表示元素的第n电离能,碳元素的电离能变化趋势如图所示:

 与
与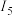 的差值明显大于其他相邻电离能的差值,原因是
的差值明显大于其他相邻电离能的差值,原因是___________ 。
(5)基态铁原子的外围电子轨道表示式为___________ 。 的稳定性强于
的稳定性强于 ,从微观角度解释其原因为
,从微观角度解释其原因为___________ 。
 )主要用于制取海绵钛和钛白粉,也可用作催化剂。工业上以钛铁矿、焦炭、氯气为原料,在高温条件下制取
)主要用于制取海绵钛和钛白粉,也可用作催化剂。工业上以钛铁矿、焦炭、氯气为原料,在高温条件下制取 ,反应的化学方程式为
,反应的化学方程式为
 。请回答下列问题:
。请回答下列问题:(1)基态钛原子的电子排布式为
(2)已知:H、
 、
、 的电负性分别为2.1、3.0、1.5,则
的电负性分别为2.1、3.0、1.5,则 中
中 和
和 之间的化学键类型为
之间的化学键类型为 中
中 的化合价为
的化合价为(3)基态碳原子中,能量最高的电子位于
(4)若用
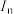 表示元素的第n电离能,碳元素的电离能变化趋势如图所示:
表示元素的第n电离能,碳元素的电离能变化趋势如图所示:
 与
与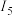 的差值明显大于其他相邻电离能的差值,原因是
的差值明显大于其他相邻电离能的差值,原因是(5)基态铁原子的外围电子轨道表示式为
 的稳定性强于
的稳定性强于 ,从微观角度解释其原因为
,从微观角度解释其原因为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】硝酸工业尾气中含有NO,可以利用强氧化剂过硫酸钠(Na2S2O8)氧化脱除NO,可以消除污染。
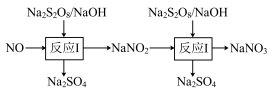
(1)NO3-空间构型为__________ 。
(2)O、N、S三种元素的第一电离能由小到大的顺序为____________ 。
(3)在反应2中,NO2-的初始浓度为0.1 mol·L-1,反应为NO2-+S2O82-+2OH- NO3-+2SO42-+H2O。不同温度下,达到平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如图1所示。
NO3-+2SO42-+H2O。不同温度下,达到平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如图1所示。

图中点a、点b和点c的平衡常数K的大小关系____ 。
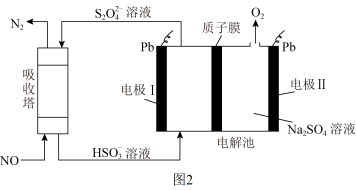
(4)间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图2所示,质子膜允许H+和H2O通过。电极 Ⅰ 的电极反应式为____ ,每处理1 mol NO,可同时得到____ g O2。

(1)NO3-空间构型为
(2)O、N、S三种元素的第一电离能由小到大的顺序为
(3)在反应2中,NO2-的初始浓度为0.1 mol·L-1,反应为NO2-+S2O82-+2OH-
 NO3-+2SO42-+H2O。不同温度下,达到平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如图1所示。
NO3-+2SO42-+H2O。不同温度下,达到平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如图1所示。

图中点a、点b和点c的平衡常数K的大小关系
(4)间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图2所示,质子膜允许H+和H2O通过。电极 Ⅰ 的电极反应式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒等多种元素构成薄膜太阳能电池。回答下列问题:
(1)基态亚铜离子(Cu+)的价层电子排布式为__________ 。
(2)砷、硒是第四周期的相邻元素,已知砷的第一电离能(947kJ·mol-1)大于硒(941k]·mol-l)。请从原子结构的角度加以解释__________ 。
(3)H2O的沸点高于H2Se的沸点,其原因是__________ 。
(4)GaCl3和AsF3的分子立体构型分别是__________ ,__________ 。
(5)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为__________ 。
②[B(OH)4]-的结构式为__________ 。
(6)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是__________ (用化学式表示)
②金刚石的晶胞参数为apm(lpm=10-12m),1cm3晶体的平均质量为__________ g(只要求列算式,阿伏伽德罗常数的值为NA)。
(1)基态亚铜离子(Cu+)的价层电子排布式为
(2)砷、硒是第四周期的相邻元素,已知砷的第一电离能(947kJ·mol-1)大于硒(941k]·mol-l)。请从原子结构的角度加以解释
(3)H2O的沸点高于H2Se的沸点,其原因是
(4)GaCl3和AsF3的分子立体构型分别是
(5)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为
②[B(OH)4]-的结构式为
(6)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是
②金刚石的晶胞参数为apm(lpm=10-12m),1cm3晶体的平均质量为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】蛋白质是构成生物体的基本物质,蛋白质的组成元素主要有氢、碳、氮、氧、硫,同时还有微量元素铁、锌等。回答下列问题:
(1)碳、氮、氧三元素的第一电离能由小到大的顺序为_______ (用元素符号表示)。
(2)NH3的空间结构是_______ 形
(3)将足量的氨水逐滴地加入到CuSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物[Cu(NH3)4]SO4,配位化合物中的阳离子结构式为____ ; 中的硫原子杂化方式为
中的硫原子杂化方式为____ ;
(4)碲化锌晶体有两种结构,其中一种晶胞结构如图:
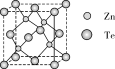
与Te原子距离最近的Te原子有_______ 个;若晶胞边长为apm,则晶体密度为_______ g/cm3(用含NA的式子表示,已知相对质量:Zn-65、Te-128)。
(1)碳、氮、氧三元素的第一电离能由小到大的顺序为
(2)NH3的空间结构是
(3)将足量的氨水逐滴地加入到CuSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物[Cu(NH3)4]SO4,配位化合物中的阳离子结构式为
 中的硫原子杂化方式为
中的硫原子杂化方式为(4)碲化锌晶体有两种结构,其中一种晶胞结构如图:

与Te原子距离最近的Te原子有
您最近一年使用:0次



