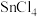1 . 在特定碱性条件下,过量 可将
可将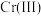 完全氧化成
完全氧化成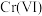 ,其反应为
,其反应为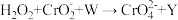 (未配平),下列有关说法错误的是
(未配平),下列有关说法错误的是
 可将
可将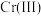 完全氧化成
完全氧化成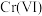 ,其反应为
,其反应为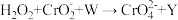 (未配平),下列有关说法错误的是
(未配平),下列有关说法错误的是A.W为 |
B.上述反应中氧化剂和还原剂的物质的量之比为 |
C.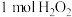 参加反应时,转移电子的物质的量为2mol 参加反应时,转移电子的物质的量为2mol |
D.在酸性条件下 可以转化为 可以转化为 |
您最近一年使用:0次
2022-11-24更新
|
557次组卷
|
5卷引用:天津市第一中学2022-2023学年高三上学期第二次月考化学试题
天津市第一中学2022-2023学年高三上学期第二次月考化学试题(已下线)查补易混易错03 基本概念和基础理论部分-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)考点05 氧化还原反应方程式的配平与计算(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)吉林省通化市辉南县第六中学2024届高三上学期第二次半月考化学试题黑龙江省鸡西市新兴实验学校2023-2024学年高三上学期11月期中考试化学试题
名校
解题方法
2 . 铁器时代是人类发展史中⼀个极为重要的时代,铁及其化合物在人类的生产、生活中都起了巨大的作用。
(1)长期放置的 溶液易被氧化而变质,实验室⽤绿矾
溶液易被氧化而变质,实验室⽤绿矾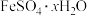 配制
配制 溶液时为了防止
溶液时为了防止 溶液变质,经常向其中加入
溶液变质,经常向其中加入________ ,其原因是______________________ (用离子方程式表示)。
(2)利用部分变质的 溶液制备
溶液制备 :
:
部分变质的 溶液
溶液 溶液I
溶液I 沉淀II
沉淀II

① 溶液作用的离子方程式为
溶液作用的离子方程式为_____________________________________ 。
②写出由“溶液I”到“沉淀II”反应的离子方程式:_______________________________ 。
(3)电子工业中,常用 溶液腐蚀铜,其反应的离子方程式为
溶液腐蚀铜,其反应的离子方程式为________________________ 。
(1)长期放置的
 溶液易被氧化而变质,实验室⽤绿矾
溶液易被氧化而变质,实验室⽤绿矾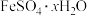 配制
配制 溶液时为了防止
溶液时为了防止 溶液变质,经常向其中加入
溶液变质,经常向其中加入(2)利用部分变质的
 溶液制备
溶液制备 :
:部分变质的
 溶液
溶液 溶液I
溶液I 沉淀II
沉淀II

①
 溶液作用的离子方程式为
溶液作用的离子方程式为②写出由“溶液I”到“沉淀II”反应的离子方程式:
(3)电子工业中,常用
 溶液腐蚀铜,其反应的离子方程式为
溶液腐蚀铜,其反应的离子方程式为
您最近一年使用:0次
解题方法
3 . 高铁酸盐是优良的多功能水处理剂。 为紫色固体,可溶于水,微溶于浓
为紫色固体,可溶于水,微溶于浓 溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出
溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出 。某实验小组制备高铁酸钾
。某实验小组制备高铁酸钾 并测定产品纯度。回答下列问题:
并测定产品纯度。回答下列问题:
I.制备
装置如图所示,夹持、加热等装置略。
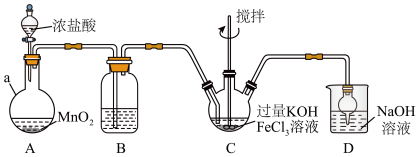
(1)仪器a的名称是__________ ,装置B中除杂质所用试剂是__________ 。
(2)A中发生反应的离子方程式为__________ 。
(3)C中反应为放热反应,而反应温度须控制在0~50℃,采用的控温方法为__________ ,反应中 必须过量的原因是
必须过量的原因是__________ 。
(4)C中由 制备
制备 ,若生成
,若生成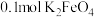 ,则该反应过程中转移的电子数目
,则该反应过程中转移的电子数目______ 。
II.产品纯度的测定
准确称取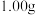 制得的晶体,配成
制得的晶体,配成 溶液,准确量取
溶液,准确量取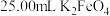 溶液放入锥形瓶,加入足量
溶液放入锥形瓶,加入足量 和
和 溶液,振荡,再加入稀硫酸酸化后得
溶液,振荡,再加入稀硫酸酸化后得 和
和 ,滴入几滴二苯胺磺酸钠作指示剂,用
,滴入几滴二苯胺磺酸钠作指示剂,用 标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗
标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗 标准溶液
标准溶液 。
。
(5)根据以上数据,样品中 的质量分数为
的质量分数为__________ 。
 为紫色固体,可溶于水,微溶于浓
为紫色固体,可溶于水,微溶于浓 溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出
溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出 。某实验小组制备高铁酸钾
。某实验小组制备高铁酸钾 并测定产品纯度。回答下列问题:
并测定产品纯度。回答下列问题:I.制备

装置如图所示,夹持、加热等装置略。

(1)仪器a的名称是
(2)A中发生反应的离子方程式为
(3)C中反应为放热反应,而反应温度须控制在0~50℃,采用的控温方法为
 必须过量的原因是
必须过量的原因是(4)C中由
 制备
制备 ,若生成
,若生成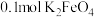 ,则该反应过程中转移的电子数目
,则该反应过程中转移的电子数目II.产品纯度的测定
准确称取
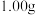 制得的晶体,配成
制得的晶体,配成 溶液,准确量取
溶液,准确量取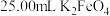 溶液放入锥形瓶,加入足量
溶液放入锥形瓶,加入足量 和
和 溶液,振荡,再加入稀硫酸酸化后得
溶液,振荡,再加入稀硫酸酸化后得 和
和 ,滴入几滴二苯胺磺酸钠作指示剂,用
,滴入几滴二苯胺磺酸钠作指示剂,用 标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗
标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗 标准溶液
标准溶液 。
。(5)根据以上数据,样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
4 . A、B、D、E、X是原子序数依次增大的五种短周期元素。A是周期表中相对原子质量最小的元素,A、B能形成两种液态化合物 和
和 。D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。回答下列问题:(用化学用语填空)
。D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。回答下列问题:(用化学用语填空)
(1) 的电子式为
的电子式为__________ ;离子半径D__________ B(填“>”或“<”)。
(2)如图所示,将少量X单质的水溶液分别滴入盛有不同试剂的试管中。

管a中发生反应的化学方程式为__________ ,该反应可用于制备漂白液。
②试管b中的实验现象为__________ ,说明X的非金属性强于碘元素,从原子结构的角度解释其原因是__________ 。
(3)镓 与E为同主族元素,氮化镓
与E为同主族元素,氮化镓 作为第三代半导体材料,具有耐高温、耐高电压等特性。下列相关说法中,正确的是
作为第三代半导体材料,具有耐高温、耐高电压等特性。下列相关说法中,正确的是__________ (填字母序号)。
a. 位于元素周期表的第四周期
位于元素周期表的第四周期
b. 中
中 的化合价为
的化合价为
c. 的离子半径小于
的离子半径小于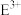 的离子半径
的离子半径
(4)工业上用 处理中性废水中的
处理中性废水中的 ,使其转化为
,使其转化为 沉淀除去,X被还原至最低价,该反应的离子方程式为
沉淀除去,X被还原至最低价,该反应的离子方程式为__________ 。
 和
和 。D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。回答下列问题:(用化学用语填空)
。D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。回答下列问题:(用化学用语填空) (1)
 的电子式为
的电子式为(2)如图所示,将少量X单质的水溶液分别滴入盛有不同试剂的试管中。

管a中发生反应的化学方程式为
②试管b中的实验现象为
(3)镓
 与E为同主族元素,氮化镓
与E为同主族元素,氮化镓 作为第三代半导体材料,具有耐高温、耐高电压等特性。下列相关说法中,正确的是
作为第三代半导体材料,具有耐高温、耐高电压等特性。下列相关说法中,正确的是a.
 位于元素周期表的第四周期
位于元素周期表的第四周期b.
 中
中 的化合价为
的化合价为
c.
 的离子半径小于
的离子半径小于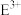 的离子半径
的离子半径(4)工业上用
 处理中性废水中的
处理中性废水中的 ,使其转化为
,使其转化为 沉淀除去,X被还原至最低价,该反应的离子方程式为
沉淀除去,X被还原至最低价,该反应的离子方程式为
您最近一年使用:0次
名校
解题方法
5 . 无水四氯化锡( )用于制作FTO导电玻璃,FTO玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等;军事上四氯化锡蒸气与
)用于制作FTO导电玻璃,FTO玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等;军事上四氯化锡蒸气与 及水汽混合呈浓烟状,可制作烟幕弹。实验室可用熔融的金属锡与干燥氯气利用图装置制备四氯化锡。有关信息如下表:
及水汽混合呈浓烟状,可制作烟幕弹。实验室可用熔融的金属锡与干燥氯气利用图装置制备四氯化锡。有关信息如下表:
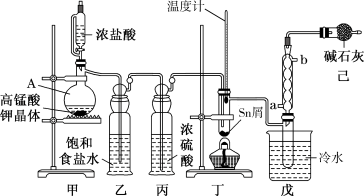
(1)实验室用二氧化锰制氯气的离子方程式为_______________________ 。
(2)装置己的作用有___________________ 。
(3) 和Sn的反应产物可能会有
和Sn的反应产物可能会有 和
和 为防止产品中带入
为防止产品中带入 ,除了通入过量氯气外,应控制温度在
,除了通入过量氯气外,应控制温度在_________ 范围内。(填标号)
a.114~232℃ b.232~652℃ c.652~2260℃
(4)为了确认丁中 的生成,可选用以下
的生成,可选用以下_____ 检验。(填标号)
a.稀盐酸
b.滴有KSCN(KSCN遇 变红)溶液的
变红)溶液的 溶液
溶液
c.酸性高锰酸钾溶液
(5)氯气在实际生活中的用途很多,可用于饮用水消毒。但对饮用水消毒副作用够,产生影响人体健康的有机氯衍生物。可用氯气制取高铁酸钠净水,补全缺项,并配平离子方程式______ 。
______ ______(______)+______
______(______)+______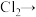 ______
______ ______(______)+
______(______)+
(6)工业上常将氯气转化为漂白粉,工业上利用氯气和石灰乳生产漂白粉的主要化学方程式是_________________ ,在空气中漂白粉长期存放会变质而失效的原理是(用化学方程式说明)____________ _____ 。
 )用于制作FTO导电玻璃,FTO玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等;军事上四氯化锡蒸气与
)用于制作FTO导电玻璃,FTO玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等;军事上四氯化锡蒸气与 及水汽混合呈浓烟状,可制作烟幕弹。实验室可用熔融的金属锡与干燥氯气利用图装置制备四氯化锡。有关信息如下表:
及水汽混合呈浓烟状,可制作烟幕弹。实验室可用熔融的金属锡与干燥氯气利用图装置制备四氯化锡。有关信息如下表:
化学式 | Sn |
|
|
熔点/℃ | 232 | 246 | -33 |
沸点/℃ | 2260 | 652 | 114 |
其他性质 | 银白色固体金属 | 无色晶体,Sn(Ⅱ)易被氧化 | 无色液体,遇水反应 |
(2)装置己的作用有
(3)
 和Sn的反应产物可能会有
和Sn的反应产物可能会有 和
和 为防止产品中带入
为防止产品中带入 ,除了通入过量氯气外,应控制温度在
,除了通入过量氯气外,应控制温度在a.114~232℃ b.232~652℃ c.652~2260℃
(4)为了确认丁中
 的生成,可选用以下
的生成,可选用以下a.稀盐酸
b.滴有KSCN(KSCN遇
 变红)溶液的
变红)溶液的 溶液
溶液c.酸性高锰酸钾溶液
(5)氯气在实际生活中的用途很多,可用于饮用水消毒。但对饮用水消毒副作用够,产生影响人体健康的有机氯衍生物。可用氯气制取高铁酸钠净水,补全缺项,并配平离子方程式
______
 ______(______)+______
______(______)+______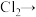 ______
______ ______(______)+
______(______)+
(6)工业上常将氯气转化为漂白粉,工业上利用氯气和石灰乳生产漂白粉的主要化学方程式是
您最近一年使用:0次
2022-11-18更新
|
274次组卷
|
2卷引用:天津市第一中学2022-2023学年高一上学期期中质量调查化学试题
6 . 硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5•H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3,白色片状晶体,溶于水和酒精等,对人体的受伤组织有防腐消毒作用)的工艺流程如图所示:
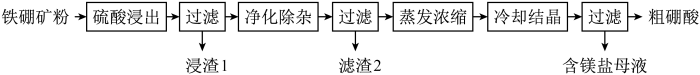
(1)硼在元素周期表中的位置为____ ;硼元素有两种天然同位素10B和11B,硼元素的近似相对原子质量为10.8,则两种同位素原子的原子个数之比为____ 。
(2)写出Mg2B2O5•H2O与硫酸反应的化学方程式:____ 。
(3)利用Fe3O4的磁性,可将其从“浸渣1”中分离,“浸渣1”中还剩余的物质是____ (化学式)。
(4)“净化除杂”需先加H2O2溶液,作用是:____ ;然后再调节溶液的pH约为5,目的是____ 。
(5)以硼酸为原料可制得硼氢化钠(NaBH4),其电子式为____ 。
(6)H3BO3溶液中存在H3BO3(aq)+H2O(l) [B(OH)4]-(aq)+H+(aq)平衡。下列关于硼酸的说法正确的是
[B(OH)4]-(aq)+H+(aq)平衡。下列关于硼酸的说法正确的是____ 。
a.H3BO3是一元酸
b.其水溶液中,水的电离平衡受到抑制
c.硼酸和过量NaOH溶液反应的方程式为H3BO3+NaOH=Na[B(OH)4]

(1)硼在元素周期表中的位置为
(2)写出Mg2B2O5•H2O与硫酸反应的化学方程式:
(3)利用Fe3O4的磁性,可将其从“浸渣1”中分离,“浸渣1”中还剩余的物质是
(4)“净化除杂”需先加H2O2溶液,作用是:
(5)以硼酸为原料可制得硼氢化钠(NaBH4),其电子式为
(6)H3BO3溶液中存在H3BO3(aq)+H2O(l)
 [B(OH)4]-(aq)+H+(aq)平衡。下列关于硼酸的说法正确的是
[B(OH)4]-(aq)+H+(aq)平衡。下列关于硼酸的说法正确的是a.H3BO3是一元酸
b.其水溶液中,水的电离平衡受到抑制
c.硼酸和过量NaOH溶液反应的方程式为H3BO3+NaOH=Na[B(OH)4]
您最近一年使用:0次
2022-11-16更新
|
145次组卷
|
2卷引用:天津市部分区2022-2023学年高三上学期期中考试化学试题
解题方法
7 . 按要求完成下列问题。
(1)硒(Se)是人体必需的微量元素,与O为同一主族元素,Se原子比O原子多两个电子层,则Se的原子序数为____ ,其最高价氧化物对应的水化物化学式为____ 。
(2)X射线衍射法可以测定某些分子结构,NH3分子结构为_____ 。
(3)水在液态时,几个水分子可以形成缔合水分子(H2O)n的原因是水分子之间存在____ 。
(4)漂白粉(有效成分Ca(ClO)2)与空气中CO2和水蒸气反应的化学方程式:____ 。
(5)完成氧化还原反应的离子方程式:____ 。
Cr2O +Fe2++_____=Cr3++Fe3++____
+Fe2++_____=Cr3++Fe3++____
(6)一定条件下金属钠和H2反应生成甲,甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4。化合物甲和NaAlH4都是重要的还原剂。将4.80g甲加热至完全分解,得到金属钠和2.24L(已折算成标准状况)的H2。
①甲的化学式____ 。
②甲与AlCl3反应得到NaAlH4的化学方程式:____ 。
③NaAlH4与水发生氧化还原反应的化学方程式:____ 。
④甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式:____ 。
(1)硒(Se)是人体必需的微量元素,与O为同一主族元素,Se原子比O原子多两个电子层,则Se的原子序数为
(2)X射线衍射法可以测定某些分子结构,NH3分子结构为
(3)水在液态时,几个水分子可以形成缔合水分子(H2O)n的原因是水分子之间存在
(4)漂白粉(有效成分Ca(ClO)2)与空气中CO2和水蒸气反应的化学方程式:
(5)完成氧化还原反应的离子方程式:
Cr2O
 +Fe2++_____=Cr3++Fe3++____
+Fe2++_____=Cr3++Fe3++____(6)一定条件下金属钠和H2反应生成甲,甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4。化合物甲和NaAlH4都是重要的还原剂。将4.80g甲加热至完全分解,得到金属钠和2.24L(已折算成标准状况)的H2。
①甲的化学式
②甲与AlCl3反应得到NaAlH4的化学方程式:
③NaAlH4与水发生氧化还原反应的化学方程式:
④甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式:
您最近一年使用:0次
2022-11-16更新
|
160次组卷
|
2卷引用:天津市部分区2022-2023学年高三上学期期中考试化学试题
名校
8 . 按要求回答下列问题:
Ⅰ.现有以下物质:①氮气 ②液 ③氯化氢气体 ④铜片 ⑤硫酸钡晶体 ⑥蔗糖 ⑦酒精 ⑧熔化的
③氯化氢气体 ④铜片 ⑤硫酸钡晶体 ⑥蔗糖 ⑦酒精 ⑧熔化的 ⑨
⑨ 溶液,请回答下列问题:
溶液,请回答下列问题:
(1)以上物质中能导电的是_______ (填序号,下同)
(2)以上物质中属于电解质的是_______ 。
(3)写出上述物质中⑨的电离方程式:_______ 。
Ⅱ.有下列6种物质: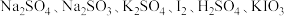 组成一个氧化还原反应。
组成一个氧化还原反应。
(4)将除 的5种物质分别填入下面对应的横线上,组成化学方程式并配平:
的5种物质分别填入下面对应的横线上,组成化学方程式并配平:_______ 。
 。
。
(5)在该反应中,还原剂是_______ (填化学式,下同),还原产物是_______ 。
Ⅲ.是“84”消毒液的有效成分,请回答下列问题:
(6) 中
中 元素的化合价是
元素的化合价是_______ 价,曾有报道,在清洗卫生间时,因混合使用“洁厕灵”(主要成分是稀盐酸)与“84”消毒液而发生氯气中毒事件。用离子方程式表示原因:_______ 。
Ⅰ.现有以下物质:①氮气 ②液
 ③氯化氢气体 ④铜片 ⑤硫酸钡晶体 ⑥蔗糖 ⑦酒精 ⑧熔化的
③氯化氢气体 ④铜片 ⑤硫酸钡晶体 ⑥蔗糖 ⑦酒精 ⑧熔化的 ⑨
⑨ 溶液,请回答下列问题:
溶液,请回答下列问题:(1)以上物质中能导电的是
(2)以上物质中属于电解质的是
(3)写出上述物质中⑨的电离方程式:
Ⅱ.有下列6种物质:
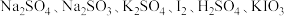 组成一个氧化还原反应。
组成一个氧化还原反应。(4)将除
 的5种物质分别填入下面对应的横线上,组成化学方程式并配平:
的5种物质分别填入下面对应的横线上,组成化学方程式并配平: 。
。(5)在该反应中,还原剂是
Ⅲ.是“84”消毒液的有效成分,请回答下列问题:
(6)
 中
中 元素的化合价是
元素的化合价是
您最近一年使用:0次
9 . I.食醋是烹饪美食的调味品,有效成分主要为醋酸。
(1)配制250mL0.1mol/L的醋酸溶液,需5mol/L醋酸溶液的体积为_______ mL(保留到小数点后一位)
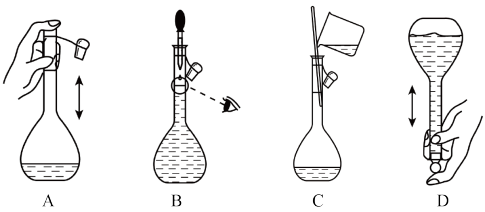
(2)下列关于某容积的容量瓶的操作,正确的是_______ 。
II.人工固氮合成氨,并通过氨氧化法制取硝酸的流程如图所示。
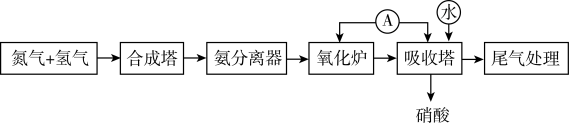
(3)“合成塔”内发生的化学反应中作氧化剂的是_______ (填化学式),金属镁在该氧化剂中燃烧的化学方程式为_______ ,其产物遇水生成的有刺激性气味气体的电子式为_______ ,分子构型为_______ ;“氧化炉”中氨气发生反应的化学方程式为_______ 。
(4)常温下,工业上选择铁或铝作盛装浓硝酸的罐体材料的主要原因是_______
(5)为了避免生成硝酸的过程中氮的氧化物污染环境,可用氨气处理尾气,将其转化为大气中含有的无害气体,以处理 为例,该反应中氧化剂与还原剂的物质的量之比为
为例,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(1)配制250mL0.1mol/L的醋酸溶液,需5mol/L醋酸溶液的体积为
(2)下列关于某容积的容量瓶的操作,正确的是

II.人工固氮合成氨,并通过氨氧化法制取硝酸的流程如图所示。

(3)“合成塔”内发生的化学反应中作氧化剂的是
(4)常温下,工业上选择铁或铝作盛装浓硝酸的罐体材料的主要原因是
(5)为了避免生成硝酸的过程中氮的氧化物污染环境,可用氨气处理尾气,将其转化为大气中含有的无害气体,以处理
 为例,该反应中氧化剂与还原剂的物质的量之比为
为例,该反应中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
10 . 填空。
(1)二氧化氯是国际公认的高效安全杀菌消毒剂,工业制备 的反应原理如下:
的反应原理如下: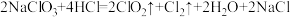
①该反应中,氧化剂是_______ ,氧化剂和还原剂的物质的量之比为_______ ,依据氧化还原反应规律判断,氧化性强弱为
_______  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
② 在杀菌消毒过程中会产生副产物亚氯酸盐(
在杀菌消毒过程中会产生副产物亚氯酸盐( ),需将其转化为
),需将其转化为 除去,下列试剂中,可将
除去,下列试剂中,可将 转化为
转化为 的是
的是_______ (填字母序号)。
a. b.
b. c.
c. d.
d.
(2) 是一种重要的化学品,其合成方法不断发展。早期制备方法如下:
是一种重要的化学品,其合成方法不断发展。早期制备方法如下:
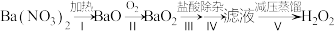
①I为分解反应,产物除BaO、 外,还有一种红棕色气体。该反应的化学方程式是
外,还有一种红棕色气体。该反应的化学方程式是_______ 。
②II为可逆反应,促进该反应正向进行的措施是_______ (写出一种即可)。
③III中生成 ,反应的化学方程式是
,反应的化学方程式是_______ 。
④减压能够降低蒸馏温度,从 的化学性质角度说明V中采用减压蒸馏的原因:
的化学性质角度说明V中采用减压蒸馏的原因:_______ 。
(1)二氧化氯是国际公认的高效安全杀菌消毒剂,工业制备
 的反应原理如下:
的反应原理如下: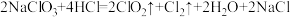
①该反应中,氧化剂是

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)②
 在杀菌消毒过程中会产生副产物亚氯酸盐(
在杀菌消毒过程中会产生副产物亚氯酸盐( ),需将其转化为
),需将其转化为 除去,下列试剂中,可将
除去,下列试剂中,可将 转化为
转化为 的是
的是a.
 b.
b. c.
c. d.
d.
(2)
 是一种重要的化学品,其合成方法不断发展。早期制备方法如下:
是一种重要的化学品,其合成方法不断发展。早期制备方法如下: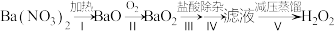
①I为分解反应,产物除BaO、
 外,还有一种红棕色气体。该反应的化学方程式是
外,还有一种红棕色气体。该反应的化学方程式是②II为可逆反应,促进该反应正向进行的措施是
③III中生成
 ,反应的化学方程式是
,反应的化学方程式是④减压能够降低蒸馏温度,从
 的化学性质角度说明V中采用减压蒸馏的原因:
的化学性质角度说明V中采用减压蒸馏的原因:
您最近一年使用:0次
2022-11-14更新
|
128次组卷
|
2卷引用:天津市河东区2022-2023学年高三上学期期中检测化学试题