解题方法
1 . 海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。回答下列问题:
(1)请写出海水淡化的一种方法:___________ 。
(2)从海水中提取的粗盐中含有 、
、 、
、 等杂质离子,精制时常用的试剂有:a稀盐酸;b氯化钡溶液;c氢氧化钠溶液;d碳酸钠溶液。加入试剂的正确顺序是
等杂质离子,精制时常用的试剂有:a稀盐酸;b氯化钡溶液;c氢氧化钠溶液;d碳酸钠溶液。加入试剂的正确顺序是___________ (填字母)。
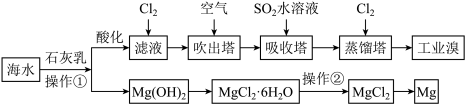
利用海水可以提取溴和镁,提取过程如下,___________ 。
(4)操作②为___________ 。
(5)提取溴的过程中,经过2次 转化的目的是
转化的目的是___________ 。
(6)吸收塔中发生反应的离子方程式为___________ ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_________________________________ 。
(7)工业上常用上述流程“空气吹出法”实现海水提溴,将1m3海水浓缩至1L,使用该法最终得到36gBr2,若提取率为60%,则原海水中溴的浓度为___________ mg/L。
(1)请写出海水淡化的一种方法:
(2)从海水中提取的粗盐中含有
 、
、 、
、 等杂质离子,精制时常用的试剂有:a稀盐酸;b氯化钡溶液;c氢氧化钠溶液;d碳酸钠溶液。加入试剂的正确顺序是
等杂质离子,精制时常用的试剂有:a稀盐酸;b氯化钡溶液;c氢氧化钠溶液;d碳酸钠溶液。加入试剂的正确顺序是利用海水可以提取溴和镁,提取过程如下,
(4)操作②为
(5)提取溴的过程中,经过2次
 转化的目的是
转化的目的是(6)吸收塔中发生反应的离子方程式为
(7)工业上常用上述流程“空气吹出法”实现海水提溴,将1m3海水浓缩至1L,使用该法最终得到36gBr2,若提取率为60%,则原海水中溴的浓度为
您最近一年使用:0次
2023-02-20更新
|
292次组卷
|
2卷引用:天津市南开区2022~2023 学年高三上学期阶段性质量监测 (二) 化学试题
2023高三·全国·专题练习
解题方法
2 . 金属钒(V)及其化合物有着广泛的用途。请回答下列问题:
(1)钒在溶液中的主要聚合状态与溶液的pH关系如图所示。V2O 中V元素的化合价是
中V元素的化合价是_______ ,溶液中VO 转化为V2O
转化为V2O 的离子方程式为
的离子方程式为_______ 。

(2)偏钒酸铵是最普通的钒酸盐,将V2O5溶于碳酸钠溶液中(有气体生成),然后加入氯化铵,便可析出偏钒酸铵(NH4VO3),该过程总反应的化学方程式为_______ ;当pH超过8.0时偏钒酸铵会发生转化,其原因是溶液中的VO 转化为V2O
转化为V2O 、
、_______ (请另写出一点原因)。
(3)NH4VO3在高温下分解产生的V2O5可作为硫酸工业中2SO2(g)+O2(g)⇌2SO3(g) ΔH=pkJ/mol反应的催化剂,其催化原理如图所示。

①过程a和过程b的热化学方程式为
V2O5(s)+SO2(g)=V2O4(s)+SO3(g) ΔH=qkJ/mol
V2O4(s)+O2(g)+2SO2(g)=2VOSO4(s) ΔH=rkJ/mol
则过程c的热化学方程式为_______ 。
②T℃时反应2SO3(g)⇌2SO2(g)+O2(g) ΔH>0中SO3的转化率(α)与体系总压强(p)的关系如图所示。T℃时,将2molSO3置于10L密闭容器中,反应达到平衡后,体系总压强为0.10MPa,则T℃时B点的化学平衡常数Kc=_______ 。

(1)钒在溶液中的主要聚合状态与溶液的pH关系如图所示。V2O
 中V元素的化合价是
中V元素的化合价是 转化为V2O
转化为V2O 的离子方程式为
的离子方程式为
(2)偏钒酸铵是最普通的钒酸盐,将V2O5溶于碳酸钠溶液中(有气体生成),然后加入氯化铵,便可析出偏钒酸铵(NH4VO3),该过程总反应的化学方程式为
 转化为V2O
转化为V2O 、
、(3)NH4VO3在高温下分解产生的V2O5可作为硫酸工业中2SO2(g)+O2(g)⇌2SO3(g) ΔH=pkJ/mol反应的催化剂,其催化原理如图所示。

①过程a和过程b的热化学方程式为
V2O5(s)+SO2(g)=V2O4(s)+SO3(g) ΔH=qkJ/mol
V2O4(s)+O2(g)+2SO2(g)=2VOSO4(s) ΔH=rkJ/mol
则过程c的热化学方程式为
②T℃时反应2SO3(g)⇌2SO2(g)+O2(g) ΔH>0中SO3的转化率(α)与体系总压强(p)的关系如图所示。T℃时,将2molSO3置于10L密闭容器中,反应达到平衡后,体系总压强为0.10MPa,则T℃时B点的化学平衡常数Kc=

您最近一年使用:0次
解题方法
3 . 硝酸铈铵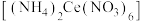 、二氧化铈(
、二氧化铈( )均是常见的强氧化剂,可以以
)均是常见的强氧化剂,可以以 为原料进行制取。
为原料进行制取。

(1)“沉淀1”时,溶液中 转化为
转化为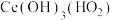 沉淀。写出沉淀1反应的化学方程式:
沉淀。写出沉淀1反应的化学方程式:_______ 。
(2)“酸溶2”时,控制反应温度为80℃,硝酸与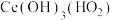 分解产生的
分解产生的 反应生成
反应生成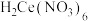 ,反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,同时将
,反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,同时将 分批加入硝酸中,原因是
分批加入硝酸中,原因是_______ 。
(3)“沉淀2”时,控制其他条件一定,改变加入 固体的量,测得
固体的量,测得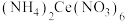 沉淀的收率如图所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入
沉淀的收率如图所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入 的目的是
的目的是_______ 。
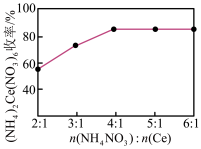
(4)实验小组以 为原料制取
为原料制取 ,请补充完整实验方案:将
,请补充完整实验方案:将 完全溶解于盐酸中,
完全溶解于盐酸中,_______ ,得 固体。[已知:
固体。[已知: (白色沉淀)
(白色沉淀)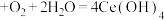 (黄色沉淀),
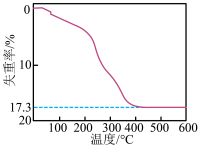
(黄色沉淀), 受热分解时失重百分比与温度的关系如图所示。可选用的仪器和试剂:
受热分解时失重百分比与温度的关系如图所示。可选用的仪器和试剂: 氨水、
氨水、 、
、 、
、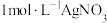 溶液、马弗炉(可用于固体的高温加热)]
溶液、马弗炉(可用于固体的高温加热)]
(5)实验制得的硝酸铈铵(摩尔质量为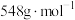 )含量可用如下方法测定:准确称取16.0g硝酸铈铵样品,加水充分溶解,并转移至100mL容量瓶中定容、摇匀,得硝酸铈铵溶液试样。准确量取5mL的硝酸铈铵溶液试样,移入250mL锥形瓶中,加入适量硫酸和磷酸,并加入2滴0.25%邻二氮杂菲指示剂,用
)含量可用如下方法测定:准确称取16.0g硝酸铈铵样品,加水充分溶解,并转移至100mL容量瓶中定容、摇匀,得硝酸铈铵溶液试样。准确量取5mL的硝酸铈铵溶液试样,移入250mL锥形瓶中,加入适量硫酸和磷酸,并加入2滴0.25%邻二氮杂菲指示剂,用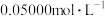 硫酸亚铁铵
硫酸亚铁铵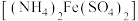 标准溶液滴定至终点(滴定过程中
标准溶液滴定至终点(滴定过程中 被还原为
被还原为 ),消耗标准溶液24.00mL。计算该样品中硝酸铈铵的质量分数
),消耗标准溶液24.00mL。计算该样品中硝酸铈铵的质量分数______ 。
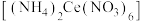 、二氧化铈(
、二氧化铈( )均是常见的强氧化剂,可以以
)均是常见的强氧化剂,可以以 为原料进行制取。
为原料进行制取。
(1)“沉淀1”时,溶液中
 转化为
转化为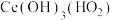 沉淀。写出沉淀1反应的化学方程式:
沉淀。写出沉淀1反应的化学方程式:(2)“酸溶2”时,控制反应温度为80℃,硝酸与
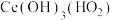 分解产生的
分解产生的 反应生成
反应生成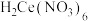 ,反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,同时将
,反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,同时将 分批加入硝酸中,原因是
分批加入硝酸中,原因是(3)“沉淀2”时,控制其他条件一定,改变加入
 固体的量,测得
固体的量,测得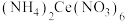 沉淀的收率如图所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入
沉淀的收率如图所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入 的目的是
的目的是
(4)实验小组以
 为原料制取
为原料制取 ,请补充完整实验方案:将
,请补充完整实验方案:将 完全溶解于盐酸中,
完全溶解于盐酸中, 固体。[已知:
固体。[已知: (白色沉淀)
(白色沉淀)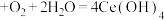 (黄色沉淀),
(黄色沉淀), 受热分解时失重百分比与温度的关系如图所示。可选用的仪器和试剂:
受热分解时失重百分比与温度的关系如图所示。可选用的仪器和试剂: 氨水、
氨水、 、
、 、
、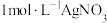 溶液、马弗炉(可用于固体的高温加热)]
溶液、马弗炉(可用于固体的高温加热)]
(5)实验制得的硝酸铈铵(摩尔质量为
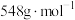 )含量可用如下方法测定:准确称取16.0g硝酸铈铵样品,加水充分溶解,并转移至100mL容量瓶中定容、摇匀,得硝酸铈铵溶液试样。准确量取5mL的硝酸铈铵溶液试样,移入250mL锥形瓶中,加入适量硫酸和磷酸,并加入2滴0.25%邻二氮杂菲指示剂,用
)含量可用如下方法测定:准确称取16.0g硝酸铈铵样品,加水充分溶解,并转移至100mL容量瓶中定容、摇匀,得硝酸铈铵溶液试样。准确量取5mL的硝酸铈铵溶液试样,移入250mL锥形瓶中,加入适量硫酸和磷酸,并加入2滴0.25%邻二氮杂菲指示剂,用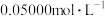 硫酸亚铁铵
硫酸亚铁铵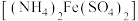 标准溶液滴定至终点(滴定过程中
标准溶液滴定至终点(滴定过程中 被还原为
被还原为 ),消耗标准溶液24.00mL。计算该样品中硝酸铈铵的质量分数
),消耗标准溶液24.00mL。计算该样品中硝酸铈铵的质量分数
您最近一年使用:0次
名校
解题方法
4 . 下列离子方程式正确的是
A.向酸性KMnO4溶液中滴加双氧水:2MnO H2O26H=2Mn23O24H2O H2O26H=2Mn23O24H2O |
B.NaHCO3溶液与少量的BaOH2溶液混合:HCO Ba2OH=BaCO3H2O Ba2OH=BaCO3H2O |
| C.向含有FeBr2和FeCl2混合溶液中通入少量氯气:Cl2+2Fe2+=2Fe3++2Cl- |
D.用醋酸和淀粉-KI溶液检验加碘盐中的IO :IO :IO 5I6H=3I23H2O 5I6H=3I23H2O |
您最近一年使用:0次
2023-01-13更新
|
268次组卷
|
2卷引用:天津市新华中学2022-2023学年高三上学期期末考试化学试题
5 . 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中Na2O2是_______ (填氧化剂、还原剂)
(2)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O。
、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:_______ 。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为_______ mol
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中Na2O2是
(2)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO
 、Cl-、H2O。
、Cl-、H2O。①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为
您最近一年使用:0次
名校
解题方法
6 . 铁是人类较早使用的金属之一,运用铁及其化合物的知识,完成下列问题。
印刷电路板(PCB)是用腐蚀液(FeCl3溶液)将覆铜板上的部分铜腐蚀掉而制得。一种制作PCB并将腐蚀后废液(其中金属阳离子主要含Fe3+、Cu2+、Fe2+)回收再生的流程如图。

请回答:
(1)腐蚀池中发生反应的化学方程式是_______ 。
(2)上述各池中,没有发生化学变化的是_______ 池。
(3)由置换池中得到固体的操作名称是_______ 。
(4)向再生池中通入Cl2也可以使废液再生,相比Cl2,用双氧水的优点是_______ 。
(5)若取少量循环使用的氯化铁溶液于烧杯中,同时加入铁粉和铜粉。反应结束后,下列结果不可能出现的是_______。(填写编号)
印刷电路板(PCB)是用腐蚀液(FeCl3溶液)将覆铜板上的部分铜腐蚀掉而制得。一种制作PCB并将腐蚀后废液(其中金属阳离子主要含Fe3+、Cu2+、Fe2+)回收再生的流程如图。

请回答:
(1)腐蚀池中发生反应的化学方程式是
(2)上述各池中,没有发生化学变化的是
(3)由置换池中得到固体的操作名称是
(4)向再生池中通入Cl2也可以使废液再生,相比Cl2,用双氧水的优点是
(5)若取少量循环使用的氯化铁溶液于烧杯中,同时加入铁粉和铜粉。反应结束后,下列结果不可能出现的是_______。(填写编号)
| A.有铜无铁 | B.有铁无铜 | C.铁、铜都有 | D.铁、铜都无 |
您最近一年使用:0次
2023-01-13更新
|
227次组卷
|
4卷引用:天津市第四中学2022-2023学年高一上学期期末考试化学试题
天津市第四中学2022-2023学年高一上学期期末考试化学试题(已下线)专题07 铁及其化合物 金属材料-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(天津专用)(已下线)专项02 氧化还原反应的概念、规律及综合应用-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(天津专用)(已下线)专项06 无机推断、化工流程和化学计算-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(天津专用)
名校
解题方法
7 . 从某含有 、
、 、
、 的工业废液中回收铜并制备氯化铁晶体的流程如下,则下列说法不正确的是
的工业废液中回收铜并制备氯化铁晶体的流程如下,则下列说法不正确的是
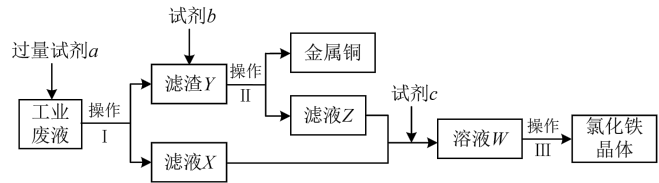
 、
、 、
、 的工业废液中回收铜并制备氯化铁晶体的流程如下,则下列说法不正确的是
的工业废液中回收铜并制备氯化铁晶体的流程如下,则下列说法不正确的是
| A.试剂a为铁,试剂b为稀硫酸 |
B.加入试剂a过程中,有红色固体析出后,说明溶液中 已经反应完全 已经反应完全 |
C.试剂c可为 溶液,相应的反应为 溶液,相应的反应为 |
| D.溶液W可作“腐蚀液”腐蚀覆铜板 |
您最近一年使用:0次
2023-01-07更新
|
1467次组卷
|
5卷引用:天津市南开中学2022-2023学年高一上学期期末考试化学试题
天津市南开中学2022-2023学年高一上学期期末考试化学试题(已下线)专项02 氧化还原反应的概念、规律及综合应用-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(天津专用)(已下线)【2023】【高一下】【期中考】【328】【高中化学】安徽省安庆市第七中学2023-2024学年高一下学期开学考试化学试题浙江省余姚中学2023-2024学年高一下学期3月质量检测化学(选考)试题
名校
8 . 室温下,通过下列实验探究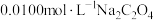 溶液的性质。
溶液的性质。
实验1:实验测得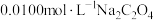 溶液
溶液 为8.6。
为8.6。
实验2:向溶液中滴加等体积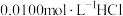 溶液,
溶液, 由8.6降为4.8。
由8.6降为4.8。
实验3:向溶液中加入等体积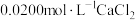 溶液,出现白色沉淀。
溶液,出现白色沉淀。
实验4:向稀硫酸酸化的 溶液中滴加
溶液中滴加 溶液至溶液褪色。
溶液至溶液褪色。
已知室温时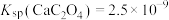 ,下列说法正确的是
,下列说法正确的是
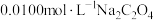 溶液的性质。
溶液的性质。实验1:实验测得
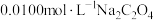 溶液
溶液 为8.6。
为8.6。实验2:向溶液中滴加等体积
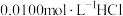 溶液,
溶液, 由8.6降为4.8。
由8.6降为4.8。实验3:向溶液中加入等体积
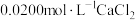 溶液,出现白色沉淀。
溶液,出现白色沉淀。实验4:向稀硫酸酸化的
 溶液中滴加
溶液中滴加 溶液至溶液褪色。
溶液至溶液褪色。已知室温时
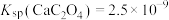 ,下列说法正确的是
,下列说法正确的是A.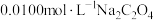 溶液中满足: 溶液中满足: |
B.实验2滴加盐酸后离子浓度关系满足: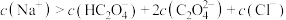 |
C.实验3所得上层清液中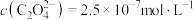 |
D.实验4发生反应的离子方程式为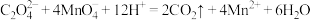 |
您最近一年使用:0次
名校
9 . Ⅰ、现有下列十种物质:①液态氯化氢;②小苏打;③固体纯碱;④二氧化碳;⑤葡萄糖;⑥氯化镁;⑦Na2O2;⑧氨水;⑨NaHSO4;⑩硫酸铁溶液。
(1)上述十种物质中,属于电解质的有___________ ,属于非电解质的有___________ 。
(2)④的电子式为___________ 。
(3)用电子式表示⑥的形成过程___________ 。
(4)除去③中少量②的化学方程式为___________ 。
(5)⑦中含有的化学键为___________
Ⅱ、写出下列反应的离子方程式(已知还原性: ):
):
(6)向 溶液中通入
溶液中通入 ,
, 与
与 的化学计量数之比为
的化学计量数之比为 :
:___________ 。
(1)上述十种物质中,属于电解质的有
(2)④的电子式为
(3)用电子式表示⑥的形成过程
(4)除去③中少量②的化学方程式为
(5)⑦中含有的化学键为
Ⅱ、写出下列反应的离子方程式(已知还原性:
 ):
):(6)向
 溶液中通入
溶液中通入 ,
, 与
与 的化学计量数之比为
的化学计量数之比为 :
:
您最近一年使用:0次
10 . 回答下列问题:
(1)Fe、Co、Ni是三种重要的金属元素。Fe、Co、Ni都能与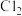 反应,其中Co和Ni均生成二氯化物,由此推断
反应,其中Co和Ni均生成二氯化物,由此推断 、
、 和
和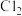 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为_______ 。一种钴氧化物晶胞如图所示,该氧化物中钴离子价电子排布式为_______ 。设阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为_______ g﹒cm-3。

(2)以钴矿[主要成分是CoO、 、
、 ,还含
,还含 及少量
及少量 、
、 、CuO及
、CuO及 等]为原料可制取钴的氧化物。利用钴矿制取钴的氧化物的主要步骤如下:
等]为原料可制取钴的氧化物。利用钴矿制取钴的氧化物的主要步骤如下:
①浸取:用盐酸和 溶液浸取钴矿,浸取液中含有
溶液浸取钴矿,浸取液中含有 、
、 、
、 、
、 、
、 、
、 、
、 等离子。写出
等离子。写出 发生反应的离子方程式:
发生反应的离子方程式:_______ 。
②除杂:向浸取液中先加入足量 氧化
氧化 ,再加入NaOH调节pH除去
,再加入NaOH调节pH除去 、
、 、
、 。有关沉淀数据如下表(“完全沉淀”时金属离子浓度
。有关沉淀数据如下表(“完全沉淀”时金属离子浓度 mol·L
mol·L ):
):
若浸取液中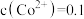 mol·L
mol·L ,则须调节溶液pH的范围是
,则须调节溶液pH的范围是_______ (加入 和NaOH时,溶液的体积变化忽略)。
和NaOH时,溶液的体积变化忽略)。
③萃取、反萃取:向除杂后的溶液中,加入某有机酸萃取剂 ,发生反应:
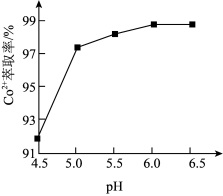
,发生反应: 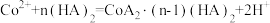 。实验测得:当溶液pH处于4.5~6.5范围内,
。实验测得:当溶液pH处于4.5~6.5范围内, 萃取率随溶液pH的增大而增大(如下图所示),其原因是
萃取率随溶液pH的增大而增大(如下图所示),其原因是_______ 。向萃取所得有机相中加入 ,反萃取得到水相。
,反萃取得到水相。
④沉钴、热分解:向反萃取后得到的水相中加入 溶液,过滤、洗涤、干燥,得到
溶液,过滤、洗涤、干燥,得到 晶体。称取14.64 g该晶体,在空气中加热一段时间后,得到CoO和
晶体。称取14.64 g该晶体,在空气中加热一段时间后,得到CoO和 的混合物。称量该混合物,质量为6.32 g,通过计算确定该混合物中CoO和
的混合物。称量该混合物,质量为6.32 g,通过计算确定该混合物中CoO和 的质量之比
的质量之比_______ (写出最简整数比)。
(1)Fe、Co、Ni是三种重要的金属元素。Fe、Co、Ni都能与
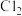 反应,其中Co和Ni均生成二氯化物,由此推断
反应,其中Co和Ni均生成二氯化物,由此推断 、
、 和
和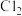 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为 ,则该晶体的密度为
,则该晶体的密度为
(2)以钴矿[主要成分是CoO、
 、
、 ,还含
,还含 及少量
及少量 、
、 、CuO及
、CuO及 等]为原料可制取钴的氧化物。利用钴矿制取钴的氧化物的主要步骤如下:
等]为原料可制取钴的氧化物。利用钴矿制取钴的氧化物的主要步骤如下:①浸取:用盐酸和
 溶液浸取钴矿,浸取液中含有
溶液浸取钴矿,浸取液中含有 、
、 、
、 、
、 、
、 、
、 、
、 等离子。写出
等离子。写出 发生反应的离子方程式:
发生反应的离子方程式:②除杂:向浸取液中先加入足量
 氧化
氧化 ,再加入NaOH调节pH除去
,再加入NaOH调节pH除去 、
、 、
、 。有关沉淀数据如下表(“完全沉淀”时金属离子浓度
。有关沉淀数据如下表(“完全沉淀”时金属离子浓度 mol·L
mol·L ):
):| 沉淀 |  |  |  |  |  |
| 恰好完全沉淀时的pH | 5.2 | 2.8 | 9.4 | 6.7 | 10.1 |
若浸取液中
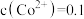 mol·L
mol·L ,则须调节溶液pH的范围是
,则须调节溶液pH的范围是 和NaOH时,溶液的体积变化忽略)。
和NaOH时,溶液的体积变化忽略)。③萃取、反萃取:向除杂后的溶液中,加入某有机酸萃取剂
 ,发生反应:
,发生反应: 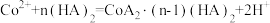 。实验测得:当溶液pH处于4.5~6.5范围内,
。实验测得:当溶液pH处于4.5~6.5范围内, 萃取率随溶液pH的增大而增大(如下图所示),其原因是
萃取率随溶液pH的增大而增大(如下图所示),其原因是 ,反萃取得到水相。
,反萃取得到水相。
④沉钴、热分解:向反萃取后得到的水相中加入
 溶液,过滤、洗涤、干燥,得到
溶液,过滤、洗涤、干燥,得到 晶体。称取14.64 g该晶体,在空气中加热一段时间后,得到CoO和
晶体。称取14.64 g该晶体,在空气中加热一段时间后,得到CoO和 的混合物。称量该混合物,质量为6.32 g,通过计算确定该混合物中CoO和
的混合物。称量该混合物,质量为6.32 g,通过计算确定该混合物中CoO和 的质量之比
的质量之比
您最近一年使用:0次



