名校
解题方法
1 . 把碎纸片b补充到a中,可得到一个完整的离子方程式(未配平),

下列说法正确的是

下列说法正确的是
| A.反应物微粒为SO2、 Mn2+、 H+ |
| B.该反应发生后溶液酸性增强 |
| C.氧化剂和还原剂的化学计量数之比为5∶2 |
| D.配平后H⁺的化学计量数为8 |
您最近一年使用:0次
2 . 一定条件下硝酸铵受热分解的未配平化学方程式为:NH4NO3→HNO3+N2+H2O,在反应中被氧化与被还原的氮原子数之比为
| A.5: 3 | B.5: 4 | C.1: 1 | D.3: 1 |
您最近一年使用:0次
名校
3 . 使用相关化学用语回答下列问题:
(1)用化学方程式表示金属钠的工业制法:___________ ;
(2)用化学方程式表示高炉炼铁的反应原理:___________ ;
(3)实验室使用 和浓盐酸制备氯气的反应离子方程式:
和浓盐酸制备氯气的反应离子方程式:___________ ;
(4)通过氯碱工业制备氯气的离子方程式:___________ ;
(5)用化学方程式表示氨气实验室制法的反应原理:___________ ;
(6)实验室制乙烯的化学反应方程式:___________ ;
(7)实验室制乙炔的化学反应方程式:___________ ;
(8)泡沫灭火器反应原理的离子方程式:___________ 。
(1)用化学方程式表示金属钠的工业制法:
(2)用化学方程式表示高炉炼铁的反应原理:
(3)实验室使用
 和浓盐酸制备氯气的反应离子方程式:
和浓盐酸制备氯气的反应离子方程式:(4)通过氯碱工业制备氯气的离子方程式:
(5)用化学方程式表示氨气实验室制法的反应原理:
(6)实验室制乙烯的化学反应方程式:
(7)实验室制乙炔的化学反应方程式:
(8)泡沫灭火器反应原理的离子方程式:
您最近一年使用:0次
4 . 炼油、石化等工业会产生含硫(-2价)废水,可通过催化氧化法进行处理,碱性条件下,催化氧化废水的机理如图所示。其中MnO2为催化剂,附着在催化剂载体聚苯胺的表面。下列说法错误的是
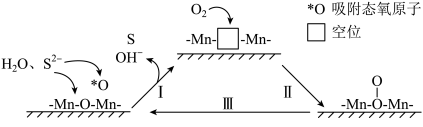
| A.转化I中Mn的化合价未发生变化 |
| B.催化氧化过程中有共价键的断裂 |
C.催化氧化过程的总反应为:O2+2H2O+2S2- 4OH-+2S 4OH-+2S |
| D.催化剂使用一段时间后催化效率会下降,原因是生成的S覆盖在催化剂表面或进入催化剂内空位处 |
您最近一年使用:0次
2023-10-10更新
|
407次组卷
|
3卷引用:天津市第一中学2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
5 . 铁及其化合物在生产生活中有重要应用。
Ⅰ.高铁酸钾(K2FeO4)是一种新型的污水处理剂。
(1)K2FeO4的制备:

①ⅰ中反应的离子方程式是___________
②将ⅱ中反应的离子方程式补充完整:

___________
③ⅲ中反应说明溶解度:
___________  (填“>”或“<”)。
(填“>”或“<”)。
(2)K2FeO4的性质:
ⅰ.将K2FeO4固体溶于蒸馏水中,有少量无色气泡产生,经检验为O2,液体有丁达尔效应。
ⅱ.将K2FeO4固体溶于浓KOH溶液中,放置2小时无明显变化。
ⅲ.将K2FeO4固体溶于硫酸中,产生无色气泡的速率明显比ⅰ快。
①K2FeO4溶于蒸馏水的化学反应方程式是___________ 。
②K2FcO4的氧化性与溶液pH的关系是___________ 。
(3)K2FeO4的应用。K2FeO4可用于生活垃圾渗透液的脱氮(将含氮物质转化为N2)处理。K2FeO4对生活垃圾渗透液的脱氮效果随水体pH的变化结果如下:

K2FeO4脱氮的最佳pH是___________ 。
Ⅱ.请回答:
(4)Fe、Co、Ni能与Cl2反应,其中Co和为Ni均生成二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为___________ 。Co(OH)3与盐酸反应有黄绿色气体生成,写出反应的离子方程式:___________ 。
Ⅰ.高铁酸钾(K2FeO4)是一种新型的污水处理剂。
(1)K2FeO4的制备:

①ⅰ中反应的离子方程式是
②将ⅱ中反应的离子方程式补充完整:

③ⅲ中反应说明溶解度:

 (填“>”或“<”)。
(填“>”或“<”)。(2)K2FeO4的性质:
ⅰ.将K2FeO4固体溶于蒸馏水中,有少量无色气泡产生,经检验为O2,液体有丁达尔效应。
ⅱ.将K2FeO4固体溶于浓KOH溶液中,放置2小时无明显变化。
ⅲ.将K2FeO4固体溶于硫酸中,产生无色气泡的速率明显比ⅰ快。
①K2FeO4溶于蒸馏水的化学反应方程式是
②K2FcO4的氧化性与溶液pH的关系是
(3)K2FeO4的应用。K2FeO4可用于生活垃圾渗透液的脱氮(将含氮物质转化为N2)处理。K2FeO4对生活垃圾渗透液的脱氮效果随水体pH的变化结果如下:

K2FeO4脱氮的最佳pH是
Ⅱ.请回答:
(4)Fe、Co、Ni能与Cl2反应,其中Co和为Ni均生成二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为
您最近一年使用:0次
6 . 离子反应和氧化还原反应原理在生产生活中有着广泛的应用。下图是某大型工厂利用含有CuCl2和FeCl2的废液来处理含H2S废气的原理示意图,此方法既避免了污染物排放又回收了硫磺,大大提高了生产效益。下列说法错误的是
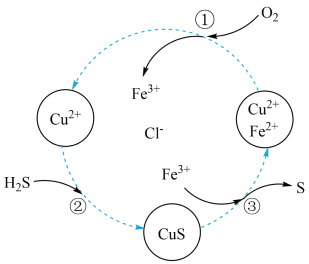

| A.步骤①③是氧化还原反应,步骤②是非氧化还原反应 |
B.该方法的总反应可表示为: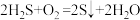 |
| C.步骤③中每生成1个S需要消耗1个Fe3+ |
| D.该方法中CuCl2和FeCl2可以循环使用 |
您最近一年使用:0次
2023-10-05更新
|
0次组卷
|
2卷引用:天津市第一中学2023-2024学年高一上学期11月期中化学试题
7 . 请回答下列问题:
C+4HNO3(浓) CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(1)氧化剂___________ ,还原剂___________ ,12g碳参与反应可得到___________ g还原产物。
(2)标出反应的双线桥___________
(3)配平反应方程式:
①________
___________Cu+___________HNO3→___________Cu(NO3)2+___________NO↑+___________H2O
②________
___________NO2+___________H2O=___________HNO3+___________NO。
C+4HNO3(浓)
 CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O(1)氧化剂
(2)标出反应的双线桥
(3)配平反应方程式:
①
___________Cu+___________HNO3→___________Cu(NO3)2+___________NO↑+___________H2O
②
___________NO2+___________H2O=___________HNO3+___________NO。
您最近一年使用:0次
名校
解题方法
8 . 中科院化学所研制的晶体材料——纳米四氧化三铁,在核磁共振造影及医药上有广泛用途,其生产过程的部分流程如图所示。
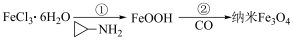
下列有关说法正确的是
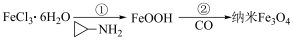
下列有关说法正确的是
| A.可用稀硫酸和K3[Fe(CN)6]鉴别Fe3O4和FeO |
B.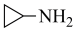 在反应①中的作用是促进氯化铁水解 在反应①中的作用是促进氯化铁水解 |
| C.将制得的纳米Fe3O4均匀分散在水中不会产生丁达尔效应 |
D.反应②发生的化学方程式为6FeOOH+3CO 2Fe3O4+3H2O+3CO2 2Fe3O4+3H2O+3CO2 |
您最近一年使用:0次
2023-09-24更新
|
79次组卷
|
2卷引用:天津市2023-2024学年天津一中高三年级第二次月考化学
名校
9 . I.配制0.50mol/LNaOH溶液。
(1)若实验中大约要使用245mLNaOH溶液,至少需要称量 NaOH固体
_______ g。
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):
_______ 。
Ⅱ.铋酸钠(NaBiO3)广泛应用于制药业,其粉末呈浅黄色,不溶于冷水,遇沸水或酸则迅速分解。某同学设计如下实验,利用白色且难溶于水的Bi(OH)3在NaOH溶液中与Cl2反应制备NaBiO2,并探究其应用,NaBiO3的制备,实验装置如下图(加热和夹持仪器已略去),请按要求回答下列问题:
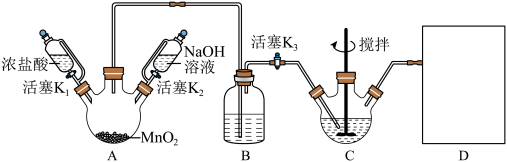
(3)A装置中盛装MnO2固体的仪器名称为
_______ ;B装置的作用是
_______ ;补全上图D装置图
_______ (并标注试剂名称)。
(4)C中反应的离子方程式为
_______ ,C装置在反应过程中不断搅拌的作用为
_______ ,当观察到现象为C中白色固体转化为淡黄色固体且黄色不再加深时,可以初步判断C中反应已经完成。
(5)反应完成后,为从装置C中获得尽可能多的产品,需进行的操作:在冰水中冷却结晶、过滤、洗涤,干燥。实验结束后,打开A装置中的活塞K2,让NaOH溶液进入A装置中,请用离子方程式表示该操作的作用:
_______ 。
(6)铋酸钠的应用,检测Mn2+。向含有Mn2+的溶液中加入铋酸钠,再加入硫酸酸化,溶液变为紫红色,此反应中铋酸钠的作用是
_______ 。
(1)若实验中大约要使用245mLNaOH溶液,至少需要
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
Ⅱ.铋酸钠(NaBiO3)广泛应用于制药业,其粉末呈浅黄色,不溶于冷水,遇沸水或酸则迅速分解。某同学设计如下实验,利用白色且难溶于水的Bi(OH)3在NaOH溶液中与Cl2反应制备NaBiO2,并探究其应用,NaBiO3的制备,实验装置如下图(加热和夹持仪器已略去),请按要求回答下列问题:

(3)A装置中盛装MnO2固体的仪器名称为
(4)C中反应的离子方程式为
(5)反应完成后,为从装置C中获得尽可能多的产品,需进行的操作:在冰水中冷却结晶、过滤、洗涤,干燥。实验结束后,打开A装置中的活塞K2,让NaOH溶液进入A装置中,请用离子方程式表示该操作的作用:
(6)铋酸钠的应用,检测Mn2+。向含有Mn2+的溶液中加入铋酸钠,再加入硫酸酸化,溶液变为紫红色,此反应中铋酸钠的作用是
您最近一年使用:0次
2023-09-24更新
|
51次组卷
|
2卷引用:天津市第四十七中学2023-2024学年高三上学期第一次阶段性检测化学试题
名校
解题方法
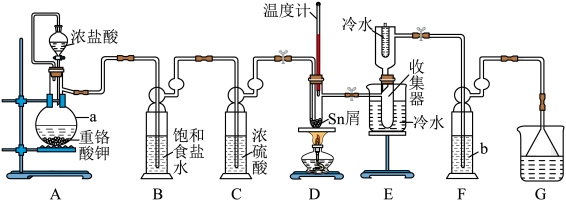
10 . 无水四氯化锡( )常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点为232℃)与
)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点为232℃)与 反应制备
反应制备 ,装置如图所示。
,装置如图所示。
已知:① 在潮湿空气中极易水解生成
在潮湿空气中极易水解生成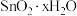
②各物质熔沸点:
(1)仪器a的名称为___________ ,重铬酸钾( )与浓盐酸反应时,还原产物是
)与浓盐酸反应时,还原产物是 ,装置A中发生反应的离子方程式为
,装置A中发生反应的离子方程式为___________ 。
(2)F装置中试剂b为___________ ,其作用是___________ 。
(3)锡屑中含铜杂质导致D中产生 ,但不影响E中产品的纯度,原因是
,但不影响E中产品的纯度,原因是___________ 。
(4)E所得产品 中常溶有少量
中常溶有少量 杂质,可用
杂质,可用___________ 方法提纯。
(5)制得的 产品中常含有
产品中常含有 ,可用如下方法测定产品纯度:先准确称量7.60g产品于锥形瓶中,再加过量的
,可用如下方法测定产品纯度:先准确称量7.60g产品于锥形瓶中,再加过量的 溶液,发生反应:
溶液,发生反应: ,再用
,再用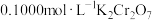 标准溶液滴定生成的
标准溶液滴定生成的 ,此时还原产物为
,此时还原产物为 ,消耗标准溶液20.00mL,则
,消耗标准溶液20.00mL,则 产品的纯度为
产品的纯度为___________ 。
 )常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点为232℃)与
)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点为232℃)与 反应制备
反应制备 ,装置如图所示。
,装置如图所示。
已知:①
 在潮湿空气中极易水解生成
在潮湿空气中极易水解生成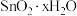
②各物质熔沸点:
| 物质 | 熔点/℃ | 沸点/℃ |
 | 246 | 652 |
 | -33 | 114 |
 | 620 | 993 |
 )与浓盐酸反应时,还原产物是
)与浓盐酸反应时,还原产物是 ,装置A中发生反应的离子方程式为
,装置A中发生反应的离子方程式为(2)F装置中试剂b为
(3)锡屑中含铜杂质导致D中产生
 ,但不影响E中产品的纯度,原因是
,但不影响E中产品的纯度,原因是(4)E所得产品
 中常溶有少量
中常溶有少量 杂质,可用
杂质,可用(5)制得的
 产品中常含有
产品中常含有 ,可用如下方法测定产品纯度:先准确称量7.60g产品于锥形瓶中,再加过量的
,可用如下方法测定产品纯度:先准确称量7.60g产品于锥形瓶中,再加过量的 溶液,发生反应:
溶液,发生反应: ,再用
,再用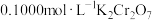 标准溶液滴定生成的
标准溶液滴定生成的 ,此时还原产物为
,此时还原产物为 ,消耗标准溶液20.00mL,则
,消耗标准溶液20.00mL,则 产品的纯度为
产品的纯度为
您最近一年使用:0次



