1 . 防治环境污染,改善生态环境已成为全球共识。回答下列问题:
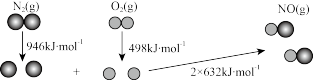
(1)汽车尾气中NO生成过程中的能量变化如图所示。生成1 mol
___________ (填“吸收”或“放出”)___________ kJ的热量。
(2)汽车尾气(含CO、 和
和 等)是城市空气的污染源之一,三元催化可以将汽车尾气中的CO和
等)是城市空气的污染源之一,三元催化可以将汽车尾气中的CO和 进行净化处理,写出NO和CO反应转化为无害气体的化学方程式
进行净化处理,写出NO和CO反应转化为无害气体的化学方程式___________ 。
(3)硝酸工业废气中有氮氧化物( ),利用尿素消除
),利用尿素消除 污染的转化反应为:
污染的转化反应为:
ⅰ.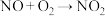 ,ⅱ.
,ⅱ.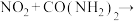 无污染气体。
无污染气体。
尿素中C元素的化合价___________ ,反应ⅱ的化学方程式为___________ 。
(4)用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。

①在酸性NaClO溶液中,HClO氧化NO生成 和
和 ,其离子方程式为
,其离子方程式为___________ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是___________ 。
(5)加入过量次氯酸钠可使废水中 完全转化为
完全转化为 ,而本身被还原为NaCl。
,而本身被还原为NaCl。
①检验废水中是否存在 的方法是
的方法是___________ 。
②若处理废水产生了0.448 L (标准状况),则需消耗浓度为2 mol/L的次氯酸钠的体积为
(标准状况),则需消耗浓度为2 mol/L的次氯酸钠的体积为___________ mL。
(1)汽车尾气中NO生成过程中的能量变化如图所示。生成1 mol


(2)汽车尾气(含CO、
 和
和 等)是城市空气的污染源之一,三元催化可以将汽车尾气中的CO和
等)是城市空气的污染源之一,三元催化可以将汽车尾气中的CO和 进行净化处理,写出NO和CO反应转化为无害气体的化学方程式
进行净化处理,写出NO和CO反应转化为无害气体的化学方程式(3)硝酸工业废气中有氮氧化物(
 ),利用尿素消除
),利用尿素消除 污染的转化反应为:
污染的转化反应为:ⅰ.
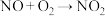 ,ⅱ.
,ⅱ.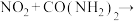 无污染气体。
无污染气体。尿素中C元素的化合价
(4)用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成
 和
和 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是
(5)加入过量次氯酸钠可使废水中
 完全转化为
完全转化为 ,而本身被还原为NaCl。
,而本身被还原为NaCl。①检验废水中是否存在
 的方法是
的方法是②若处理废水产生了0.448 L
 (标准状况),则需消耗浓度为2 mol/L的次氯酸钠的体积为
(标准状况),则需消耗浓度为2 mol/L的次氯酸钠的体积为
您最近一年使用:0次
名校
解题方法
2 . 在工业上,可以从废水或废料中回收金属单质或金属的化合物。
Ⅰ.某工厂排出的废水中含有大量的Fe2+、Cu2+和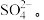 某校研究性学习小组设计如图流程以回收铜和硫酸亚铁。
某校研究性学习小组设计如图流程以回收铜和硫酸亚铁。

(1)操作①中用到的玻璃仪器是_____(填序号)。
(2)固体成份是_____ (填名称)。
(3)原料②的名称_____ 。
(4)回收的铜可用于制备胆矾 ,可将铜和一定浓度稀硫酸混合后并在加热的情况下通入氧气,发生如下反应:
,可将铜和一定浓度稀硫酸混合后并在加热的情况下通入氧气,发生如下反应: ,制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾。请分析上述反应中,氧化剂是
,制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾。请分析上述反应中,氧化剂是_____ (填化学式)。
Ⅱ.某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取PAFC(聚合氯化铁铝 设计生产流程如下,请回答下列问题:
设计生产流程如下,请回答下列问题:

(5)用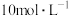 的浓盐酸配制
的浓盐酸配制 的稀盐酸,所用玻璃仪器除量筒和玻璃棒外,还有_____(填序号)。
的稀盐酸,所用玻璃仪器除量筒和玻璃棒外,还有_____(填序号)。
(6)下列关于PAFC的说法中正确的是_____(填序号)。
(7)步骤Ⅱ中取样分析的目的是_____(填序号)。
(8)写出向溶液中加入NaClO3时,发生反应的离子方程式为_____ 。
Ⅰ.某工厂排出的废水中含有大量的Fe2+、Cu2+和
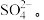 某校研究性学习小组设计如图流程以回收铜和硫酸亚铁。
某校研究性学习小组设计如图流程以回收铜和硫酸亚铁。
(1)操作①中用到的玻璃仪器是_____(填序号)。
| A.烧杯 | B.漏斗 | C.玻璃棒 | D.酒精灯 |
(2)固体成份是
(3)原料②的名称
(4)回收的铜可用于制备胆矾
 ,可将铜和一定浓度稀硫酸混合后并在加热的情况下通入氧气,发生如下反应:
,可将铜和一定浓度稀硫酸混合后并在加热的情况下通入氧气,发生如下反应: ,制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾。请分析上述反应中,氧化剂是
,制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾。请分析上述反应中,氧化剂是Ⅱ.某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取PAFC(聚合氯化铁铝
 设计生产流程如下,请回答下列问题:
设计生产流程如下,请回答下列问题:
(5)用
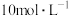 的浓盐酸配制
的浓盐酸配制 的稀盐酸,所用玻璃仪器除量筒和玻璃棒外,还有_____(填序号)。
的稀盐酸,所用玻璃仪器除量筒和玻璃棒外,还有_____(填序号)。| A.容量瓶 | B.烧杯 | C.烧瓶 | D.胶头滴管 |
(6)下列关于PAFC的说法中正确的是_____(填序号)。
| A.PAFC是一种有机高分子化合物 |
| B.PAFC中Fe显+2价 |
| C.PAFC溶于水能电离出OH-,是一种碱 |
| D.PAFC在强酸性和强碱性溶液中均不能稳定存在 |
(7)步骤Ⅱ中取样分析的目的是_____(填序号)。
A.测定溶液中 与 与 的含量比 的含量比 |
| B.测定原料是否完全溶解 |
C.测定溶液中 的含量,以确定加入 的含量,以确定加入 的量 的量 |
| D.测定溶液中Al3+的含量 |
(8)写出向溶液中加入NaClO3时,发生反应的离子方程式为
您最近一年使用:0次
3 . 门捷列夫在研究周期表时预言了包括“类铝”、“类硅”在内的11种元素。回答下列问题:
Ⅰ. “类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。
(1)铝是一种活泼金属,工业上采用电解熔融Al2O3制备金属Al。电解反应方程式为2Al2O3 4Al+3O2↑,加入冰晶石的目的是
4Al+3O2↑,加入冰晶石的目的是_______ 。Al可以与NaOH溶液反应生成Na[Al(OH)4]与H2,该反应的离子方程式为_______ 。
(2)镓与铝同主族,且位于铝的下一周期,则镓的原子结构示意图为_______ 。
(3)废弃的含GaAs的材料可以用浓硝酸溶解,放出红棕色气体,同时生成H3AsO4和Ga(NO3)3,该反应的化学方程式为_______ 。
Ⅱ.门捷列夫预言的“类硅”,多年后被德国化学家文克勒发现,命名为锗(Ge)。
(4)硅是应用最为广泛的半导体材料,写出高纯硅的两种用途:_______ 、_______ 。
(5)写出SiCl4的电子式:_______
(6)硅和锗单质分别与H2反应时,反应较难进行的是_______ (填“硅”或“锗”)。
Ⅰ. “类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。
(1)铝是一种活泼金属,工业上采用电解熔融Al2O3制备金属Al。电解反应方程式为2Al2O3
 4Al+3O2↑,加入冰晶石的目的是
4Al+3O2↑,加入冰晶石的目的是(2)镓与铝同主族,且位于铝的下一周期,则镓的原子结构示意图为
(3)废弃的含GaAs的材料可以用浓硝酸溶解,放出红棕色气体,同时生成H3AsO4和Ga(NO3)3,该反应的化学方程式为
Ⅱ.门捷列夫预言的“类硅”,多年后被德国化学家文克勒发现,命名为锗(Ge)。
(4)硅是应用最为广泛的半导体材料,写出高纯硅的两种用途:
(5)写出SiCl4的电子式:
(6)硅和锗单质分别与H2反应时,反应较难进行的是
您最近一年使用:0次
名校
解题方法
4 . 国际化学年的中国宣传口号是“化学-我们的生活,我们的未来”。学习化学应该明白“从生活中来,到生活中去”道理。请填空:
(1)①若金属钠等活泼金属着火时,应该用______ 来灭火。
②小苏打可治疗胃酸过多,其反应的离子反应方程式为:______ 。
(2)火药是中国的“四大发明”之一、黑火药在发生爆炸时,发生如下反应: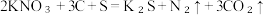 ,其中被氧化的元素是
,其中被氧化的元素是______ ,还原产物是______ 。
(3)人体内铁元素是以Fe2+和Fe3+的形式存在。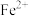 易被人体吸收,服用维生素C,可使Fe3+转化成Fe2+,有利于人体吸收,说明维生素C具有
易被人体吸收,服用维生素C,可使Fe3+转化成Fe2+,有利于人体吸收,说明维生素C具有______ (填“氧化性”或“还原性”)。
(4)探究碳酸氢钠的热稳定性,并利用其产物验证过氧化钠与二氧化碳的反应,按如图装置图进行实验。
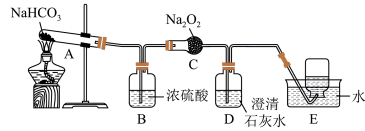
①C中反应的化学方程式为______ 。
②E中收集的气体主要是______ 。
(5)请将5种物质: 、
、 、
、 (N
(N )3、HNO3和
)3、HNO3和 分别填入下面对应的横线上,组成一个已配平的化学方程式
分别填入下面对应的横线上,组成一个已配平的化学方程式______ 。
→▢______+▢______→▢______+▢______+▢______+▢
(1)①若金属钠等活泼金属着火时,应该用
②小苏打可治疗胃酸过多,其反应的离子反应方程式为:
(2)火药是中国的“四大发明”之一、黑火药在发生爆炸时,发生如下反应:
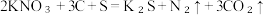 ,其中被氧化的元素是
,其中被氧化的元素是(3)人体内铁元素是以Fe2+和Fe3+的形式存在。
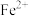 易被人体吸收,服用维生素C,可使Fe3+转化成Fe2+,有利于人体吸收,说明维生素C具有
易被人体吸收,服用维生素C,可使Fe3+转化成Fe2+,有利于人体吸收,说明维生素C具有(4)探究碳酸氢钠的热稳定性,并利用其产物验证过氧化钠与二氧化碳的反应,按如图装置图进行实验。

①C中反应的化学方程式为
②E中收集的气体主要是
(5)请将5种物质:
 、
、 、
、 (N
(N )3、HNO3和
)3、HNO3和 分别填入下面对应的横线上,组成一个已配平的化学方程式
分别填入下面对应的横线上,组成一个已配平的化学方程式→▢______+▢______→▢______+▢______+▢______+▢

您最近一年使用:0次
名校
5 . 碳酸亚铁可用于制备补血剂。某研究小组制备了FeCO3,并对FeCO3的性质和应用进行了探究。
已知:①FeCO3是白色固体,难溶于水;②Fe2++6SCN- [Fe(SCN)6]4-(无色)。
[Fe(SCN)6]4-(无色)。
I.FeCO3的制取(夹持装置略)
实验i:
装置C中,向Na2CO3溶液(pH=11.9)通入一段时间CO2至其pH为7,滴加一定量FeSO4溶液,产生白色沉淀,过滤、洗涤、干燥,得到FeCO3固体。
(1)试剂a是___________ 。
(2)向Na2CO3溶液通入CO2的目的是___________ 。
(3)C装置中制取FeCO3的离子方程式为___________ 。
(4)有同学认为C中出现白色沉淀之后应继续通CO2,你认为是否合理并说明理由:___________ 。
II.FeCO3的性质探究
实验ii
实验iii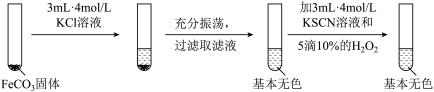
(5)对比实验ii和iii,得出的实验结论是___________ 。
(6)依据实验ii的现象,配平加入10%H2O2溶液的离子方程式:___________ 。
___________[Fe(SCN)6]4___________H2O2=___________Fe(OH)3↓+___________Fe(SCN)3+___________SCN-
III.FeCO3的应用
(7)FeCO3溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁([CH3CH(OH)COO]2Fe,相对分子质量为234)补血剂。为测定补血剂中亚铁含量进而计算乳酸亚铁的质量分数,南开中学化学实验小组准确称量1.0g补血剂,用酸性KMnO4溶液滴定该补血剂,消耗0.1000mol/L的KMnO4溶液10.00mL,则乳酸亚铁在补血剂中的质量分数为___________ ,该数值异常的原因是___________ (不考虑操作不当以及试剂变质引起的误差)。
已知:①FeCO3是白色固体,难溶于水;②Fe2++6SCN-
 [Fe(SCN)6]4-(无色)。
[Fe(SCN)6]4-(无色)。I.FeCO3的制取(夹持装置略)
实验i:

装置C中,向Na2CO3溶液(pH=11.9)通入一段时间CO2至其pH为7,滴加一定量FeSO4溶液,产生白色沉淀,过滤、洗涤、干燥,得到FeCO3固体。
(1)试剂a是
(2)向Na2CO3溶液通入CO2的目的是
(3)C装置中制取FeCO3的离子方程式为
(4)有同学认为C中出现白色沉淀之后应继续通CO2,你认为是否合理并说明理由:
II.FeCO3的性质探究
实验ii

实验iii

(5)对比实验ii和iii,得出的实验结论是
(6)依据实验ii的现象,配平加入10%H2O2溶液的离子方程式:
___________[Fe(SCN)6]4___________H2O2=___________Fe(OH)3↓+___________Fe(SCN)3+___________SCN-
III.FeCO3的应用
(7)FeCO3溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁([CH3CH(OH)COO]2Fe,相对分子质量为234)补血剂。为测定补血剂中亚铁含量进而计算乳酸亚铁的质量分数,南开中学化学实验小组准确称量1.0g补血剂,用酸性KMnO4溶液滴定该补血剂,消耗0.1000mol/L的KMnO4溶液10.00mL,则乳酸亚铁在补血剂中的质量分数为
您最近一年使用:0次
名校
解题方法
6 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等氧化物,从铬钒渣中分离提取铬和钒的一种流程如图所示:
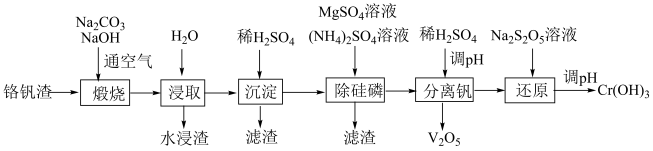
已知:i)最高价铬酸根在酸性介质中以Cr2O 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在;
存在;
ii)pH<7时,硅元素以H2SiO3形式存在;
iii)pH在4-12之间,铝元素以Al(OH)3形式存在。
回答下列问题:
(1)Cr元素的价电子轨道表示式_________ 。
(2)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为______ (填化学式)。
(3)水浸渣中主要物质为______ (填化学式)。
(4)“沉淀”步骤调pH到弱碱性,主要除去的杂质为_______ (填化学式)。
(5)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH以达到最好的除杂效果,下列说法中,正确的是______ 。
a.若pH过小,磷酸根会与H+反应使其浓度降低导致MgNH4PO4无法完全沉淀
b.若pH过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
c.若pH过大,会导致镁离子生成氢氧化镁沉淀,不能形成MgSiO3沉淀,导致产品中混有杂质
d.若pH过大,溶液中铵根离子浓度增大,降低导致MgNH4PO4无法完全沉淀
(6)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有______ (填标号)。
A.酸性 B.碱性 C.两性
(7)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为________ 。

已知:i)最高价铬酸根在酸性介质中以Cr2O
 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在;
存在;ii)pH<7时,硅元素以H2SiO3形式存在;
iii)pH在4-12之间,铝元素以Al(OH)3形式存在。
回答下列问题:
(1)Cr元素的价电子轨道表示式
(2)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为
(3)水浸渣中主要物质为
(4)“沉淀”步骤调pH到弱碱性,主要除去的杂质为
(5)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH以达到最好的除杂效果,下列说法中,正确的是
a.若pH过小,磷酸根会与H+反应使其浓度降低导致MgNH4PO4无法完全沉淀
b.若pH过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
c.若pH过大,会导致镁离子生成氢氧化镁沉淀,不能形成MgSiO3沉淀,导致产品中混有杂质
d.若pH过大,溶液中铵根离子浓度增大,降低导致MgNH4PO4无法完全沉淀
(6)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO
 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有A.酸性 B.碱性 C.两性
(7)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为
您最近一年使用:0次
2023-10-27更新
|
379次组卷
|
2卷引用:天津市南开中学2023-2024学年高三上学期第一次月考化学试题
名校
7 . 按照要求写出下列相关方程式
(1)写出相应电解质在水中的电离方程式
①碳酸氢钠___________ 。
②硫酸氢钠___________ 。
(2)写出相应离子方程式
①钠与水的反应___________ 。
②过氧化钠与水的反应___________ 。
③已知氧化性: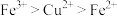 ,将足量Cu投入至FeCl3溶液中
,将足量Cu投入至FeCl3溶液中___________
④向Ba(OH)2溶液中滴加NaHSO4溶液至Ba2+沉淀完全___________ 。继续向上述溶液中滴加NaHSO4溶液至过量___________
⑤已知还原性: ,向FeBr2溶液中通入少量Cl2
,向FeBr2溶液中通入少量Cl2___________ ;向FeI2溶液中通入和Fe2+等数目的Cl2___________ 。
(3)写出相应化学方程式
①钠在空气中加热___________ 。
②制备氢氧化铁胶体的反应___________ 。
(4)用双线桥法表示下列反应的电子转移方向和数目___________ 。
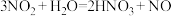
(5)用单线桥法表示下列反应的电子转移方向和数目___________ 。

(6)配平下列方程式
①超氧化钾(KO2)与水的反应:___________ 。
___________KO2+___________H2O→___________KOH+___________O2↑+___________H2O2
②___________ 。
___________ +___________ClO-→N2↑+Cl-+___________+___________
+___________ClO-→N2↑+Cl-+___________+___________
(1)写出相应电解质在水中的电离方程式
①碳酸氢钠
②硫酸氢钠
(2)写出相应离子方程式
①钠与水的反应
②过氧化钠与水的反应
③已知氧化性:
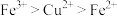 ,将足量Cu投入至FeCl3溶液中
,将足量Cu投入至FeCl3溶液中④向Ba(OH)2溶液中滴加NaHSO4溶液至Ba2+沉淀完全
⑤已知还原性:
 ,向FeBr2溶液中通入少量Cl2
,向FeBr2溶液中通入少量Cl2(3)写出相应化学方程式
①钠在空气中加热
②制备氢氧化铁胶体的反应
(4)用双线桥法表示下列反应的电子转移方向和数目
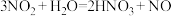
(5)用单线桥法表示下列反应的电子转移方向和数目

(6)配平下列方程式
①超氧化钾(KO2)与水的反应:
___________KO2+___________H2O→___________KOH+___________O2↑+___________H2O2
②
___________
 +___________ClO-→N2↑+Cl-+___________+___________
+___________ClO-→N2↑+Cl-+___________+___________
您最近一年使用:0次
名校
8 . 工业废气中的氮氧化物(如NO、NO2等,用通式NOx表示)是主要的大气污染物之一、为了保护环境,工业上常通入氨气与之发生如下反应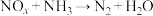 来消除污染。有关此反应,下列说法中错误的是
来消除污染。有关此反应,下列说法中错误的是
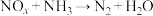 来消除污染。有关此反应,下列说法中错误的是
来消除污染。有关此反应,下列说法中错误的是| A.N2既是氧化产物又是还原产物 |
| B.当x=1时,每生成5个N2分子,被氧化的气体分子有6个 |
| C.当x=2时,有1个气体分子被还原,将转移4个电子 |
D.反应通式配平表示为: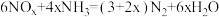 |
您最近一年使用:0次
名校
9 . 有一未完成的离子方程式: 。据此判断下列说法错误的是
。据此判断下列说法错误的是
 。据此判断下列说法错误的是
。据此判断下列说法错误的是| A.X原子最外层电子数为5 |
| B.当有3个X2生成时,转移5个电子 |
C.“□”中所填的微粒为 |
| D.氧化产物和还原产物的质量之比为5∶1 |
您最近一年使用:0次
名校
解题方法
10 . 配平下列化学方程式:
(1)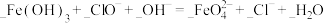
_______________________________
(2)
_______________________________
(3)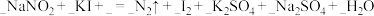
_______________________________
(1)
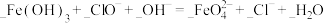
(2)

(3)
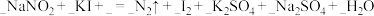
您最近一年使用:0次



