1 .  是新一代饮用水的消毒剂,许多发达国家的自来水厂采用
是新一代饮用水的消毒剂,许多发达国家的自来水厂采用  代替
代替  来进行自来水消毒,我国最近成功研制出制取
来进行自来水消毒,我国最近成功研制出制取  的新方法,其反应的微观过程如图所示
的新方法,其反应的微观过程如图所示
 是新一代饮用水的消毒剂,许多发达国家的自来水厂采用
是新一代饮用水的消毒剂,许多发达国家的自来水厂采用  代替
代替  来进行自来水消毒,我国最近成功研制出制取
来进行自来水消毒,我国最近成功研制出制取  的新方法,其反应的微观过程如图所示
的新方法,其反应的微观过程如图所示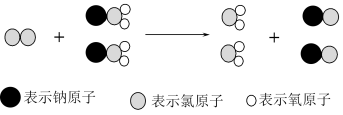
| A.该反应是复分解反应 |
B.该反应的化学方程式为  |
| C.反应过程中存在共价键、离子键的断裂与形成 |
D.生成 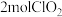 时转移的电子数为 时转移的电子数为 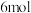 |
您最近半年使用:0次
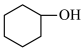
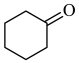
2 . 环己酮是无色油状液体, 时在水中的溶解度为
时在水中的溶解度为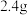 。实验室由环己醇制备环己酮。
。实验室由环己醇制备环己酮。
【实验原理】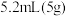 环已醇和
环已醇和 冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。
冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。
Ⅱ.在室温下继续搅拌 ,然后加入饱和亚硫酸氢钠溶液。
,然后加入饱和亚硫酸氢钠溶液。
Ⅲ.在反应混合物中加入 水、
水、 氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。
氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。
Ⅳ.在搅拌情况下向馏出液中加入无水碳酸钠至中性,然后再加入精制食盐使之饱和,将此液体倒入分液漏斗,分出有机层。
Ⅴ.向有机层中加入无水 ,静置,过滤,对滤液进行蒸馏,得到产品
,静置,过滤,对滤液进行蒸馏,得到产品 。
。
回答下列问题。
(1)仪器X的名称为_______ 。
(2)步骤Ⅰ中,加入冰醋酸除作为溶剂外,还有的作用是_______ 。用淀粉碘化钾试纸可检验反应后的液体,如果试纸变_______ 色,说明次氯酸钠过量。
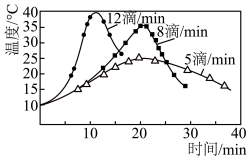
(3)步骤Ⅰ中,次氯酸钠溶液要在冰水浴冷却下逐滴加入,勿使氧化反应进行得过于猛烈而升温过高,否则产物环己酮将进一步被氧化而发生碳链断裂。在次氯酸钠的不同滴加速度下,在冰水浴存在的情况下,溶液温度随滴加时间变化曲线如图,为了控制好反应温度,应选择的滴速为_______ 滴/ 。
。_______ 。
(5)在步骤Ⅳ中,加入精制食盐的目的是_______ 。
(6)在步骤Ⅴ中,加入无水 的作用为
的作用为_______ 。
(7)产品的产率为_______ (精确至0.1%)。
 时在水中的溶解度为
时在水中的溶解度为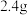 。实验室由环己醇制备环己酮。
。实验室由环己醇制备环己酮。【实验原理】
 +NaClO
+NaClO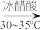
 +NaCl+H2O
+NaCl+H2O 
【装置示意图】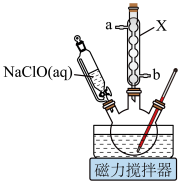
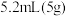 环已醇和
环已醇和 冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。
冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。Ⅱ.在室温下继续搅拌
 ,然后加入饱和亚硫酸氢钠溶液。
,然后加入饱和亚硫酸氢钠溶液。Ⅲ.在反应混合物中加入
 水、
水、 氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。
氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。Ⅳ.在搅拌情况下向馏出液中加入无水碳酸钠至中性,然后再加入精制食盐使之饱和,将此液体倒入分液漏斗,分出有机层。
Ⅴ.向有机层中加入无水
 ,静置,过滤,对滤液进行蒸馏,得到产品
,静置,过滤,对滤液进行蒸馏,得到产品 。
。回答下列问题。
(1)仪器X的名称为
(2)步骤Ⅰ中,加入冰醋酸除作为溶剂外,还有的作用是
(3)步骤Ⅰ中,次氯酸钠溶液要在冰水浴冷却下逐滴加入,勿使氧化反应进行得过于猛烈而升温过高,否则产物环己酮将进一步被氧化而发生碳链断裂。在次氯酸钠的不同滴加速度下,在冰水浴存在的情况下,溶液温度随滴加时间变化曲线如图,为了控制好反应温度,应选择的滴速为
 。
。
(5)在步骤Ⅳ中,加入精制食盐的目的是
(6)在步骤Ⅴ中,加入无水
 的作用为
的作用为(7)产品的产率为
您最近半年使用:0次
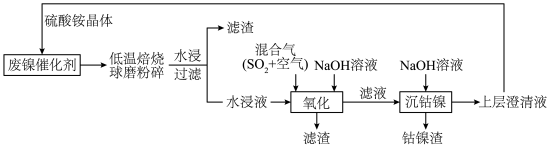
3 . 一种废镍催化剂回收镍、钴元素的工艺流程图如下,流程图中水浸液中含有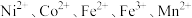 。
。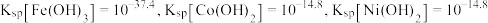 。
。
回答下列问题。
(1)球磨粉碎的作用是_______ 。
(2)“氧化”中,混合气在金属离子的催化作用下,生成具有强氧化性的过一硫酸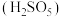 ,其反应的化学方程式为
,其反应的化学方程式为_______ 。
(3)“氧化”中, 被过一硫酸氧化为
被过一硫酸氧化为 沉淀,过一硫酸被还原为硫酸根离子,写出该反应的离子方程式:
沉淀,过一硫酸被还原为硫酸根离子,写出该反应的离子方程式:_______ (已知 的电离第一步完全,第二步微弱);用
的电离第一步完全,第二步微弱);用 溶液调节
溶液调节 ,还有
,还有_______ (写离子符号)也会形成沉淀而除去。
(4)“氧化”中保持空气通入速率不变, 的氧化率与
的氧化率与 的体积分数的关系如图所示。
的体积分数的关系如图所示。 的体积分数为9.0%时,
的体积分数为9.0%时, 的氧化率最大;当
的氧化率最大;当 的体积分数大于9.0%时,继续增大
的体积分数大于9.0%时,继续增大 的体积分数,
的体积分数, 的氧化率减小的原因可能是
的氧化率减小的原因可能是_______ 。 沉淀完全,需控制溶液的
沉淀完全,需控制溶液的 不低于
不低于_______ (说明:当溶液中的 浓度均小于
浓度均小于 时,认为已沉淀完全)。
时,认为已沉淀完全)。
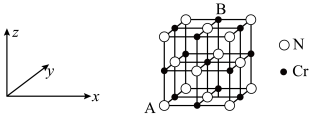
(6)铬、钴、镍都属于副族金属元素,其中铬与氮气在一定条件下可以合成氨化铬,且氮化铬的晶体结构及类型与氯化钠的相似,其晶胞结构如图所示。A点的分数坐标为 ,则B点的分数坐标为
,则B点的分数坐标为_______ 。已知氮化铬的晶胞参数为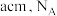 为阿伏加德罗常数,则该晶胞的密度为
为阿伏加德罗常数,则该晶胞的密度为_______  。
。
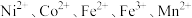 。
。
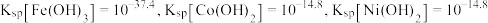 。
。回答下列问题。
(1)球磨粉碎的作用是
(2)“氧化”中,混合气在金属离子的催化作用下,生成具有强氧化性的过一硫酸
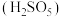 ,其反应的化学方程式为
,其反应的化学方程式为(3)“氧化”中,
 被过一硫酸氧化为
被过一硫酸氧化为 沉淀,过一硫酸被还原为硫酸根离子,写出该反应的离子方程式:
沉淀,过一硫酸被还原为硫酸根离子,写出该反应的离子方程式: 的电离第一步完全,第二步微弱);用
的电离第一步完全,第二步微弱);用 溶液调节
溶液调节 ,还有
,还有(4)“氧化”中保持空气通入速率不变,
 的氧化率与
的氧化率与 的体积分数的关系如图所示。
的体积分数的关系如图所示。 的体积分数为9.0%时,
的体积分数为9.0%时, 的氧化率最大;当
的氧化率最大;当 的体积分数大于9.0%时,继续增大
的体积分数大于9.0%时,继续增大 的体积分数,
的体积分数, 的氧化率减小的原因可能是
的氧化率减小的原因可能是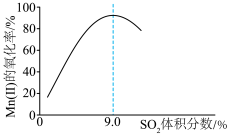
 沉淀完全,需控制溶液的
沉淀完全,需控制溶液的 不低于
不低于 浓度均小于
浓度均小于 时,认为已沉淀完全)。
时,认为已沉淀完全)。(6)铬、钴、镍都属于副族金属元素,其中铬与氮气在一定条件下可以合成氨化铬,且氮化铬的晶体结构及类型与氯化钠的相似,其晶胞结构如图所示。A点的分数坐标为
 ,则B点的分数坐标为
,则B点的分数坐标为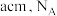 为阿伏加德罗常数,则该晶胞的密度为
为阿伏加德罗常数,则该晶胞的密度为 。
。
您最近半年使用:0次
4 .  是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某
是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某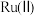 催化剂(用
催化剂(用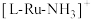 表示)能高效电催化氧化
表示)能高效电催化氧化 合成
合成 ,其反应机理如图所示。下列说法正确的是
,其反应机理如图所示。下列说法正确的是
 是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某
是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某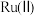 催化剂(用
催化剂(用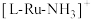 表示)能高效电催化氧化
表示)能高效电催化氧化 合成
合成 ,其反应机理如图所示。下列说法正确的是
,其反应机理如图所示。下列说法正确的是
A.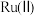 催化剂降低该反应的活化能,大大缩短达到化学平衡所需的时间 催化剂降低该反应的活化能,大大缩短达到化学平衡所需的时间 |
B.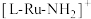 中氮原子上有孤电子对 中氮原子上有孤电子对 |
C.该过程的总反应式为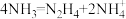 |
D.由于 中存在非极性共价键,所以 中存在非极性共价键,所以 易溶于水 易溶于水 |
您最近半年使用:0次
解题方法
5 . 无水 可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是
可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是 和
和 等)和焦炭制备,流程如下:
等)和焦炭制备,流程如下: 、
、 分别在178℃,316℃时升华。
分别在178℃,316℃时升华。
(1)氯化炉中 、
、 和焦炭在高温下发生反应的化学方程式为
和焦炭在高温下发生反应的化学方程式为___________ ;炉气中残余的少量 可用NaOH溶液吸收,其离子方程式为
可用NaOH溶液吸收,其离子方程式为___________ 。
(2)700℃时,升华器中物质经充分反应后需降温实现 和
和 的分离。请选择合适的温度范围:(填字母)
的分离。请选择合适的温度范围:(填字母)___________ 。
A.低于178℃ B.介于178℃和316℃之间 C.高于316℃
(3)升华器中发生反应的基本反应类型是___________ 。
(4)为测定制得的无水 产品(含杂质
产品(含杂质 )的纯度,称取16.25g无水
)的纯度,称取16.25g无水 样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.16g。
样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.16g。
①上述除杂过程中涉及的离子方程式为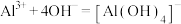 、
、___________ 。
②无水 产品的纯度为
产品的纯度为___________ 。
 可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是
可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是 和
和 等)和焦炭制备,流程如下:
等)和焦炭制备,流程如下: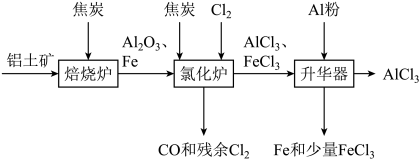
 、
、 分别在178℃,316℃时升华。
分别在178℃,316℃时升华。(1)氯化炉中
 、
、 和焦炭在高温下发生反应的化学方程式为
和焦炭在高温下发生反应的化学方程式为 可用NaOH溶液吸收,其离子方程式为
可用NaOH溶液吸收,其离子方程式为(2)700℃时,升华器中物质经充分反应后需降温实现
 和
和 的分离。请选择合适的温度范围:(填字母)
的分离。请选择合适的温度范围:(填字母)A.低于178℃ B.介于178℃和316℃之间 C.高于316℃
(3)升华器中发生反应的基本反应类型是
(4)为测定制得的无水
 产品(含杂质
产品(含杂质 )的纯度,称取16.25g无水
)的纯度,称取16.25g无水 样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.16g。
样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.16g。①上述除杂过程中涉及的离子方程式为
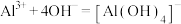 、
、②无水
 产品的纯度为
产品的纯度为
您最近半年使用:0次
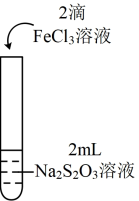
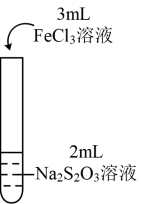
6 . 为探究 能否氧化
能否氧化 ,某兴趣小组用0.1
,某兴趣小组用0.1 的
的 溶液(pH≈7)和0.1
溶液(pH≈7)和0.1 的
的 溶液(pH≈1)进行如下操作并记录现象。
溶液(pH≈1)进行如下操作并记录现象。
已知:
① (紫色)
(紫色)
② 遇
遇 无明显现象
无明显现象
③ 能显著减慢
能显著减慢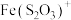 的紫色褪去
的紫色褪去
④在水溶液中 能自发的发生反应
能自发的发生反应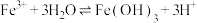
(1)分析实验Ⅰ:若向紫色溶液中加入酸,会使体系Ⅰ中___________ (填离子符号)浓度增大,导致 平衡
平衡___________ (填“正向”或“逆向”)移动;出现淡黄色浑浊是因为 与
与 发生了反应,该反应的离子方程式为
发生了反应,该反应的离子方程式为___________ 。
(2)分析实验Ⅱ:溶液紫色褪去,是因为 被
被___________ (填“氧化”或“还原”)生成 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(3)实验Ⅰ中出现淡黄色浑浊,而实验Ⅱ中未出现淡黄色浑浊的原因是___________ 。
 能否氧化
能否氧化 ,某兴趣小组用0.1
,某兴趣小组用0.1 的
的 溶液(pH≈7)和0.1
溶液(pH≈7)和0.1 的
的 溶液(pH≈1)进行如下操作并记录现象。
溶液(pH≈1)进行如下操作并记录现象。已知:
①
 (紫色)
(紫色)②
 遇
遇 无明显现象
无明显现象③
 能显著减慢
能显著减慢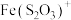 的紫色褪去
的紫色褪去④在水溶液中
 能自发的发生反应
能自发的发生反应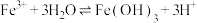
| 实验编号 | Ⅰ | Ⅱ |
| 实验操作 |
|
|
| 实验现象 | 溶液呈紫色,静置后紫色迅速褪去,久置后出现淡黄色浑浊 | 溶液呈紫色,静置后紫色较快褪去,久置后未出现淡黄色浑浊 |
(1)分析实验Ⅰ:若向紫色溶液中加入酸,会使体系Ⅰ中
 平衡
平衡 与
与 发生了反应,该反应的离子方程式为
发生了反应,该反应的离子方程式为(2)分析实验Ⅱ:溶液紫色褪去,是因为
 被
被 ,该反应的离子方程式为
,该反应的离子方程式为(3)实验Ⅰ中出现淡黄色浑浊,而实验Ⅱ中未出现淡黄色浑浊的原因是
您最近半年使用:0次
解题方法
7 .  在现代工业生产中应用广泛,查阅资料得:无水
在现代工业生产中应用广泛,查阅资料得:无水 在空气中易潮解,加热易升华。
在空气中易潮解,加热易升华。
(1)用丁达尔效应鉴别 胶体和
胶体和 溶液的操作是
溶液的操作是____________ (写出具体实验操作、结论)。
(2)电子工业中用 溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出
溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:__________________ 。该反应的还原剂是______ 。
(3)硫化氢( )是一种有毒的气体,可用
)是一种有毒的气体,可用 溶液吸收,生成单质硫(S)沉淀。
溶液吸收,生成单质硫(S)沉淀。 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为____________ 。该反应中氧化产物与还原产物的物质的量之比为______ 。
(4)某小组同学设计了制备无水) 的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
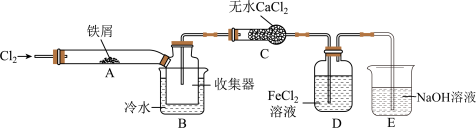
步骤Ⅰ.检验装置的气密性;
步骤Ⅱ.通入干燥的 ,赶尽装置中的空气;
,赶尽装置中的空气;
步骤Ⅲ.用酒精灯在铁屑下方加热至反应完成;
步骤Ⅳ.体系冷却后,停止通入 ,并用干燥的
,并用干燥的 赶尽
赶尽 ,将收集器密封。
,将收集器密封。
①装置A中发生反应的化学方程式为__________________ 。
②装置B中冷水浴的作用为____________ 。
 在现代工业生产中应用广泛,查阅资料得:无水
在现代工业生产中应用广泛,查阅资料得:无水 在空气中易潮解,加热易升华。
在空气中易潮解,加热易升华。(1)用丁达尔效应鉴别
 胶体和
胶体和 溶液的操作是
溶液的操作是(2)电子工业中用
 溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出
溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:(3)硫化氢(
 )是一种有毒的气体,可用
)是一种有毒的气体,可用 溶液吸收,生成单质硫(S)沉淀。
溶液吸收,生成单质硫(S)沉淀。 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为(4)某小组同学设计了制备无水)
 的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
步骤Ⅰ.检验装置的气密性;
步骤Ⅱ.通入干燥的
 ,赶尽装置中的空气;
,赶尽装置中的空气;步骤Ⅲ.用酒精灯在铁屑下方加热至反应完成;
步骤Ⅳ.体系冷却后,停止通入
 ,并用干燥的
,并用干燥的 赶尽
赶尽 ,将收集器密封。
,将收集器密封。①装置A中发生反应的化学方程式为
②装置B中冷水浴的作用为
您最近半年使用:0次
解题方法
8 . 某消毒液的主要成分为NaClO,还含有一定量的NaCl和NaOH。下列用来解释事实的离子方程式不合理的是
A.该消毒液可用NaOH溶液吸收 来制备: 来制备: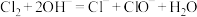 |
B.HClO的酸性弱于 : :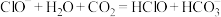 |
C.该消毒液与洁厕灵(主要成分为HCl)混用会产生有毒的 : : |
D.该消毒液加白醋会生成HClO,可增强漂白作用: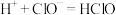 |
您最近半年使用:0次
解题方法
9 . 向铜屑、稀盐酸和铁盐的混合溶液中持续通入空气可制备氯化铜,其反应过程如图所示。下列说法不正确 的是
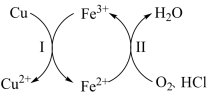

A.制备 的总反应为 的总反应为 |
B.反应Ⅰ中 作氧化剂 作氧化剂 |
C.反应Ⅱ中 作还原剂 作还原剂 |
D.还原性: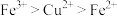 |
您最近半年使用:0次
解题方法
10 . 过氧化氢(H2O2,俗名为双氧水)、过氧化银(Ag2O2)广泛应用于抗菌消毒和化学能源等领域。


(1)根据下列三个反应回答问题:
反应Ⅰ.Ag2O+H2O2=2Ag+O2↑+H2O
反应Ⅱ.2H2O2=2H2O+O2↑
反应Ⅲ.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
①从氧化还原反应角度分析,反应Ⅰ中H2O2表现的性质为_____ 。
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序为_____ 。
③某强酸反应体系中发生一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、Mn 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:_____ 。
(2)过氧化银(Ag2O2)为活性物质,可用作新型电池材料。用NaClO-NaOH溶液氧化AgNO3,能制得高纯度的纳米级Ag2O2.
①NaClO中Cl的化合价为_____ ,Ag2O2中O的化合价为_____ 。
②写出上述反应的化学方程式:_____ 。


(1)根据下列三个反应回答问题:
反应Ⅰ.Ag2O+H2O2=2Ag+O2↑+H2O
反应Ⅱ.2H2O2=2H2O+O2↑
反应Ⅲ.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
①从氧化还原反应角度分析,反应Ⅰ中H2O2表现的性质为
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序为
③某强酸反应体系中发生一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、Mn
 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:(2)过氧化银(Ag2O2)为活性物质,可用作新型电池材料。用NaClO-NaOH溶液氧化AgNO3,能制得高纯度的纳米级Ag2O2.
①NaClO中Cl的化合价为
②写出上述反应的化学方程式:
您最近半年使用:0次
2024-03-23更新
|
49次组卷
|
2卷引用:甘肃省白银市靖远县第二中学2023-2024学年高一上学期12月期末化学试题