1 . 完成下列问题。
(1)将 通入0.5mol/L
通入0.5mol/L 溶液中,一段时间后,试管中液面与空气接触部分出现红棕色气体。写出
溶液中,一段时间后,试管中液面与空气接触部分出现红棕色气体。写出 与
与 反应的离子方程式
反应的离子方程式___________ 。
(2)NSR( 的储存和还原在不同时段交替进行)技术可有效降低稀燃柴油和汽油发动机尾气中
的储存和还原在不同时段交替进行)技术可有效降低稀燃柴油和汽油发动机尾气中 的排放,其工作原理如下图。
的排放,其工作原理如下图。

储存阶段中Ba存储 后转化为
后转化为 的化学方程式是
的化学方程式是___________ 。
(3) 的吸收与利用:
的吸收与利用:
利用太阳能,以 为原料制取炭黑的流程如下图所示。过程2的化学方程式是
为原料制取炭黑的流程如下图所示。过程2的化学方程式是___________ 。

(4)已知: 的还原产物是
的还原产物是
 酸性溶液与
酸性溶液与 反应的离子方程式是
反应的离子方程式是___________ 。
(5)以海绵铜(CuO、Cu)为原料制备氯化亚铜(CuCl)的一种工艺流程如下

“沉淀”过程中产生CuCl的离子方程式是___________ 。
(1)将
 通入0.5mol/L
通入0.5mol/L 溶液中,一段时间后,试管中液面与空气接触部分出现红棕色气体。写出
溶液中,一段时间后,试管中液面与空气接触部分出现红棕色气体。写出 与
与 反应的离子方程式
反应的离子方程式(2)NSR(
 的储存和还原在不同时段交替进行)技术可有效降低稀燃柴油和汽油发动机尾气中
的储存和还原在不同时段交替进行)技术可有效降低稀燃柴油和汽油发动机尾气中 的排放,其工作原理如下图。
的排放,其工作原理如下图。
储存阶段中Ba存储
 后转化为
后转化为 的化学方程式是
的化学方程式是(3)
 的吸收与利用:
的吸收与利用:利用太阳能,以
 为原料制取炭黑的流程如下图所示。过程2的化学方程式是
为原料制取炭黑的流程如下图所示。过程2的化学方程式是
(4)已知:
 的还原产物是
的还原产物是
 酸性溶液与
酸性溶液与 反应的离子方程式是
反应的离子方程式是(5)以海绵铜(CuO、Cu)为原料制备氯化亚铜(CuCl)的一种工艺流程如下

“沉淀”过程中产生CuCl的离子方程式是
您最近一年使用:0次
名校
解题方法
2 . 铬及其化合物在催化、金属防腐等方面具有重要应用。
(1)催化剂 可由
可由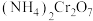 加热分解制备,反应同时生成无污染气体。
加热分解制备,反应同时生成无污染气体。

图1
①完成化学方程式:_____ 。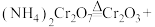 _____
_____ _____。
_____。
② 催化丙烷脱氢过程中,部分反应历程如图1,
催化丙烷脱氢过程中,部分反应历程如图1, 过程的焓变为
过程的焓变为_____ 。(列式表示)
③ 可用于
可用于 的催化氧化。设计从
的催化氧化。设计从 出发经过3步反应制备
出发经过3步反应制备 的路线
的路线_____ (用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为_____ 。
(2) 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(ⅰ)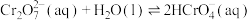
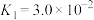 (25℃﹚
(25℃﹚
(ⅱ)
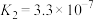 (25℃)
(25℃)
①下列有关 溶液的说法正确的有
溶液的说法正确的有_____ 。
A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量 固体,平衡时
固体,平衡时 与
与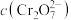 的比值保持不变
的比值保持不变
②在稀溶液中,一种物质对光的吸收程度(A)与其所吸收光的波长( )有关,在一定波长范围内,最大A对应的波长(
)有关,在一定波长范围内,最大A对应的波长(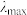 )取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究pH对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、pH不同的
)取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究pH对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、pH不同的 稀溶液,测得其A随λ的变化曲线如下图。波长
稀溶液,测得其A随λ的变化曲线如下图。波长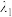 、
、 和
和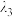 中,与
中,与 的
的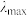 最接近的是
最接近的是_____ ,溶液pH从a变到b的过程中,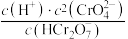 的值
的值_____ (填“增大”“减小”或“不变”)。

(1)催化剂
 可由
可由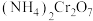 加热分解制备,反应同时生成无污染气体。
加热分解制备,反应同时生成无污染气体。
图1
①完成化学方程式:
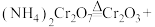 _____
_____ _____。
_____。②
 催化丙烷脱氢过程中,部分反应历程如图1,
催化丙烷脱氢过程中,部分反应历程如图1, 过程的焓变为
过程的焓变为③
 可用于
可用于 的催化氧化。设计从
的催化氧化。设计从 出发经过3步反应制备
出发经过3步反应制备 的路线
的路线(2)
 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:(ⅰ)
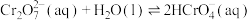
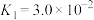 (25℃﹚
(25℃﹚(ⅱ)

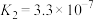 (25℃)
(25℃)①下列有关
 溶液的说法正确的有
溶液的说法正确的有A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量
 固体,平衡时
固体,平衡时 与
与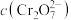 的比值保持不变
的比值保持不变②在稀溶液中,一种物质对光的吸收程度(A)与其所吸收光的波长(
 )有关,在一定波长范围内,最大A对应的波长(
)有关,在一定波长范围内,最大A对应的波长(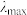 )取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究pH对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、pH不同的
)取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究pH对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、pH不同的 稀溶液,测得其A随λ的变化曲线如下图。波长
稀溶液,测得其A随λ的变化曲线如下图。波长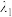 、
、 和
和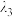 中,与
中,与 的
的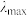 最接近的是
最接近的是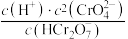 的值
的值
您最近一年使用:0次
名校
解题方法
3 . 某小组在探究 性质的实验中观察到异常现象。
性质的实验中观察到异常现象。
资料:i. (红色),
(红色), 中S元素的化合价为-2价
中S元素的化合价为-2价
ii. 是不溶于盐酸的白色沉淀
是不溶于盐酸的白色沉淀
(1)实验I体现了 的
的______ 性,补全 与
与 酸性溶液反应的离子方程式:
酸性溶液反应的离子方程式:______ 。
______ ______
______ ______
______ ______
______ ______
______
(2)探究“红色褪去”的原因,进行实验II:将褪色后的溶液分三份分别进行实验。

实验II得出的结论是:红色褪去的原因是______ 。
(3)为进一步探究“红色褪去”的原因,进行了实验III.
分析上述三个实验,下列叙述正确的是______(填字母)。
(4)上述实验探究过程用到的实验方法有______ (写出一条)。
(5)验证 性质的实验还可以选用
性质的实验还可以选用 溶液和酸化的
溶液和酸化的 溶液,二者发生反应的离子方程式是:
溶液,二者发生反应的离子方程式是:______ 。
 性质的实验中观察到异常现象。
性质的实验中观察到异常现象。| 实验I | 现象 |
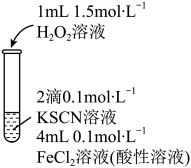 | 溶液变红,片刻红色褪去,有气体生成(经检验为 )。 )。 |
 (红色),
(红色), 中S元素的化合价为-2价
中S元素的化合价为-2价ii.
 是不溶于盐酸的白色沉淀
是不溶于盐酸的白色沉淀(1)实验I体现了
 的
的 与
与 酸性溶液反应的离子方程式:
酸性溶液反应的离子方程式:______
 ______
______ ______
______ ______
______ ______
______
(2)探究“红色褪去”的原因,进行实验II:将褪色后的溶液分三份分别进行实验。

实验II得出的结论是:红色褪去的原因是
(3)为进一步探究“红色褪去”的原因,进行了实验III.
| 实验III | 现象 |
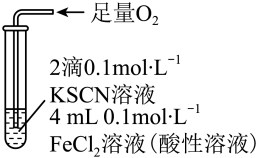 | 溶液变红,一段时间后不褪色。 |
取上述反应后的溶液,滴加盐酸和 溶液 溶液 | 无白色沉淀产生。 |
A.实验III中发生了氧化还原反应: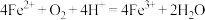 |
B.通过实验III推出实验I中氧化 的只有 的只有 |
C. 在该实验条件下不能使红色溶液褪色 在该实验条件下不能使红色溶液褪色 |
D.实验I中红色褪去与 的氧化性有关 的氧化性有关 |
(5)验证
 性质的实验还可以选用
性质的实验还可以选用 溶液和酸化的
溶液和酸化的 溶液,二者发生反应的离子方程式是:
溶液,二者发生反应的离子方程式是:
您最近一年使用:0次
4 . 某化学实验小组用酸性KMnO4溶液和草酸(H2C2O4)溶液反应,研究外界条件对化学反应速率的影响,实验操作及现象如下:
(1)补全高锰酸钾与草酸反应的离子方程式:____________________
5H2C2O4 + 2 +______= 2Mn2+ + _____ + 8H2O
+______= 2Mn2+ + _____ + 8H2O
(2)由实验I、II可得出的结论是___________ 。
(3)关于实验II中80 s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的Mn2+对反应有催化作用。利用提供的试剂设计实验III,验证猜想。
提供的试剂:0.01 mol/L酸性 KMnO4溶液,0.1 mol/L草酸溶液,3 mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水
①补全实验III的操作:向试管中先加入1 mL 0.01 mol/L酸性 KMnO4溶液,___________ ,最后加入1 mL 0.1 mol/L草酸溶液。
②若猜想成立,应观察到的实验现象是___________ 。
(4)该小组拟采用如下图所示的实验方案继续探究外界条件对反应速率的影响。

①他们拟研究的影响因素是___________ 。
②你认为他们的实验方案___________ (填“合理”或“不合理”),理由是___________ 。
| 编号 | 实验操作 | 实验现象 |
| I | 向一支试管中先加入1 mL 0.01 mol/L酸性 KMnO4溶液,再加入1滴3 mol/L硫酸和9滴蒸馏水,最后加入1 mL 0.1 mol/L草酸溶液 | 前10 min内溶液紫色无明显变化,后颜色逐渐变浅,30 min后几乎变为无色 |
| II | 向另一支试管中先加入1 mL 0.01 mol/L酸性 KMnO4溶液,再加入10滴3 mol/L硫酸,最后加入1 mL 0.1 mol/L草酸溶液 | 80 s内溶液紫色无明显变化,后颜色迅速变浅,约150 s后几乎变为无色 |
(1)补全高锰酸钾与草酸反应的离子方程式:
5H2C2O4 + 2
 +______= 2Mn2+ + _____ + 8H2O
+______= 2Mn2+ + _____ + 8H2O(2)由实验I、II可得出的结论是
(3)关于实验II中80 s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的Mn2+对反应有催化作用。利用提供的试剂设计实验III,验证猜想。
提供的试剂:0.01 mol/L酸性 KMnO4溶液,0.1 mol/L草酸溶液,3 mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水
①补全实验III的操作:向试管中先加入1 mL 0.01 mol/L酸性 KMnO4溶液,
②若猜想成立,应观察到的实验现象是
(4)该小组拟采用如下图所示的实验方案继续探究外界条件对反应速率的影响。

①他们拟研究的影响因素是
②你认为他们的实验方案
您最近一年使用:0次
名校
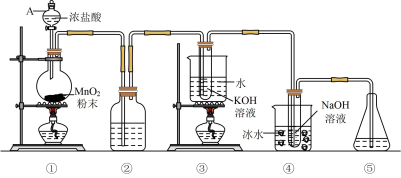
5 . 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备 和NaClO,探究其氧化还原性质。
和NaClO,探究其氧化还原性质。
已知:氯化氢极易溶于水,氯气难溶于饱和食盐水;
 难溶于水且密度比水大,
难溶于水且密度比水大, 在
在 中显紫色;
中显紫色;
氯气与碱反应时温度不同产物不同。
请回答下列问题:
(1)写出装置①制取氯气的化学方程式___________ ,其中盐酸的作用是___________ ,仪器A的名称是___________ ,其中氧化剂与还原剂物质的量之比为___________ 。
(2)装置②的作用是除去氯气中的氯化氢气体,②中的试剂为___________ 。
(3)装置③中反应的离子方程式为___________ ,反应结束后,取出③中试管,经冷却结晶,过滤,少量(冷)水洗涤,干燥,得到 晶体。
晶体。
(4)装置④中反应的离子方程式为___________ ,用单线桥标出电子转移的方向和数目。
(5)装置⑤可选用试剂___________ (填字母)。
a.NaClb. c.
c.
(6)84消毒液的有效成分是NaClO,与洁厕灵(有效成分是HCl)混用产生黄绿色气体,请写出相关的离子方程式___________ 。
(7)取少量 和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入
和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入 振荡,静置后
振荡,静置后 层显紫色,可知该条件下
层显紫色,可知该条件下 的氧化能力比NaClO
的氧化能力比NaClO___________ (填“强”或“弱”)。
 和NaClO,探究其氧化还原性质。
和NaClO,探究其氧化还原性质。
已知:氯化氢极易溶于水,氯气难溶于饱和食盐水;
 难溶于水且密度比水大,
难溶于水且密度比水大, 在
在 中显紫色;
中显紫色;氯气与碱反应时温度不同产物不同。
请回答下列问题:
(1)写出装置①制取氯气的化学方程式
(2)装置②的作用是除去氯气中的氯化氢气体,②中的试剂为
(3)装置③中反应的离子方程式为
 晶体。
晶体。(4)装置④中反应的离子方程式为
(5)装置⑤可选用试剂
a.NaClb.
 c.
c.
(6)84消毒液的有效成分是NaClO,与洁厕灵(有效成分是HCl)混用产生黄绿色气体,请写出相关的离子方程式
(7)取少量
 和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入
和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入 振荡,静置后
振荡,静置后 层显紫色,可知该条件下
层显紫色,可知该条件下 的氧化能力比NaClO
的氧化能力比NaClO
您最近一年使用:0次
名校
6 . 二氧化氯( )泡腾片由
)泡腾片由 、固体酸及辅助剂混合制得,是一种用来消毒的家庭用品。使用时只需将泡腾片放入水中,5~10分钟即可完全溶解,释放出
、固体酸及辅助剂混合制得,是一种用来消毒的家庭用品。使用时只需将泡腾片放入水中,5~10分钟即可完全溶解,释放出 。
。
注: 是一种易溶于水的气体。
是一种易溶于水的气体。

(1) 中Cl元素的化合价为
中Cl元素的化合价为___________ 。
(2)反应a:
请配平上述方程式___________ ,其中氧化剂与还原剂物质的量之比为___________ 。
(3)二氧化氯泡腾片使用时需要加水,水的作用是___________ 。
 )泡腾片由
)泡腾片由 、固体酸及辅助剂混合制得,是一种用来消毒的家庭用品。使用时只需将泡腾片放入水中,5~10分钟即可完全溶解,释放出
、固体酸及辅助剂混合制得,是一种用来消毒的家庭用品。使用时只需将泡腾片放入水中,5~10分钟即可完全溶解,释放出 。
。注:
 是一种易溶于水的气体。
是一种易溶于水的气体。
(1)
 中Cl元素的化合价为
中Cl元素的化合价为(2)反应a:

请配平上述方程式
(3)二氧化氯泡腾片使用时需要加水,水的作用是
您最近一年使用:0次
7 . 过氧化钙常温常压下为固体,微溶于水,过氧化钙不通过金属钙来制备。一种制备过氧化钙的方法是在10℃左右向一定量的氧化钙滴加适量过氧化氢溶液,生成 固体。将
固体。将 固体过滤后干燥,得到无水过氧化钙,回答下列问题:
固体过滤后干燥,得到无水过氧化钙,回答下列问题:
(1)氧化钙属于___________ (填“酸性”或“碱性”)氧化物;写出题干中描述的由氧化钙制备 的化学方程式:
的化学方程式:___________ 。
(2)用题干中描述的方法制备的过氧化钙通常不纯且氧化钙和过氧化氢难以完全反应,可能的原因是___________ ;为了检测所制备过氧化钙的纯度,一种常用的方法是将已知质量的待测样品与已知质量的 在酸性溶液中完全反应,计算出待测样品所含过氧化钙的质量,在过氧化钙与
在酸性溶液中完全反应,计算出待测样品所含过氧化钙的质量,在过氧化钙与 的反应中,过氧化钙是
的反应中,过氧化钙是___________ (填“氧化剂”或“还原剂”);
(3)取少量过氧化钙固体于试管中,加热试管,用带火星的木条深入试管口,发现___________ ,说明反应生成一种无色气体;在火力发电厂的烟道气中,二氧化碳约占碳排放总量的40%,因此提高烟道气中二氧化碳的捕集效率十分必要,若在加热条件下以过氧化钙为二氧化碳吸附剂,则吸附过程中发生反应的化学方程式是___________ 。
 固体。将
固体。将 固体过滤后干燥,得到无水过氧化钙,回答下列问题:
固体过滤后干燥,得到无水过氧化钙,回答下列问题:(1)氧化钙属于
 的化学方程式:
的化学方程式:(2)用题干中描述的方法制备的过氧化钙通常不纯且氧化钙和过氧化氢难以完全反应,可能的原因是
 在酸性溶液中完全反应,计算出待测样品所含过氧化钙的质量,在过氧化钙与
在酸性溶液中完全反应,计算出待测样品所含过氧化钙的质量,在过氧化钙与 的反应中,过氧化钙是
的反应中,过氧化钙是(3)取少量过氧化钙固体于试管中,加热试管,用带火星的木条深入试管口,发现
您最近一年使用:0次
名校
解题方法
8 . 饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,某饮用水研究人员提出:在碱性条件下用铝粉将
的浓度,某饮用水研究人员提出:在碱性条件下用铝粉将 还原为
还原为 :
: 。请回答下列问题:
。请回答下列问题:
(1)请配平其化学方程式并用双线桥表示电子转移的方向和数目:___________ 。
(2)上述反应中,还原剂是___________ ,还原产物是___________ 。
(3)另一种去除污水中 的方法是在酸性污水中加入铁粉,最终生成铵根和FeO(OH),该反应的离子方程式为:
的方法是在酸性污水中加入铁粉,最终生成铵根和FeO(OH),该反应的离子方程式为:___________ 。
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,某饮用水研究人员提出:在碱性条件下用铝粉将
的浓度,某饮用水研究人员提出:在碱性条件下用铝粉将 还原为
还原为 :
: 。请回答下列问题:
。请回答下列问题:(1)请配平其化学方程式并用双线桥表示电子转移的方向和数目:
(2)上述反应中,还原剂是
(3)另一种去除污水中
 的方法是在酸性污水中加入铁粉,最终生成铵根和FeO(OH),该反应的离子方程式为:
的方法是在酸性污水中加入铁粉,最终生成铵根和FeO(OH),该反应的离子方程式为:
您最近一年使用:0次
名校
9 . 钠是一种非常活泼、具有广泛应用的金属。
(1)钠的原子结构示意图为 ,钠在反应中容易
,钠在反应中容易___________ 电子(填“得到”或“失去”)。
(2)金属钠非常活泼,通常保存在___________ 里,以隔绝空气。
(3)汽车安全气囊的气体发生剂 可由金属钠生产。某汽车安全气囊内含
可由金属钠生产。某汽车安全气囊内含 、
、 和
和 等物质。
等物质。
ⅰ.当汽车发生较严重的碰撞时,引发 分解
分解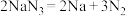 ,从而为气囊充气。产生的Na立即与
,从而为气囊充气。产生的Na立即与 发生置换反应生成
发生置换反应生成 ,化学方程式是
,化学方程式是___________ 。
ⅱ. 是冷却剂,吸收产气过程释放的热量。
是冷却剂,吸收产气过程释放的热量。 起冷却作用时发生反应的化学方程式为
起冷却作用时发生反应的化学方程式为___________ 。
ⅲ.一个安全气囊通常装有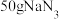 ,其完全分解所释放的
,其完全分解所释放的 为
为___________ mol。
(4)工业通过电解NaCl生产金属钠: ,过程如下:
,过程如下:

已知:电解时需要将NaCl加热至熔融状态。NaCl的熔点为801℃,为降低能耗,通常加入 从而把熔点降至约580℃。
从而把熔点降至约580℃。
①把NaCl固体加热至熔融状态,目的是___________ 。
②电解时,要避免产生的Na与 接触而重新生成NaCl。NaCl的电离方程式为
接触而重新生成NaCl。NaCl的电离方程式为___________ 。
③粗钠中含有少量杂质Ca,过程Ⅱ除去Ca的化学方程式是___________ 。
④过程Ⅰ中, 能发生像NaCl那样的电解反应而被消耗。但在过程Ⅰ中
能发生像NaCl那样的电解反应而被消耗。但在过程Ⅰ中 却不断地被重新生成,用化学方程式解释原因
却不断地被重新生成,用化学方程式解释原因___________ 。
(1)钠的原子结构示意图为
 ,钠在反应中容易
,钠在反应中容易(2)金属钠非常活泼,通常保存在
(3)汽车安全气囊的气体发生剂
 可由金属钠生产。某汽车安全气囊内含
可由金属钠生产。某汽车安全气囊内含 、
、 和
和 等物质。
等物质。ⅰ.当汽车发生较严重的碰撞时,引发
 分解
分解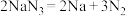 ,从而为气囊充气。产生的Na立即与
,从而为气囊充气。产生的Na立即与 发生置换反应生成
发生置换反应生成 ,化学方程式是
,化学方程式是ⅱ.
 是冷却剂,吸收产气过程释放的热量。
是冷却剂,吸收产气过程释放的热量。 起冷却作用时发生反应的化学方程式为
起冷却作用时发生反应的化学方程式为ⅲ.一个安全气囊通常装有
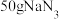 ,其完全分解所释放的
,其完全分解所释放的 为
为(4)工业通过电解NaCl生产金属钠:
 ,过程如下:
,过程如下:
已知:电解时需要将NaCl加热至熔融状态。NaCl的熔点为801℃,为降低能耗,通常加入
 从而把熔点降至约580℃。
从而把熔点降至约580℃。①把NaCl固体加热至熔融状态,目的是
②电解时,要避免产生的Na与
 接触而重新生成NaCl。NaCl的电离方程式为
接触而重新生成NaCl。NaCl的电离方程式为③粗钠中含有少量杂质Ca,过程Ⅱ除去Ca的化学方程式是
④过程Ⅰ中,
 能发生像NaCl那样的电解反应而被消耗。但在过程Ⅰ中
能发生像NaCl那样的电解反应而被消耗。但在过程Ⅰ中 却不断地被重新生成,用化学方程式解释原因
却不断地被重新生成,用化学方程式解释原因
您最近一年使用:0次
名校
10 .  是一种重要的化学品,具有广泛的应用
是一种重要的化学品,具有广泛的应用
(1) 的性质研究。
的性质研究。
①理论分析: 具有氧化性和还原性,从O元素的化合价分析原因:
具有氧化性和还原性,从O元素的化合价分析原因:_______ 。
②实验研究:向酸化的 溶液中加入
溶液中加入 溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(
溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊( ),继续加入
),继续加入 溶液,红色浑浊又变为蓝色溶液,这个过程可以反复多次。下列关于上述过程的说法
溶液,红色浑浊又变为蓝色溶液,这个过程可以反复多次。下列关于上述过程的说法不正确 的是_______ (填序号)。
A. 是
是 分解反应的催化剂
分解反应的催化剂
B. 既表现氧化性又表现还原性
既表现氧化性又表现还原性
C. 将
将 还原为
还原为
D.发生了反应
(2) 的制备。某种制取过氧化氢的方法如下:
的制备。某种制取过氧化氢的方法如下:
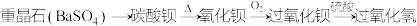
①用氧化钡制取过氧化钡(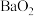 )的反应属于
)的反应属于_______ 反应(填序号)。
A.化合 B.分解 C.氧化还原 D.复分解
②用过氧化钡制取过氧化氢的离子方程式是_______ 。
③上述方法制得的过氧化氢浓度低且能耗高。有人提出下列制取过氧化氢的方案,从原理上分析合理的是_______ (填序号)。
A.在一定条件下,使用适宜的氧化剂氧化
B.在一定条件下, 还原
还原
C.在一定条件下, 氧化
氧化
(3) 的定量检测。用酸性
的定量检测。用酸性 测定
测定 的含量,反应原理如下(该条件下可忽略
的含量,反应原理如下(该条件下可忽略 的分解)。补充完整该离子方程式并配平
的分解)。补充完整该离子方程式并配平__________ 。
□ □
□ ___
___ □
□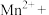 □_____
□_____
 是一种重要的化学品,具有广泛的应用
是一种重要的化学品,具有广泛的应用(1)
 的性质研究。
的性质研究。①理论分析:
 具有氧化性和还原性,从O元素的化合价分析原因:
具有氧化性和还原性,从O元素的化合价分析原因:②实验研究:向酸化的
 溶液中加入
溶液中加入 溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(
溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊( ),继续加入
),继续加入 溶液,红色浑浊又变为蓝色溶液,这个过程可以反复多次。下列关于上述过程的说法
溶液,红色浑浊又变为蓝色溶液,这个过程可以反复多次。下列关于上述过程的说法A.
 是
是 分解反应的催化剂
分解反应的催化剂B.
 既表现氧化性又表现还原性
既表现氧化性又表现还原性C.
 将
将 还原为
还原为
D.发生了反应

(2)
 的制备。某种制取过氧化氢的方法如下:
的制备。某种制取过氧化氢的方法如下: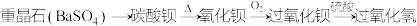
①用氧化钡制取过氧化钡(
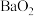 )的反应属于
)的反应属于A.化合 B.分解 C.氧化还原 D.复分解
②用过氧化钡制取过氧化氢的离子方程式是
③上述方法制得的过氧化氢浓度低且能耗高。有人提出下列制取过氧化氢的方案,从原理上分析合理的是
A.在一定条件下,使用适宜的氧化剂氧化

B.在一定条件下,
 还原
还原
C.在一定条件下,
 氧化
氧化
(3)
 的定量检测。用酸性
的定量检测。用酸性 测定
测定 的含量,反应原理如下(该条件下可忽略
的含量,反应原理如下(该条件下可忽略 的分解)。补充完整该离子方程式并配平
的分解)。补充完整该离子方程式并配平□
 □
□ ___
___ □
□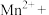 □_____
□_____
您最近一年使用:0次



