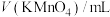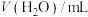名校
1 . 高铁酸钾(K2FeO4)是一种新型的污水处理剂。
(1) K2FeO4的制备
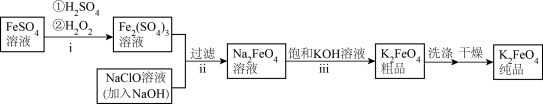
①i中反应的离子方程式是___________ 。
②将ii中反应的离子方程式补充完整:___________ 。
□ □
□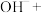 □
□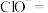 □
□ □___________
□___________ □___________
□___________
③iii中反应能够发生是因为溶解度:Na2FeO4___________ K2FeO4 (填“>”或“<”)。
(2) K2FeO4的性质
i.将K2FeO4固体溶于蒸馏水中,有少量无色气泡(O2),液体有丁达尔效应。
ii.将K2FeO4固体溶于浓KOH溶液中,放置2小时无明显变化。
iii.将K2FeO4固体溶于稀硫酸中,产生无色气泡的速率明显比ⅰ快。
①K2FeO4溶于蒸馏水的化学反应方程式是___________ 。
②K2FeO4的氧化性与溶液pH的关系是___________ 。
(3) K2FeO4的应用
K2FeO4可用于生活垃圾渗透液的脱氮(将 转化为N2)处理。K2FeO4对生活垃圾渗透液的脱氮效果随水体pH的变化结果如图所示:
转化为N2)处理。K2FeO4对生活垃圾渗透液的脱氮效果随水体pH的变化结果如图所示:

①脱氮的最佳pH约为8,pH小于8时,脱氮效果随pH减小而减弱,结合 转化为N2的氧化反应分析原因:
转化为N2的氧化反应分析原因:___________ 。
②pH大于8时,脱氮效果随pH的升高而减弱,分析可能的原因:___________ 。
(1) K2FeO4的制备

①i中反应的离子方程式是
②将ii中反应的离子方程式补充完整:
□
 □
□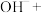 □
□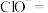 □
□ □___________
□___________ □___________
□___________③iii中反应能够发生是因为溶解度:Na2FeO4
(2) K2FeO4的性质
i.将K2FeO4固体溶于蒸馏水中,有少量无色气泡(O2),液体有丁达尔效应。
ii.将K2FeO4固体溶于浓KOH溶液中,放置2小时无明显变化。
iii.将K2FeO4固体溶于稀硫酸中,产生无色气泡的速率明显比ⅰ快。
①K2FeO4溶于蒸馏水的化学反应方程式是
②K2FeO4的氧化性与溶液pH的关系是
(3) K2FeO4的应用
K2FeO4可用于生活垃圾渗透液的脱氮(将
 转化为N2)处理。K2FeO4对生活垃圾渗透液的脱氮效果随水体pH的变化结果如图所示:
转化为N2)处理。K2FeO4对生活垃圾渗透液的脱氮效果随水体pH的变化结果如图所示:
①脱氮的最佳pH约为8,pH小于8时,脱氮效果随pH减小而减弱,结合
 转化为N2的氧化反应分析原因:
转化为N2的氧化反应分析原因:②pH大于8时,脱氮效果随pH的升高而减弱,分析可能的原因:
您最近一年使用:0次
名校
解题方法
2 . 某兴趣小组同学探究KMnO4溶液与草酸(H2C2O4)溶液反应速率的影响因素.配制1.0×10-3mol/LKMnO4溶液、0.40mol/L草酸溶液,将KMnO4溶液与草酸溶液按如下比例混合。
【设计实验】
(1)表格中
_________ ,实验①和②的目的是___________ .
(2)甲认为上述实验应控制 相同,可加入的试剂是
相同,可加入的试剂是__________ (填序号).
a.盐酸 b.硫酸 c.草酸
【实施实验】
小组同学将溶液 调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:i.紫色溶液变为青色溶液,ii.青色溶液逐渐褪至无色溶液.
调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:i.紫色溶液变为青色溶液,ii.青色溶液逐渐褪至无色溶液.
资料:(a) 在溶液中无色,在草酸中不能形成配合物;
在溶液中无色,在草酸中不能形成配合物;
(b) 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应 (青绿色)后氧化性减弱;
(青绿色)后氧化性减弱;
(c) 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。
(3)乙同学从氧化还原角度推测阶段i中可能产生了 ,你认为该观点是否合理,并说明理由:
,你认为该观点是否合理,并说明理由:____________________________ 。
【继续探究】
进一步实验证明溶液中含有 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图.
浓度随时间的变化如下图.

(4)第i阶段中检测到有 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为______________ .
(5)实验②在第ii阶段的反应速率较大,可能的原因是____________ .
(6)为了验证上述(5)中说法,设计如下实验:在第ii阶段将 调节至
调节至 ,现象是
,现象是____________ ,由此现象可证明上述猜想合理。
【结论与反思】
结论:反应可能是分阶段进行的草酸浓度的改变对不同阶段反应速率的影响可能不同。
【设计实验】
序号 |
| V(草酸)/mL |
| 反应温度/℃ |
① | 2.0 | 2.0 | 0 | 20 |
② | 2.0 | 1.0 |
| 20 |
(1)表格中

(2)甲认为上述实验应控制
 相同,可加入的试剂是
相同,可加入的试剂是a.盐酸 b.硫酸 c.草酸
【实施实验】
小组同学将溶液
 调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:i.紫色溶液变为青色溶液,ii.青色溶液逐渐褪至无色溶液.
调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:i.紫色溶液变为青色溶液,ii.青色溶液逐渐褪至无色溶液.资料:(a)
 在溶液中无色,在草酸中不能形成配合物;
在溶液中无色,在草酸中不能形成配合物;(b)
 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应 (青绿色)后氧化性减弱;
(青绿色)后氧化性减弱;(c)
 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。(3)乙同学从氧化还原角度推测阶段i中可能产生了
 ,你认为该观点是否合理,并说明理由:
,你认为该观点是否合理,并说明理由:【继续探究】
进一步实验证明溶液中含有
 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图.
浓度随时间的变化如下图.
(4)第i阶段中检测到有
 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为(5)实验②在第ii阶段的反应速率较大,可能的原因是
(6)为了验证上述(5)中说法,设计如下实验:在第ii阶段将
 调节至
调节至 ,现象是
,现象是【结论与反思】
结论:反应可能是分阶段进行的草酸浓度的改变对不同阶段反应速率的影响可能不同。
您最近一年使用:0次
名校
3 . Na2SO3应用广泛.利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下:
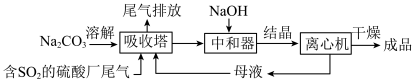
已知:① 溶液的
溶液的 约为4.7;
约为4.7;
②吸收过程中,当吸收塔中 约为5时吸收液进入中和器.
约为5时吸收液进入中和器.
(1)举例说明向大气中排放 导致的环境问题
导致的环境问题___________ .
(2)中和器中发生的主要反应的化学方程式是___________ .
(3)写出生产过程中吸收塔内发生反应的离子方程式___________ .
(4)为了促进 结晶,中和器中加入过量的
结晶,中和器中加入过量的 ,请结合化学用语,从平衡移动的角度解释
,请结合化学用语,从平衡移动的角度解释___________
(5)检验成品质量.
①取少量成品溶解,___________ ,说明成品中含 ,请补全操作与现象。
,请补全操作与现象。
②可用碘量法测定成品中 的含量,过程如下:
的含量,过程如下:
i.将 成品溶于水配成
成品溶于水配成 溶液,取
溶液,取 于碘量瓶中,并调至弱酸性;
于碘量瓶中,并调至弱酸性;
ii.加入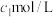 的碘标准液
的碘标准液 ,盖上瓶塞,缓慢振荡使其充分反应;
,盖上瓶塞,缓慢振荡使其充分反应;
iii.用 的
的 标准液滴定至溶液呈淡黄色时,加入
标准液滴定至溶液呈淡黄色时,加入 淀粉指示剂,继续滴定至终点,消耗
淀粉指示剂,继续滴定至终点,消耗 标准液
标准液
(已知: )
)
a.滴定终点的现象是______________
b.成品中 的质量分数是
的质量分数是______________ .

已知:①
 溶液的
溶液的 约为4.7;
约为4.7;②吸收过程中,当吸收塔中
 约为5时吸收液进入中和器.
约为5时吸收液进入中和器.(1)举例说明向大气中排放
 导致的环境问题
导致的环境问题(2)中和器中发生的主要反应的化学方程式是
(3)写出生产过程中吸收塔内发生反应的离子方程式
(4)为了促进
 结晶,中和器中加入过量的
结晶,中和器中加入过量的 ,请结合化学用语,从平衡移动的角度解释
,请结合化学用语,从平衡移动的角度解释(5)检验成品质量.
①取少量成品溶解,
 ,请补全操作与现象。
,请补全操作与现象。②可用碘量法测定成品中
 的含量,过程如下:
的含量,过程如下:i.将
 成品溶于水配成
成品溶于水配成 溶液,取
溶液,取 于碘量瓶中,并调至弱酸性;
于碘量瓶中,并调至弱酸性;ii.加入
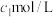 的碘标准液
的碘标准液 ,盖上瓶塞,缓慢振荡使其充分反应;
,盖上瓶塞,缓慢振荡使其充分反应;iii.用
 的
的 标准液滴定至溶液呈淡黄色时,加入
标准液滴定至溶液呈淡黄色时,加入 淀粉指示剂,继续滴定至终点,消耗
淀粉指示剂,继续滴定至终点,消耗 标准液
标准液
(已知:
 )
)a.滴定终点的现象是
b.成品中
 的质量分数是
的质量分数是
您最近一年使用:0次
名校
解题方法
4 . MnO2是重要化工原料,由软锰矿制备MnO2的一种工艺流程如下:

资料:
①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH:
③该工艺条件下,MnO2与H2SO4不反应。
(1)溶出
①溶出前,软锰矿需研磨,目的是___________ 。
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:
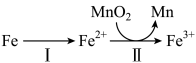
i.II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是___________ 。
ii.若I中Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2,而实际比值(0.9)小于2,原因是___________ 。
(2)纯化
已知:MnO2的氧化性与溶液pH有关。纯化时先加入MnO2后加入NH3·H2O,调溶液pH,说明试剂加入顺序及调节pH的原因:___________ 。
(3)电解
Mn2+纯化液经电解得MnO2,生成1molMnO2电子转移的数目为___________ 。
(4)产品纯度测定
向ag产品中依次加入足量bgNa2C2O4和足量稀H2SO4,如热至充分反应,生成CO2,再滴加cmol/L KMnO4溶液至剩余Na2C2O4恰好完全反应,消耗KMnO4溶液的体积为dL,产品纯度为___________ (用质量分数表示)。[已知:MnO2及 均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]

资料:
①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH:
| Fe3+ | A13+ | Mn2+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.4 | 5.8 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 7.8 | 8.3 |
(1)溶出
①溶出前,软锰矿需研磨,目的是
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:

i.II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是
ii.若I中Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2,而实际比值(0.9)小于2,原因是
(2)纯化
已知:MnO2的氧化性与溶液pH有关。纯化时先加入MnO2后加入NH3·H2O,调溶液pH,说明试剂加入顺序及调节pH的原因:
(3)电解
Mn2+纯化液经电解得MnO2,生成1molMnO2电子转移的数目为
(4)产品纯度测定
向ag产品中依次加入足量bgNa2C2O4和足量稀H2SO4,如热至充分反应,生成CO2,再滴加cmol/L KMnO4溶液至剩余Na2C2O4恰好完全反应,消耗KMnO4溶液的体积为dL,产品纯度为
 均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
您最近一年使用:0次
2023-12-15更新
|
183次组卷
|
3卷引用:北京师范大学2023--2024学年附属实验中学高一上学期化学12月统练
名校
解题方法
5 . CuCl2是一种可用于生产颜料、木材防腐剂等的化工产品。将铜粉加入稀盐酸中,并持续通入空气,在Fe3+的催化作用下可生成CuCl2 (过程如图所示)。下列说法不正确的是


| A.Fe3+可循环使用 | B.过程Ⅰ中,Fe3+的氧化性小于Cu2+ |
| C.过程Ⅱ中Fe2+发生氧化反应 | D.该过程总反应为: |
您最近一年使用:0次
2023-12-14更新
|
239次组卷
|
2卷引用:清华大学附属中学朝阳学校2023-2024学年高一上学期期中考试化学试题
名校
6 . 已知:浓硝酸和铜在常温下反应的化学方程式为: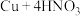 (浓)
(浓)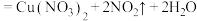 。回答下列问题:
。回答下列问题:
(1)在这个反应中,浓硝酸表现的化学性质是酸性和___________ 性(填“氧化”或“还原”)。
(2) 的电离方程式为
的电离方程式为___________ 。
(3)在离子方程式中,只有强酸、强碱和可溶性盐拆写成离子形式,该反应的离子方程式为___________ 。
(4)随着反应的进行,硝酸的浓度减小,发生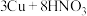 (稀)
(稀)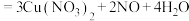 反应。在该反应中,有
反应。在该反应中,有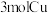 反应,有
反应,有___________ 个 转化为气体。
转化为气体。
(5)氮的氧化物有毒。用 溶液吸收的方程式为
溶液吸收的方程式为 ,该反应消耗
,该反应消耗 转移的电子数是
转移的电子数是___________  。
。
(6)用等量的铜制备 ,有三种方法:
,有三种方法:
方法一: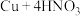 (浓)
(浓)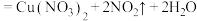
方法二: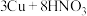 (稀)
(稀)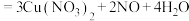
方法三: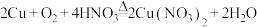
请从经济效益(硝酸根都进入硝酸铜)和社会效益(无有毒气体排放)考虑,最优方法是___________ 。
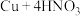 (浓)
(浓)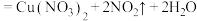 。回答下列问题:
。回答下列问题:(1)在这个反应中,浓硝酸表现的化学性质是酸性和
(2)
 的电离方程式为
的电离方程式为(3)在离子方程式中,只有强酸、强碱和可溶性盐拆写成离子形式,该反应的离子方程式为
(4)随着反应的进行,硝酸的浓度减小,发生
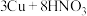 (稀)
(稀)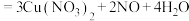 反应。在该反应中,有
反应。在该反应中,有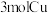 反应,有
反应,有 转化为气体。
转化为气体。(5)氮的氧化物有毒。用
 溶液吸收的方程式为
溶液吸收的方程式为 ,该反应消耗
,该反应消耗 转移的电子数是
转移的电子数是 。
。(6)用等量的铜制备
 ,有三种方法:
,有三种方法:方法一:
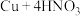 (浓)
(浓)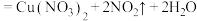
方法二:
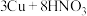 (稀)
(稀)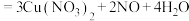
方法三:
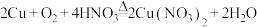
请从经济效益(硝酸根都进入硝酸铜)和社会效益(无有毒气体排放)考虑,最优方法是
您最近一年使用:0次
名校
7 . 下列解释事实的离子方程式不正确 的是
A.电解精炼铜的阴极反应: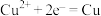 |
B.碳酸钙与醋酸反应: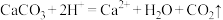 |
C.铜在潮湿空气中被腐蚀: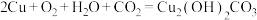 |
D. 使酸性 使酸性 溶液褪色: 溶液褪色: |
您最近一年使用:0次
名校
解题方法
8 . 某小组利用MnO2和浓HCl及如图装置制备Cl2。

(1)下列说法不正确的是______ 。
(2)该方法制氯气的离子方程式______ ;该反应中氧化剂与还原剂的物质的量之比为______ ,装置①中反应生成标准状况下氯气的体积为13.44L,则需消耗HCl的物质的量为______ mol。
(3)装置⑤的作用是______ ,发生反应的离子方程式______ 。
(4)常温下还可用Co2O3制备Cl2,反应前后共存在六种微粒:Co2O3、H2O、Cl2、H+、Cl-和Co2+,该反应的离子方程式为______ 。
(5)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO ,常用作脱氯剂,该反应的离子方程式为:
,常用作脱氯剂,该反应的离子方程式为:______ 。

(1)下列说法不正确的是
| A.①中所用装置为长颈漏斗和圆底烧瓶 |
| B.②中盛放NaOH溶液,可以除去氯气中的氯化氢气体 |
| C.③中盛放浓硫酸可以除去氯气中的水蒸气 |
| D.④是利用向上排空气法收集氯气 |
(2)该方法制氯气的离子方程式
(3)装置⑤的作用是
(4)常温下还可用Co2O3制备Cl2,反应前后共存在六种微粒:Co2O3、H2O、Cl2、H+、Cl-和Co2+,该反应的离子方程式为
(5)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO
 ,常用作脱氯剂,该反应的离子方程式为:
,常用作脱氯剂,该反应的离子方程式为:
您最近一年使用:0次
名校
9 . 通过 CO2 捕获和转化技术可实现 CO2 资源化利用,其物质转化关系如图所示。
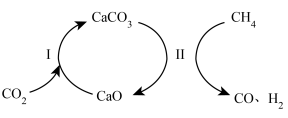
| A.过程Ⅰ属于氧化还原反应 |
| B.过程Ⅱ中的反应为CaCO3+CH4=CaO+2CO+2H2 |
| C.捕获和转化 CO2的过程中,CaO 可以循环利用 |
| D.CO2的捕获和转化有助于减弱温室效应 |
您最近一年使用:0次
2023-12-11更新
|
187次组卷
|
6卷引用:北京师范大学燕化附属中学2023-2024学年高一上学期期中考试化学试卷
名校
10 . 按要求填空:
(1)宇航员常用过氧化钠作供氧剂,写出过氧化钠与水反应的化学方程式______ ,1molNa2O2参与反应,转移电子数为______ (用NA表示阿伏加德罗常数)。
(2)自来水公司常用氯气对自来水杀菌消毒,写出该反应的离子方程式______ 。
(3)NaHCO3与NaOH反应的离子方程式为______ 。
(4)在钢铁厂生产中,炽热的铁水注入模具之前,模具必须进行充分的干燥处理,不得留有水,否则会发生爆炸事故,用化学方程式解释其中的原因______ 。
(5)向KI溶液中,滴加FeCl3溶液,溶液变棕黄色,写出反应的离子方程式______ 。
(6)实验室配制FeSO4溶液时根据需要加入一定量H2SO4,久置的FeSO4溶液发黄,原因是酸性条件下被空气氧化,离子方程式为______ 。
(1)宇航员常用过氧化钠作供氧剂,写出过氧化钠与水反应的化学方程式
(2)自来水公司常用氯气对自来水杀菌消毒,写出该反应的离子方程式
(3)NaHCO3与NaOH反应的离子方程式为
(4)在钢铁厂生产中,炽热的铁水注入模具之前,模具必须进行充分的干燥处理,不得留有水,否则会发生爆炸事故,用化学方程式解释其中的原因
(5)向KI溶液中,滴加FeCl3溶液,溶液变棕黄色,写出反应的离子方程式
(6)实验室配制FeSO4溶液时根据需要加入一定量H2SO4,久置的FeSO4溶液发黄,原因是酸性条件下被空气氧化,离子方程式为
您最近一年使用:0次