MnO2是重要化工原料,由软锰矿制备MnO2的一种工艺流程如下:

资料:
①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH:
③该工艺条件下,MnO2与H2SO4不反应。
(1)溶出
①溶出前,软锰矿需研磨,目的是___________ 。
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:
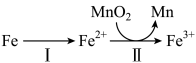
i.II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是___________ 。
ii.若I中Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2,而实际比值(0.9)小于2,原因是___________ 。
(2)纯化
已知:MnO2的氧化性与溶液pH有关。纯化时先加入MnO2后加入NH3·H2O,调溶液pH,说明试剂加入顺序及调节pH的原因:___________ 。
(3)电解
Mn2+纯化液经电解得MnO2,生成1molMnO2电子转移的数目为___________ 。
(4)产品纯度测定
向ag产品中依次加入足量bgNa2C2O4和足量稀H2SO4,如热至充分反应,生成CO2,再滴加cmol/L KMnO4溶液至剩余Na2C2O4恰好完全反应,消耗KMnO4溶液的体积为dL,产品纯度为___________ (用质量分数表示)。[已知:MnO2及 均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]

资料:
①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH:
| Fe3+ | A13+ | Mn2+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.4 | 5.8 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 7.8 | 8.3 |
(1)溶出
①溶出前,软锰矿需研磨,目的是
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:

i.II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是
ii.若I中Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2,而实际比值(0.9)小于2,原因是
(2)纯化
已知:MnO2的氧化性与溶液pH有关。纯化时先加入MnO2后加入NH3·H2O,调溶液pH,说明试剂加入顺序及调节pH的原因:
(3)电解
Mn2+纯化液经电解得MnO2,生成1molMnO2电子转移的数目为
(4)产品纯度测定
向ag产品中依次加入足量bgNa2C2O4和足量稀H2SO4,如热至充分反应,生成CO2,再滴加cmol/L KMnO4溶液至剩余Na2C2O4恰好完全反应,消耗KMnO4溶液的体积为dL,产品纯度为
 均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
更新时间:2023-12-15 14:15:17
|
相似题推荐
【推荐1】以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁的生成流程示意图:
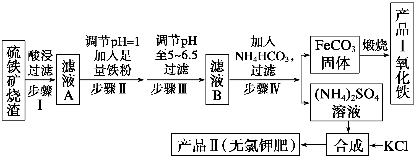
回答下列问题:
(1)酸浸使用的是稀盐酸、过滤后滤液A中的金属阳离子是_________ (写离子符号);
(2)滤液B中加入NH4HCO3溶液的离子方程式_________ ;
(3)煅烧FeCO3生成产品Ⅰ的化学反应方程式为_________ ;
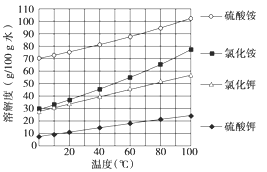
(4)已知几种盐的溶解度随温度变化的曲线如图所示,产品Ⅱ的化学式为_________ ,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是_________ 、趁热过滤、洗涤、干燥.
(5)检验产品Ⅱ晶体中是否含有少量的氯化物杂质需用到的试剂是_________ ;
(6)步骤Ⅲ中可选用_________ (填序号)试剂调节溶液的pH。
A.稀硝酸 B.双氧水 C.氨水 D.高锰酸钾溶液

回答下列问题:
(1)酸浸使用的是稀盐酸、过滤后滤液A中的金属阳离子是
(2)滤液B中加入NH4HCO3溶液的离子方程式
(3)煅烧FeCO3生成产品Ⅰ的化学反应方程式为
(4)已知几种盐的溶解度随温度变化的曲线如图所示,产品Ⅱ的化学式为

(5)检验产品Ⅱ晶体中是否含有少量的氯化物杂质需用到的试剂是
(6)步骤Ⅲ中可选用
A.稀硝酸 B.双氧水 C.氨水 D.高锰酸钾溶液
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用逾广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
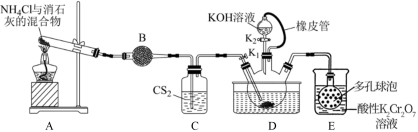
已知① 不溶于水,密度比水的大;②
不溶于水,密度比水的大;② 不于
不于 ;③硫氧化钾熔点172℃;④三颈烧瓶内盛放有
;③硫氧化钾熔点172℃;④三颈烧瓶内盛放有 、水和催化剂,回答下列问题:
、水和催化剂,回答下列问题:
Ⅰ、制餐NH4SCN溶液:
(1)实验前,检查装置气密性良好后,装入药品。装置B中的试剂是___________ ;三颈烧瓶的下层 液体必须浸没导气管口,目的是
液体必须浸没导气管口,目的是___________ 。
(2)实验开始时,打开K1,加热装置A、D.将A中产生的气体缓缓通入D中,发生反应 (该反应比较缓慢)当看到
(该反应比较缓慢)当看到___________ 现象时说明该反应接近完全。
Ⅱ、制备KSCN溶液:
(3)熄灭A处的酒精灯,关闭K1,移开水浴,将装置D继续加热至105℃,当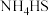 完全分解后(
完全分解后(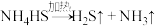 ),打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为
),打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为___________ 。
(4)装置E可用于处理尾气,多孔球泡的作用是:___________ 。已知酸性重铬酸钾溶液能将 氧化生成浅黄色沉淀,铬元素被还原为
氧化生成浅黄色沉淀,铬元素被还原为 ,写出其氧化
,写出其氧化 的离子方程式
的离子方程式___________ 。
Ⅲ、制备KSCN晶体
(5)先滤去三颈烧瓶中的固体催化剂,再在减压条件下,___________ 、过滤、洗涤、干燥,得到硫氰化钾晶体。

已知①
 不溶于水,密度比水的大;②
不溶于水,密度比水的大;② 不于
不于 ;③硫氧化钾熔点172℃;④三颈烧瓶内盛放有
;③硫氧化钾熔点172℃;④三颈烧瓶内盛放有 、水和催化剂,回答下列问题:
、水和催化剂,回答下列问题:Ⅰ、制餐NH4SCN溶液:
(1)实验前,检查装置气密性良好后,装入药品。装置B中的试剂是
 液体必须浸没导气管口,目的是
液体必须浸没导气管口,目的是(2)实验开始时,打开K1,加热装置A、D.将A中产生的气体缓缓通入D中,发生反应
 (该反应比较缓慢)当看到
(该反应比较缓慢)当看到Ⅱ、制备KSCN溶液:
(3)熄灭A处的酒精灯,关闭K1,移开水浴,将装置D继续加热至105℃,当
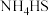 完全分解后(
完全分解后(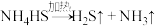 ),打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为
),打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为(4)装置E可用于处理尾气,多孔球泡的作用是:
 氧化生成浅黄色沉淀,铬元素被还原为
氧化生成浅黄色沉淀,铬元素被还原为 ,写出其氧化
,写出其氧化 的离子方程式
的离子方程式Ⅲ、制备KSCN晶体
(5)先滤去三颈烧瓶中的固体催化剂,再在减压条件下,
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
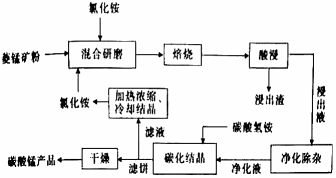
【推荐3】工业上采用氯化铵熔烧菱锰矿制备高纯碳酸锰的流程如图所示:
已知:①菱锰矿的主要成分是MnCO3,其余为Fe、Ca、Mg、Al等元素。②部分阳离子沉淀时溶液的pH;
③焙烧过程中主要反应为MnCO3+2NH4C1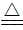 MCl2+2NH3↑+CO2↑+H2O
MCl2+2NH3↑+CO2↑+H2O
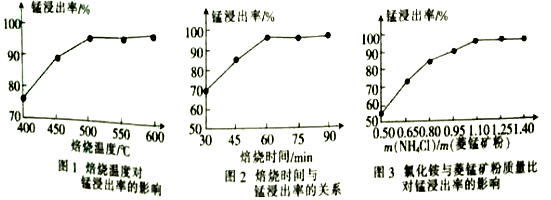
(1)合1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、c(NH4C1)/c(菱锰矿粉)分别为______ 、______ 、______ 。
(2)对浸出液净化除杂时,需先加入MnO2,作用是______ ,再调节溶液pH的最大范围为______ ,将Fe3+和Al3+变为沉淀面除去,然后加入NH4F将Ca2+、Mg2+变为氧化物沉淀除去。
(3)”碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为______ 。
(4)上述流程中可循环使用的物质是______ (填化学式)。
(5)现用滴定法测定产品中锰的含量。实验步骤:称取4.000g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnO2完全转化为[Mn(PO4)2]3-(其中NO3-转化为NO2-);加入稍过量的硫酸,发生反应NO2-+NH4+=N2↑+2H2O以除去NO2-;加入稀硫酸酸化,再加入60.00mL0.500mol•L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-;用5.00mL0.500mol•L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为______ 。
②试样中锰的质量分数为______ 。
已知:①菱锰矿的主要成分是MnCO3,其余为Fe、Ca、Mg、Al等元素。②部分阳离子沉淀时溶液的pH;
| 离子 | Al3+ | Fe3+ | Ca2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 4.1 | 2.2 | 10.6 | 8.1 | 9.1 |
| 沉淀完全的pH | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
③焙烧过程中主要反应为MnCO3+2NH4C1
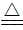 MCl2+2NH3↑+CO2↑+H2O
MCl2+2NH3↑+CO2↑+H2O(1)合1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、c(NH4C1)/c(菱锰矿粉)分别为
(2)对浸出液净化除杂时,需先加入MnO2,作用是
(3)”碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为
(4)上述流程中可循环使用的物质是
(5)现用滴定法测定产品中锰的含量。实验步骤:称取4.000g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnO2完全转化为[Mn(PO4)2]3-(其中NO3-转化为NO2-);加入稍过量的硫酸,发生反应NO2-+NH4+=N2↑+2H2O以除去NO2-;加入稀硫酸酸化,再加入60.00mL0.500mol•L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-;用5.00mL0.500mol•L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为
②试样中锰的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】工业上常采用堆浸-反萃取-电积法从低品位锌矿(主要成分为ZnS,含有FeS2、CuS、NiS、SiO2等杂质)中获得锌,其流程如图1所示。
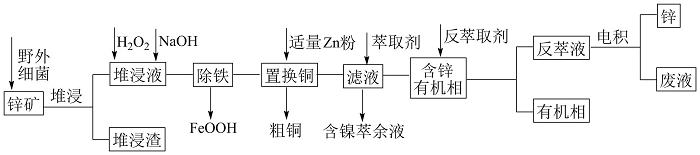
已知:①“堆浸”时金属硫化物均转化为硫酸盐;②pH过高时,氢氧化氧铁沉淀为胶状。
回答下列问题:
(1)“堆浸”时为了提高反应速率,可以采取的措施为___________ (填标号)。
a.大幅升温 b.将锌矿粉碎 c.将锌矿充分暴露
(2)“堆浸”时FeS2发生反应的化学方程式为___________ 。
(3)“除铁”时发生反应的总离子方程式为___________ 。“除铁”时,pH对不同金属离子沉淀率的影响如图2所示。“除铁”时最合理的pH约为___________ 。事实上Zn2+、Cu2+、Ni2+在pH≤6时难以沉淀,但是有铁离子存在时,pH升高,Zn2+、Cu2+、Ni2+的沉淀率均升高,原因可能为___________ 。

(4)“置换镍”时用锌粉直接置换速率极小,目前采用“锑盐净化法”置换,即置换时在酸性含Ni2+溶液中同时加入锌粉和Sb2O3,可得到合金NiSb,该反应的离子方程式为___________ 。已知Ni的熔点为1455℃,Sb的熔点为630.5℃,则该合金的熔点范围为___________ (填“高于1455℃”“在630.5℃和1455℃之间”或“低于630.5℃”)。
(5)电积时反萃取pH应控制在一定范围内,pH不能太高也不能太低,原因为___________ 。

已知:①“堆浸”时金属硫化物均转化为硫酸盐;②pH过高时,氢氧化氧铁沉淀为胶状。
回答下列问题:
(1)“堆浸”时为了提高反应速率,可以采取的措施为
a.大幅升温 b.将锌矿粉碎 c.将锌矿充分暴露
(2)“堆浸”时FeS2发生反应的化学方程式为
(3)“除铁”时发生反应的总离子方程式为

(4)“置换镍”时用锌粉直接置换速率极小,目前采用“锑盐净化法”置换,即置换时在酸性含Ni2+溶液中同时加入锌粉和Sb2O3,可得到合金NiSb,该反应的离子方程式为
(5)电积时反萃取pH应控制在一定范围内,pH不能太高也不能太低,原因为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】利用软锰矿和方铅矿(主要成分为PbS,含有 等杂质)制备
等杂质)制备 的工艺流程如图:
的工艺流程如图:
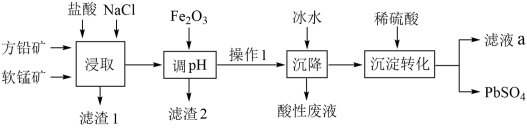
已知: ;
;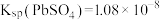 ,
,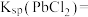
 ;
; 易溶于热水。
易溶于热水。
(1)“滤渣1”的成分是S(硫),“浸取”时被氧化的元素是_______ ,“浸取”反应的条件是_______ 。
(2)“滤渣2”的成分是_______ 。
(3)加入冰水“沉降”的离子方程式为_______ ,“酸性溶液”中的主要金属阳离子是_______ 。
(4)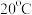 时,
时,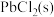 在不同浓度的盐酸中的最大溶解量(
在不同浓度的盐酸中的最大溶解量(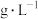 )如图所示。下列叙述正确的是
)如图所示。下列叙述正确的是_______ (填字母代号)
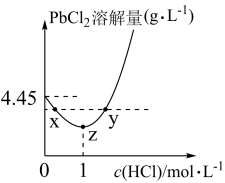
A.z→y,发生了沉淀溶解反应
B.x、y两点对应的溶液中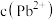 相等
相等
C.x→z, 增大使
增大使 溶解平衡逆向移动
溶解平衡逆向移动
D.盐酸浓度越小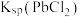 )越小
)越小
(5)“滤液a”经过处理后可以返回到_______ 工序循环使用; 经“沉淀转化”后得到
经“沉淀转化”后得到 ,当
,当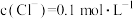 时,
时,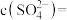
_______  。
。
 等杂质)制备
等杂质)制备 的工艺流程如图:
的工艺流程如图:
已知:
 ;
;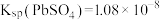 ,
,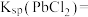
 ;
; 易溶于热水。
易溶于热水。(1)“滤渣1”的成分是S(硫),“浸取”时被氧化的元素是
(2)“滤渣2”的成分是
(3)加入冰水“沉降”的离子方程式为
(4)
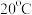 时,
时,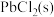 在不同浓度的盐酸中的最大溶解量(
在不同浓度的盐酸中的最大溶解量(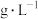 )如图所示。下列叙述正确的是
)如图所示。下列叙述正确的是
A.z→y,发生了沉淀溶解反应
B.x、y两点对应的溶液中
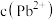 相等
相等C.x→z,
 增大使
增大使 溶解平衡逆向移动
溶解平衡逆向移动D.盐酸浓度越小
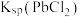 )越小
)越小(5)“滤液a”经过处理后可以返回到
 经“沉淀转化”后得到
经“沉淀转化”后得到 ,当
,当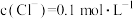 时,
时,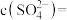
 。
。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】工业上用菱锰矿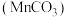 [含
[含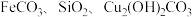 等杂质]为原料制取二氧化锰,其流程示意图如下:
等杂质]为原料制取二氧化锰,其流程示意图如下:
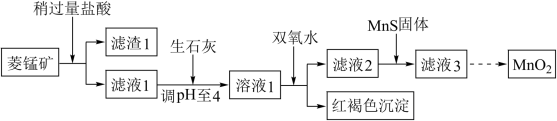
已知:生成氢氧化物沉淀的
注:金属离子的起始浓度为
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是____ 。盐酸溶解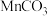 的化学方程式是
的化学方程式是_____ 。
(2)向溶液1中加入双氧水时,反应的离子方程式是____ 。
(3)滤液2中加入稍过量的难溶电解质 ,以除去
,以除去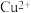 ,反应的离子方程式是
,反应的离子方程式是___________ 。
(4)将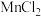 转化为
转化为 的一种方法是氧化法。用酸化的
的一种方法是氧化法。用酸化的 溶液将
溶液将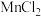 氧化生成
氧化生成 和
和 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(5)若直接电解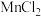 溶液,生成
溶液,生成 的同时会产生少量
的同时会产生少量 。检验
。检验 的操作是
的操作是_____ 。
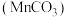 [含
[含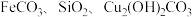 等杂质]为原料制取二氧化锰,其流程示意图如下:
等杂质]为原料制取二氧化锰,其流程示意图如下:
已知:生成氢氧化物沉淀的

 |  |  |  | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为

回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是
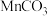 的化学方程式是
的化学方程式是(2)向溶液1中加入双氧水时,反应的离子方程式是
(3)滤液2中加入稍过量的难溶电解质
 ,以除去
,以除去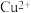 ,反应的离子方程式是
,反应的离子方程式是(4)将
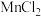 转化为
转化为 的一种方法是氧化法。用酸化的
的一种方法是氧化法。用酸化的 溶液将
溶液将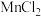 氧化生成
氧化生成 和
和 ,该反应的离子方程式为
,该反应的离子方程式为(5)若直接电解
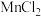 溶液,生成
溶液,生成 的同时会产生少量
的同时会产生少量 。检验
。检验 的操作是
的操作是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】合成氨是目前人工固氮最重要的途径,研究合成氨反应具有重要意义。
(1)直接常压电化学合成氨以纳米 作催化剂,
作催化剂, 和
和 为原料制备
为原料制备 。其工作原理如图所示:
。其工作原理如图所示:
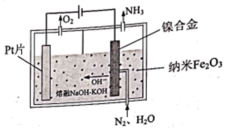
①阴极的电极反应式为______ ;阴极的镍合金制成筛网的目的是______ 。
②电解过程中,由于发生副反应,使得阴极制得的 中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是
中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是______ 。
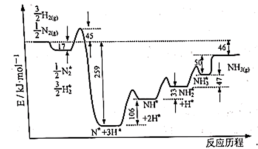
(2)一定条件下,哈伯-博施合成氨反应历程中的能量变化如图所示。合成氨反应的热化学方程式为______ 。生成 的历程中,速率最慢的反应的化学方程式为
的历程中,速率最慢的反应的化学方程式为______ 。
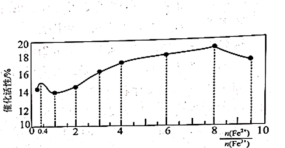
(3)科学家一直努力寻找提高合成氨效率的催化剂,一种新型高催化活性的催化剂 的催化活性与其中
的催化活性与其中 的关系如图所示,
的关系如图所示,
______ (用分数表示)。
(4) 在铁表面很容易解离成
在铁表面很容易解离成 原子,而
原子,而 在铁表面较难解离。为研究哈伯-博施合成氨反应中与
在铁表面较难解离。为研究哈伯-博施合成氨反应中与 直接反应的是
直接反应的是 还是
还是 ,德国化学家格哈德·埃特尔设计如下实验:将铁催化剂置于真空容器中,通入一定量的
,德国化学家格哈德·埃特尔设计如下实验:将铁催化剂置于真空容器中,通入一定量的 ,再向其中不断通入
,再向其中不断通入 ,同时测得催化剂表面某原子的浓度不断减小。根据实验结果他提出了反应的机理,如图所示。
,同时测得催化剂表面某原子的浓度不断减小。根据实验结果他提出了反应的机理,如图所示。
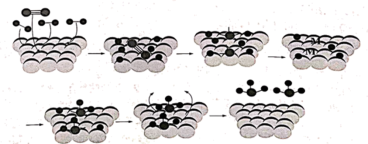
①该实验中测定的是催化剂表面______ 原子浓度的变化。
②图中 的电子式为
的电子式为______ 。
(1)直接常压电化学合成氨以纳米
 作催化剂,
作催化剂, 和
和 为原料制备
为原料制备 。其工作原理如图所示:
。其工作原理如图所示:
①阴极的电极反应式为
②电解过程中,由于发生副反应,使得阴极制得的
 中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是
中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是(2)一定条件下,哈伯-博施合成氨反应历程中的能量变化如图所示。合成氨反应的热化学方程式为
 的历程中,速率最慢的反应的化学方程式为
的历程中,速率最慢的反应的化学方程式为
(3)科学家一直努力寻找提高合成氨效率的催化剂,一种新型高催化活性的催化剂
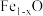 的催化活性与其中
的催化活性与其中 的关系如图所示,
的关系如图所示,

(4)
 在铁表面很容易解离成
在铁表面很容易解离成 原子,而
原子,而 在铁表面较难解离。为研究哈伯-博施合成氨反应中与
在铁表面较难解离。为研究哈伯-博施合成氨反应中与 直接反应的是
直接反应的是 还是
还是 ,德国化学家格哈德·埃特尔设计如下实验:将铁催化剂置于真空容器中,通入一定量的
,德国化学家格哈德·埃特尔设计如下实验:将铁催化剂置于真空容器中,通入一定量的 ,再向其中不断通入
,再向其中不断通入 ,同时测得催化剂表面某原子的浓度不断减小。根据实验结果他提出了反应的机理,如图所示。
,同时测得催化剂表面某原子的浓度不断减小。根据实验结果他提出了反应的机理,如图所示。
①该实验中测定的是催化剂表面
②图中
 的电子式为
的电子式为
您最近一年使用:0次
【推荐2】氨是最重要的化工原料之一,自20世纪初以来,工业上合成氨主要依赖Haber-Bosch技术。探索新的合成氨的方法一直是重要课题。
(1)最新的“人工固氮"研究报道:在常温、常压、光照条件下, N2在催化剂表面与水发生反应,直接生成氨气和氧气。已知: N2(g) + 3H2(g) 2NH3(g) △H =-a kJ/mol,2H2(g) + O2(g)= 2H2O(1) △H = -b kJ/mol,写出上述固氮反应的热化学方程式:
2NH3(g) △H =-a kJ/mol,2H2(g) + O2(g)= 2H2O(1) △H = -b kJ/mol,写出上述固氮反应的热化学方程式:____________ 。
(2)近期,两位希腊化学家提出了电解合成氨的新思路:采用高质子导电性的SCY陶瓷(能传递H+ )为介质,实现了高温(570°C)常压下高转化率的电解法合成氨,转化率可达到78% ,装置如图:
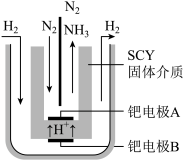
钯电极A是电解池的____ 极(填“阳”或“阴”) ,则该阴极反应式为___________
(2)恒温、恒容条件下,在容器中模拟Haber Bosch法合成氨,如下图(图中所示数据为初始物理量)。t分钟后反应达到平衡,生成的NH3为0.4 mol。
①判断该容器中的反应达平衡的依据是____ (填字母)。
a .压强不随时间改变
b .气体的密度不随时间改变
c . c(N2)不随时间改变
d .单位时间内生成2 mol NH3的同时消耗1 mol N2
e .单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下容器中反应的平衡常数K=___ ; 平衡时,混合气体压强p平=__ (用初始压强po表示)。
(1)最新的“人工固氮"研究报道:在常温、常压、光照条件下, N2在催化剂表面与水发生反应,直接生成氨气和氧气。已知: N2(g) + 3H2(g)
 2NH3(g) △H =-a kJ/mol,2H2(g) + O2(g)= 2H2O(1) △H = -b kJ/mol,写出上述固氮反应的热化学方程式:
2NH3(g) △H =-a kJ/mol,2H2(g) + O2(g)= 2H2O(1) △H = -b kJ/mol,写出上述固氮反应的热化学方程式:(2)近期,两位希腊化学家提出了电解合成氨的新思路:采用高质子导电性的SCY陶瓷(能传递H+ )为介质,实现了高温(570°C)常压下高转化率的电解法合成氨,转化率可达到78% ,装置如图:

钯电极A是电解池的
(2)恒温、恒容条件下,在容器中模拟Haber Bosch法合成氨,如下图(图中所示数据为初始物理量)。t分钟后反应达到平衡,生成的NH3为0.4 mol。
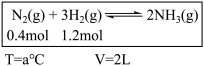
①判断该容器中的反应达平衡的依据是
a .压强不随时间改变
b .气体的密度不随时间改变
c . c(N2)不随时间改变
d .单位时间内生成2 mol NH3的同时消耗1 mol N2
e .单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下容器中反应的平衡常数K=
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】氧化铟(In2O3)用作光谱纯试剂、光电显示半导体薄膜和电子元件的材料等,铟产业被称为“信息时代的朝阳产业”。利用水铟矿[主要成分为In(OH)3]制备In2O3的工艺流程如下:
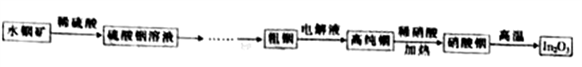
已知:常温下Ksp[In(OH)3]=1.41×10-33。
回答下列问题:
(1)In2O3中In的化合价为_________________ 。
(2)用硫酸酸浸水铟矿时发生反应的离子方程式为(杂质不参与反应)_________________ 。
(3)用硫酸从水铟矿中提取铟时,酸度与浸出率关系如图,则适宜硫酸的物质的量浓度为______ 。
(4)高纯铟与稀硝酸反应的离子方程式为_________________ 。
(5)硝酸铟高温下生成氧化铟的同时又红棕色气体产生。写出该反应的化学方程式:________ 。
(6)粗铟电解精炼为高纯铟时、阳极的电极反应为_________________ 。
(7)水铟矿溶于硫酸中得到c(In3+)=1.41mol·L-1,要使In3+不产生沉淀,计算此时溶液的pH(写出必要的计算式)___________ 。

已知:常温下Ksp[In(OH)3]=1.41×10-33。
回答下列问题:
(1)In2O3中In的化合价为
(2)用硫酸酸浸水铟矿时发生反应的离子方程式为(杂质不参与反应)
(3)用硫酸从水铟矿中提取铟时,酸度与浸出率关系如图,则适宜硫酸的物质的量浓度为

(4)高纯铟与稀硝酸反应的离子方程式为
(5)硝酸铟高温下生成氧化铟的同时又红棕色气体产生。写出该反应的化学方程式:
(6)粗铟电解精炼为高纯铟时、阳极的电极反应为
(7)水铟矿溶于硫酸中得到c(In3+)=1.41mol·L-1,要使In3+不产生沉淀,计算此时溶液的pH(写出必要的计算式)
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】实验室制备氯化亚铜(一种难溶于水的白色固体)的流程如下:

(1)“反应Ⅰ”的化学方程式为_______ 。
(2)“反应Ⅱ”中杂质与 反应的化学方程式为
反应的化学方程式为_______ 。
(3)“除铁”的离子方程式为_______ 。
(4)“反应Ⅲ”所用 由铜和浓硫酸反应制得,化学方程式为
由铜和浓硫酸反应制得,化学方程式为_______ 。_______ 。
(5)“反应Ⅲ”的离子方程式为_______ 。

(1)“反应Ⅰ”的化学方程式为
(2)“反应Ⅱ”中杂质与
 反应的化学方程式为
反应的化学方程式为(3)“除铁”的离子方程式为
(4)“反应Ⅲ”所用
 由铜和浓硫酸反应制得,化学方程式为
由铜和浓硫酸反应制得,化学方程式为(5)“反应Ⅲ”的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】纳米氮化铁(Fe6N2)是一种不溶于水的灰色粉末,常用作软磁性材料,较高温度时,暴露在空气中易释放出氨气。实验室模拟制备纳米氮化铁的步骤如下:
Ⅰ.制备纳米级氧化铁粉末向三颈烧瓶中加入0.36 mol Fe(NO3)3和0.1 mol甘氨酸,置于可控温电炉上加热,装置如图所示(甘氨酸易挥发):
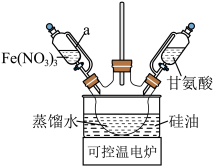
(1)装置a的名称为___________ 。
(2)混合溶液加热一段时间后,浓缩、蒸干、高温灼烧得 到纳米氧化铁粉末。
①加热一段时间的目的是___________ 。
②高温灼烧时分解制氧化铁的化学方程式为___________ 。
Ⅱ.制备纳米氮化铁
采用如图所示装置在700℃左右制备纳米氮化铁。
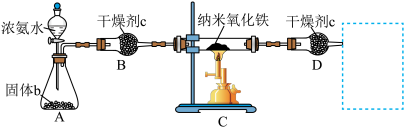
(3)固体b可以选用多种物质,固体b的最佳选项为___________
a. 熟石灰 b.二氧化锰 c.氢氧化钠 d.氯化铵
(4)干燥剂c的具体名称为___________ ,连接装置D的作用为___________ 。
(5)虚线框中最适宜的装置为___________ (选填标号)。
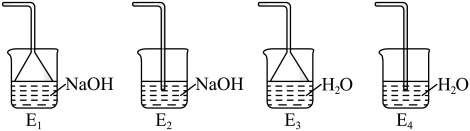
(6)氮化铁在潮湿空气中充分加热生成磁性氧化铁和氨气的化学方程式为___________ 。
Ⅰ.制备纳米级氧化铁粉末向三颈烧瓶中加入0.36 mol Fe(NO3)3和0.1 mol甘氨酸,置于可控温电炉上加热,装置如图所示(甘氨酸易挥发):

(1)装置a的名称为
(2)混合溶液加热一段时间后,浓缩、蒸干、高温灼烧得 到纳米氧化铁粉末。
①加热一段时间的目的是
②高温灼烧时分解制氧化铁的化学方程式为
Ⅱ.制备纳米氮化铁
采用如图所示装置在700℃左右制备纳米氮化铁。

(3)固体b可以选用多种物质,固体b的最佳选项为
a. 熟石灰 b.二氧化锰 c.氢氧化钠 d.氯化铵
(4)干燥剂c的具体名称为
(5)虚线框中最适宜的装置为

(6)氮化铁在潮湿空气中充分加热生成磁性氧化铁和氨气的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】重铬酸钾(K2Cr2O7)可作氧化剂,在电镀、有机合成等方面有重要应用。某化工厂以铬铁矿(主要成分是FeCr2O4,含少量Al和Si的氧化物等杂质)为主要原料制备重铬酸钾的工艺流程如图1所示。

已知:i.Ksp[Al(OH)3]=1.3×10-33;
ii.2CrO (黄色)+2H+=Cr2O
(黄色)+2H+=Cr2O (橙色)+H2O K=1.0×1014
(橙色)+H2O K=1.0×1014
回答下列问题:
(1)为提高“焙烧”速率,可采取的措施是_______ (举1例);“焙烧”过程中被氧化的元素是_______ 。
(2)矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图2所示。当溶液中可溶性组分浓度c≤1.0×10-5mol•L-1时,可认为已除尽。
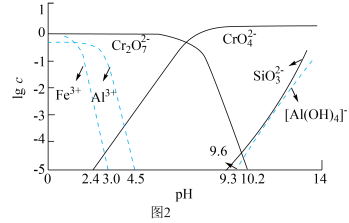
“中和”时pH的理论范围为________ ;当溶液pH=6时,溶液中c(Al3+)=_______ mol•L-1。
(3)“酸化”过程,溶液由黄色变橙色,其目的是当稀溶液pH=6(常温),c(CrO )=0.1mol•L-1时,溶液中c(Cr2O
)=0.1mol•L-1时,溶液中c(Cr2O )=
)=________ mol•L-1。
(4)“酸化”时,不能使用HCl替代H2SO4,其原因为(用离子方程式表示)________ 。

已知:i.Ksp[Al(OH)3]=1.3×10-33;
ii.2CrO
 (黄色)+2H+=Cr2O
(黄色)+2H+=Cr2O (橙色)+H2O K=1.0×1014
(橙色)+H2O K=1.0×1014回答下列问题:
(1)为提高“焙烧”速率,可采取的措施是
(2)矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图2所示。当溶液中可溶性组分浓度c≤1.0×10-5mol•L-1时,可认为已除尽。

“中和”时pH的理论范围为
(3)“酸化”过程,溶液由黄色变橙色,其目的是当稀溶液pH=6(常温),c(CrO
 )=0.1mol•L-1时,溶液中c(Cr2O
)=0.1mol•L-1时,溶液中c(Cr2O )=
)=(4)“酸化”时,不能使用HCl替代H2SO4,其原因为(用离子方程式表示)
您最近一年使用:0次



