1 . 工业上,常用以下方法处理硫化氢废气。
Ⅰ.高温热分解法,即在恒温、恒压条件下,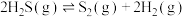
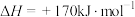
(1)下列不能 作为该反应达到平衡状态的标志的是_____。(填字母)
(2)达到平衡状态后,通入氩气,分析 平衡转化率的变化及原因
平衡转化率的变化及原因_____ 。
(3)为提高 转化率,常用
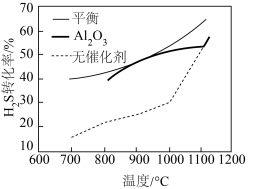
转化率,常用 作催化剂,经过相同时间测定
作催化剂,经过相同时间测定 的转化率与温度的关系如图,在
的转化率与温度的关系如图,在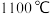 以后,有无催化剂
以后,有无催化剂 的转化率几乎相等,其原因是
的转化率几乎相等,其原因是_____ 。
II. 溶液脱除法,即将含有
溶液脱除法,即将含有 的废气通入
的废气通入 溶液中
溶液中
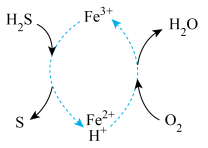
(4)脱除并再生的原理如图,写出总反应的化学方程式_____ 。
(5)如图所示,反应相同时间时,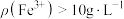 时
时 脱除率下降,推测可能的原因为
脱除率下降,推测可能的原因为_____ 。

(6)当废气中硫化氢浓度较低时,常用纯碱溶液吸收,结合表中数据计算该反应的平衡常数_____ 。
Ⅰ.高温热分解法,即在恒温、恒压条件下,
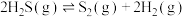
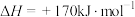
(1)下列
A. 在体系中质量分数保持不变 在体系中质量分数保持不变 |
| B.气体的平均相对分子质量不再变化 |
| C.气体密度不再变化 |
D. 的消耗速率与 的消耗速率与 的消耗速率之比为 的消耗速率之比为 |
(2)达到平衡状态后,通入氩气,分析
 平衡转化率的变化及原因
平衡转化率的变化及原因(3)为提高
 转化率,常用
转化率,常用 作催化剂,经过相同时间测定
作催化剂,经过相同时间测定 的转化率与温度的关系如图,在
的转化率与温度的关系如图,在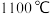 以后,有无催化剂
以后,有无催化剂 的转化率几乎相等,其原因是
的转化率几乎相等,其原因是
II.
 溶液脱除法,即将含有
溶液脱除法,即将含有 的废气通入
的废气通入 溶液中
溶液中(4)脱除并再生的原理如图,写出总反应的化学方程式

(5)如图所示,反应相同时间时,
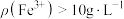 时
时 脱除率下降,推测可能的原因为
脱除率下降,推测可能的原因为
(6)当废气中硫化氢浓度较低时,常用纯碱溶液吸收,结合表中数据计算该反应的平衡常数
| 酸(常温下) |  |  |
 |  | 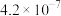 |
 | 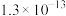 | 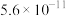 |
您最近一年使用:0次
解题方法
2 . 某学习小组对 与
与 的反应进行了研究。
的反应进行了研究。___________ 。
(2)利用如图装置完成 与
与 制取氮氧化物的反应。实验过程中可观察到装置B中液面上方为无色气体,C中液面上方为红棕色气体。
制取氮氧化物的反应。实验过程中可观察到装置B中液面上方为无色气体,C中液面上方为红棕色气体。
①为排尽整套装置内的空气,先打开弹簧夹,通入_______ (填化学式),一段时间后关闭弹簧夹。
②C中液面上方为红棕色气体,其原因是________ (用化学方程式表示)。
(3)学习小组在做铜与硝酸反应的实验时观察到了以下现象:实验Ⅰ中蓝色溶液A遇铜片立即产生气泡,而相同条件下实验Ⅱ中 硝酸遇铜片短时间内无明显变化,一段时间后才有少量气泡产生。实验操作如下:
硝酸遇铜片短时间内无明显变化,一段时间后才有少量气泡产生。实验操作如下:
①假设1:___________ (填化学式)对该反应有催化作用。
实验验证:向 硝酸中加入少量硝酸铜固体,溶液呈蓝色,放入铜片,无明显变化。
硝酸中加入少量硝酸铜固体,溶液呈蓝色,放入铜片,无明显变化。
结论:假设1不成立。
②假设2: 对该反应有催化作用。
对该反应有催化作用。
向A中鼓入 数分钟得溶液C,相同条件下,铜片与A、C溶液的反应速率:
数分钟得溶液C,相同条件下,铜片与A、C溶液的反应速率: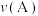
______ 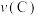 (填“
(填“ ”“
”“ ”“
”“ ”)。实验证明假设2成立。
”)。实验证明假设2成立。
③经检验,蓝色溶液A中还含有少量亚硝酸 。
。
设计实验证明 也对该反应有催化作用。操作和预期的现象是:
也对该反应有催化作用。操作和预期的现象是:___________ 。向含有铜片的溶液B中___________ 。
实验总结: 和
和 对铜与硝酸的反应都有催化作用。
对铜与硝酸的反应都有催化作用。
(4)请推测 与浓硝酸反应中
与浓硝酸反应中 和
和 参与的可能的催化过程:
参与的可能的催化过程:
①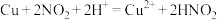 ②
②___________ 。
 与
与 的反应进行了研究。
的反应进行了研究。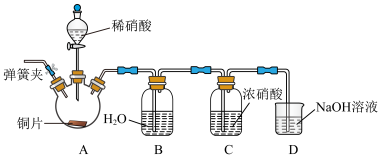
(2)利用如图装置完成
 与
与 制取氮氧化物的反应。实验过程中可观察到装置B中液面上方为无色气体,C中液面上方为红棕色气体。
制取氮氧化物的反应。实验过程中可观察到装置B中液面上方为无色气体,C中液面上方为红棕色气体。①为排尽整套装置内的空气,先打开弹簧夹,通入
②C中液面上方为红棕色气体,其原因是
(3)学习小组在做铜与硝酸反应的实验时观察到了以下现象:实验Ⅰ中蓝色溶液A遇铜片立即产生气泡,而相同条件下实验Ⅱ中
 硝酸遇铜片短时间内无明显变化,一段时间后才有少量气泡产生。实验操作如下:
硝酸遇铜片短时间内无明显变化,一段时间后才有少量气泡产生。实验操作如下:实验Ⅰ: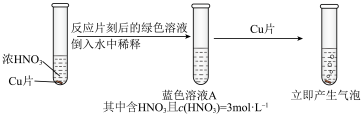
实验Ⅱ: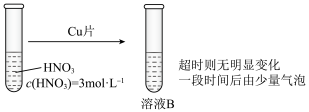
①假设1:
实验验证:向
 硝酸中加入少量硝酸铜固体,溶液呈蓝色,放入铜片,无明显变化。
硝酸中加入少量硝酸铜固体,溶液呈蓝色,放入铜片,无明显变化。结论:假设1不成立。
②假设2:
 对该反应有催化作用。
对该反应有催化作用。向A中鼓入
 数分钟得溶液C,相同条件下,铜片与A、C溶液的反应速率:
数分钟得溶液C,相同条件下,铜片与A、C溶液的反应速率: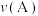
 (填“
(填“ ”“
”“ ”“
”“ ”)。实验证明假设2成立。
”)。实验证明假设2成立。③经检验,蓝色溶液A中还含有少量亚硝酸
 。
。设计实验证明
 也对该反应有催化作用。操作和预期的现象是:
也对该反应有催化作用。操作和预期的现象是:实验总结:
 和
和 对铜与硝酸的反应都有催化作用。
对铜与硝酸的反应都有催化作用。(4)请推测
 与浓硝酸反应中
与浓硝酸反应中 和
和 参与的可能的催化过程:
参与的可能的催化过程:①
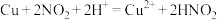 ②
②
您最近一年使用:0次
名校
解题方法
3 . 某小组探究Cu与 的反应,进行如下实验。
的反应,进行如下实验。
已知: (无色)
(无色) (白色)
(白色)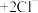
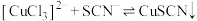 (白色)
(白色)
(1)Ⅰ、Ⅱ中,反应后的溶液均变为蓝色,推测有 生成。分别取少量反应后的溶液,滴加
生成。分别取少量反应后的溶液,滴加 溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是
溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是_______ 。
(2) 内,Cu被氧化的反应速率:Ⅰ
内,Cu被氧化的反应速率:Ⅰ_______ Ⅱ(填“>”“<”或“=”)。
(3)研究Ⅱ的反应过程,设计如下装置进行实验。不同时间取左侧烧杯中的溶液,滴加 溶液,取样时间与实验现象如下(不考虑
溶液,取样时间与实验现象如下(不考虑 的作用)。
的作用)。
经检验,白色沉淀为 。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加
。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加 溶液,溶液红色依次变浅。
溶液,溶液红色依次变浅。
① 溶液的浓度是
溶液的浓度是_______  。
。
②根据ⅰ、ⅱ中“产生白色沉淀”“溶液红色变浅”,推测Cu转化为 ,Cu与
,Cu与 溶液反应的离子方程式是
溶液反应的离子方程式是_______ 。
③由ⅲ、ⅳ可知, 后主要反应的离子方程式是
后主要反应的离子方程式是_______ 。
(4)对比Ⅰ和Ⅱ,结合ⅰ~ⅳ, 在Cu与
在Cu与 反应中的作用是
反应中的作用是_______ 。
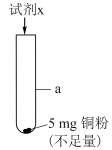
(5)研究 的浓度对铜粉溶解的影响,进行如下实验。
的浓度对铜粉溶解的影响,进行如下实验。
a中加入的试剂x为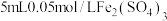 和
和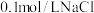 的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是
的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是 。则铜粉未完全溶解的原因是
。则铜粉未完全溶解的原因是_______ 。
 的反应,进行如下实验。
的反应,进行如下实验。已知:
 (无色)
(无色) (白色)
(白色)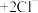
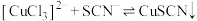 (白色)
(白色)
| 序号 | 试剂x | 实验现象 |
| Ⅰ | 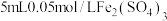 溶液 溶液 | 溶液变为浅蓝色, 时,铜粉有较多剩余 时,铜粉有较多剩余 | |
| Ⅱ | 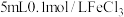 溶液 溶液 | 溶液变为蓝色, 时,铜粉完全溶解 时,铜粉完全溶解 |
(1)Ⅰ、Ⅱ中,反应后的溶液均变为蓝色,推测有
 生成。分别取少量反应后的溶液,滴加
生成。分别取少量反应后的溶液,滴加 溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是
溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是(2)
 内,Cu被氧化的反应速率:Ⅰ
内,Cu被氧化的反应速率:Ⅰ(3)研究Ⅱ的反应过程,设计如下装置进行实验。不同时间取左侧烧杯中的溶液,滴加
 溶液,取样时间与实验现象如下(不考虑
溶液,取样时间与实验现象如下(不考虑 的作用)。
的作用)。
| 序号 | 取样时间/min | 现象 |
| ⅰ | 1 | 产生白色沉淀 | |
| ⅱ | 10 | 产生白色沉淀,较 时量多 时量多 | |
| ⅲ | 30 | 产生白色沉淀,较 时量少 时量少 | |
| ⅳ | 40 | 无白色沉淀产生 |
 。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加
。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加 溶液,溶液红色依次变浅。
溶液,溶液红色依次变浅。①
 溶液的浓度是
溶液的浓度是 。
。②根据ⅰ、ⅱ中“产生白色沉淀”“溶液红色变浅”,推测Cu转化为
 ,Cu与
,Cu与 溶液反应的离子方程式是
溶液反应的离子方程式是③由ⅲ、ⅳ可知,
 后主要反应的离子方程式是
后主要反应的离子方程式是(4)对比Ⅰ和Ⅱ,结合ⅰ~ⅳ,
 在Cu与
在Cu与 反应中的作用是
反应中的作用是(5)研究
 的浓度对铜粉溶解的影响,进行如下实验。
的浓度对铜粉溶解的影响,进行如下实验。a中加入的试剂x为
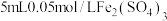 和
和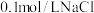 的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是
的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是 。则铜粉未完全溶解的原因是
。则铜粉未完全溶解的原因是
您最近一年使用:0次
2024-01-20更新
|
152次组卷
|
2卷引用:北京市西城区2023-2024学年高三上学期化学期末考试题
名校
解题方法
4 . 对烟气高效的脱硫、脱硝是防治空气污染的重要方式。
Ⅰ.尿素液相脱硫脱硝
(1)尿素 含有的氨基中的N原子可与
含有的氨基中的N原子可与 形成配位键,原因是
形成配位键,原因是_______ 。
(2)尿素溶液吸收烟气中的 ,生成一种正盐和
,生成一种正盐和 ,反应的化学方程式是
,反应的化学方程式是_______ 。
(3)研究发现,用尿素溶液吸收烟气中的NO时,脱除率很低。若 与尿素溶液联用,将NO转化为
与尿素溶液联用,将NO转化为 ,可大大提高NO的脱除率。
,可大大提高NO的脱除率。 与
与 溶液反应可生成两种无毒无污染的气体,反应的化学方程式是
溶液反应可生成两种无毒无污染的气体,反应的化学方程式是_______ 。
Ⅱ. 气相脱硫脱硝
气相脱硫脱硝
一定温度下,将模拟烟气通入气相氧化反应器中。NO和 的初始浓度相同,改变
的初始浓度相同,改变 的浓度,相同时间内,气体的氧化率随
的浓度,相同时间内,气体的氧化率随 与NO或
与NO或 的物质的量浓度之比的变化如图所示。其中①、④分别为NO和
的物质的量浓度之比的变化如图所示。其中①、④分别为NO和 单独通入反应器时NO、
单独通入反应器时NO、 的氧化率,②、③分别为将NO和
的氧化率,②、③分别为将NO和 同时通入反应器时NO、
同时通入反应器时NO、 的氧化率。
的氧化率。

已知:对于确定的基元反应,反应速率(v)与速率常数(k)成正比。
 气相氧化NO的关键基元反应:
气相氧化NO的关键基元反应:
基元反应1:

基元反应2:
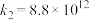
 气相氧化
气相氧化 的关键基元反应:
的关键基元反应:
基元反应3:
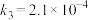
基元反应4:
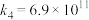
(4) 单独氧化
单独氧化 时,氧化率很低。原因是
时,氧化率很低。原因是_______ 。
(5)将 和NO同时通入气相氧化反应器中时,
和NO同时通入气相氧化反应器中时, 和NO的氧化率与将其单独通入反应器中时不同。原因分别是
和NO的氧化率与将其单独通入反应器中时不同。原因分别是_______ 。
(6)当体系中有水蒸气时, 单独氧化
单独氧化 的氧化率有很大提升。研究表明,此时
的氧化率有很大提升。研究表明,此时 被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是
被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是_______ 。
Ⅰ.尿素液相脱硫脱硝
(1)尿素
 含有的氨基中的N原子可与
含有的氨基中的N原子可与 形成配位键,原因是
形成配位键,原因是(2)尿素溶液吸收烟气中的
 ,生成一种正盐和
,生成一种正盐和 ,反应的化学方程式是
,反应的化学方程式是(3)研究发现,用尿素溶液吸收烟气中的NO时,脱除率很低。若
 与尿素溶液联用,将NO转化为
与尿素溶液联用,将NO转化为 ,可大大提高NO的脱除率。
,可大大提高NO的脱除率。 与
与 溶液反应可生成两种无毒无污染的气体,反应的化学方程式是
溶液反应可生成两种无毒无污染的气体,反应的化学方程式是Ⅱ.
 气相脱硫脱硝
气相脱硫脱硝一定温度下,将模拟烟气通入气相氧化反应器中。NO和
 的初始浓度相同,改变
的初始浓度相同,改变 的浓度,相同时间内,气体的氧化率随
的浓度,相同时间内,气体的氧化率随 与NO或
与NO或 的物质的量浓度之比的变化如图所示。其中①、④分别为NO和
的物质的量浓度之比的变化如图所示。其中①、④分别为NO和 单独通入反应器时NO、
单独通入反应器时NO、 的氧化率,②、③分别为将NO和
的氧化率,②、③分别为将NO和 同时通入反应器时NO、
同时通入反应器时NO、 的氧化率。
的氧化率。
已知:对于确定的基元反应,反应速率(v)与速率常数(k)成正比。
 气相氧化NO的关键基元反应:
气相氧化NO的关键基元反应:基元反应1:


基元反应2:

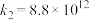
 气相氧化
气相氧化 的关键基元反应:
的关键基元反应:基元反应3:

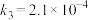
基元反应4:

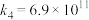
(4)
 单独氧化
单独氧化 时,氧化率很低。原因是
时,氧化率很低。原因是(5)将
 和NO同时通入气相氧化反应器中时,
和NO同时通入气相氧化反应器中时, 和NO的氧化率与将其单独通入反应器中时不同。原因分别是
和NO的氧化率与将其单独通入反应器中时不同。原因分别是(6)当体系中有水蒸气时,
 单独氧化
单独氧化 的氧化率有很大提升。研究表明,此时
的氧化率有很大提升。研究表明,此时 被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是
被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是
您最近一年使用:0次
2024-01-20更新
|
159次组卷
|
2卷引用:北京市西城区2023-2024学年高三上学期化学期末考试题
解题方法
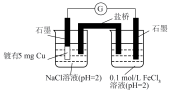
5 . 某化学小组同学对FeCl3溶液与Na2SO3溶液的反应进行探究
(1)请用离子方程式表示Na2SO3溶液显碱性的原因___________ 。
(2)甲同学认为实验①发生了氧化还原,其反应的离子方程式为___________ ,取反应后的溶液中加入K3[Fe(CN)6]溶液,观察到___________ (填现象),证实了此结论。
(3)乙同学检验红褐色沉淀为Fe(OH)3,请用平衡移动原理解释生成沉淀的原因___________ 。
(4)丙组同学检验实验②中无Fe2+,为探究此浓度下是否能发生氧化还原反应,做了如下实验:向U形管的左侧加入___________ ,观察到___________ (填实验现象),证实此浓度下的FeCl3溶液与Na2SO3溶液可以发生氧化还原反应。

(5)查阅资料已知:Fe3+、OH-、SO 可形成难电离的红色配合物:
可形成难电离的红色配合物: 。请解释实验②中无Fe2+生成的原因
。请解释实验②中无Fe2+生成的原因___________ 。
(6)通过以上探究,FeCl3溶液与Na2SO3溶液的反应受___________ 因素影响(至少写出两项)。
| 实验操作 | 现象 | |
| ① |  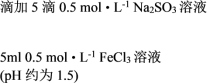 | 溶液由棕黄色变为红色,无沉淀生成。 放置6小时后,溶液变为淡黄色,始终无沉淀生成。 |
② |  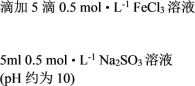 | 溶液由棕黄色变为红色,无沉淀生成。 放置6小时后,生成红褐色沉淀,上层清液为无色。 |
(1)请用离子方程式表示Na2SO3溶液显碱性的原因
(2)甲同学认为实验①发生了氧化还原,其反应的离子方程式为
(3)乙同学检验红褐色沉淀为Fe(OH)3,请用平衡移动原理解释生成沉淀的原因
(4)丙组同学检验实验②中无Fe2+,为探究此浓度下是否能发生氧化还原反应,做了如下实验:向U形管的左侧加入

(5)查阅资料已知:Fe3+、OH-、SO
 可形成难电离的红色配合物:
可形成难电离的红色配合物: 。请解释实验②中无Fe2+生成的原因
。请解释实验②中无Fe2+生成的原因(6)通过以上探究,FeCl3溶液与Na2SO3溶液的反应受
您最近一年使用:0次
6 . 工业上利用软锰矿和菱锰矿联合进行锅炉燃煤烟气脱硫,同时制备重要化工产品MnSO4,工艺流程如下:
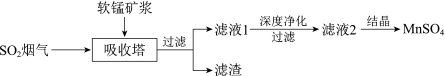
资料:i.软锰矿的主要成分是 MnO2,含少量SiO2、Fe3O4、FeO。
ⅱ.锅炉燃煤过程中空气过量。
ⅲ.该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH。
(1)吸收烟气前,软锰矿需研磨后填入吸收塔。研磨的目的是___________ 。
(2)将SO2烟气通入吸收塔中,发生的主要反应的化学方程式是___________ 。
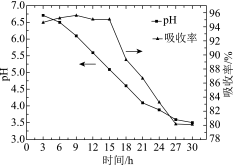
(3)软锰矿浆脱硫过程中,控制流量,每隔3 h监测一次:测定软锰矿浆的pH;同时测定吸收塔入口和出口的SO2含量,计算SO2的吸收率,结果如图所示:
①吸收塔中矿浆pH逐渐下降的原因是________ (用化学用语表示)。
②当SO2吸收率低于95%时,无法实现SO2烟气的达标排放,此时需向吸收塔中加入一定量菱锰矿(主要成分MnCO3)。下列说法中,正确的是_________ (填字母)。
a.吸收塔中吸收率下降的可能原因是pH减小抑制了SO2的溶解
b.菱锰矿调节pH升至5.0以上后,吸收率又可以恢复至95%左右
c.加入菱锰矿能增加矿浆中Mn2+的浓度
(4)经检测发现滤液1中仍含有少量Fe2+,可加入MnO2进行“深度净化”,该过程中反应的离子方程式是___________ 。
(5)产品含量测定方法如下:
I.称取a g晶体,加足量硫酸溶解,将溶液定容于100 mL容量瓶中。
Ⅱ.取25.00 mL 溶液于锥形瓶中,加入少量催化剂和过量 (NH4)2S2O8溶液,加热、充分反应后,煮沸溶液使过量的(NH4)2S2O8分解。
Ⅲ.加入指示剂,用b mol/L (NH4)2Fe(SO4)2溶液滴定,滴定至终点时消耗c mL, 重新变成Mn2+。
重新变成Mn2+。
① 补全步骤Ⅱ中反应的离子方程式:_____ ,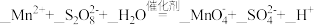 。
。
②产品中MnSO4的质量分数为________ (MnSO4的摩尔质量为151 g/mol)。

资料:i.软锰矿的主要成分是 MnO2,含少量SiO2、Fe3O4、FeO。
ⅱ.锅炉燃煤过程中空气过量。
ⅲ.该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH。
| 金属离子 | Fe3+ | Fe2+ | Mn2+ |
| 开始沉淀 | 1.5 | 6.3 | 7.6 |
| 完全沉淀 | 2.8 | 8.3 | 10.2 |
(1)吸收烟气前,软锰矿需研磨后填入吸收塔。研磨的目的是
(2)将SO2烟气通入吸收塔中,发生的主要反应的化学方程式是
(3)软锰矿浆脱硫过程中,控制流量,每隔3 h监测一次:测定软锰矿浆的pH;同时测定吸收塔入口和出口的SO2含量,计算SO2的吸收率,结果如图所示:

①吸收塔中矿浆pH逐渐下降的原因是
②当SO2吸收率低于95%时,无法实现SO2烟气的达标排放,此时需向吸收塔中加入一定量菱锰矿(主要成分MnCO3)。下列说法中,正确的是
a.吸收塔中吸收率下降的可能原因是pH减小抑制了SO2的溶解
b.菱锰矿调节pH升至5.0以上后,吸收率又可以恢复至95%左右
c.加入菱锰矿能增加矿浆中Mn2+的浓度
(4)经检测发现滤液1中仍含有少量Fe2+,可加入MnO2进行“深度净化”,该过程中反应的离子方程式是
(5)产品含量测定方法如下:
I.称取a g晶体,加足量硫酸溶解,将溶液定容于100 mL容量瓶中。
Ⅱ.取25.00 mL 溶液于锥形瓶中,加入少量催化剂和过量 (NH4)2S2O8溶液,加热、充分反应后,煮沸溶液使过量的(NH4)2S2O8分解。
Ⅲ.加入指示剂,用b mol/L (NH4)2Fe(SO4)2溶液滴定,滴定至终点时消耗c mL,
 重新变成Mn2+。
重新变成Mn2+。① 补全步骤Ⅱ中反应的离子方程式:
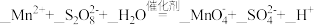 。
。②产品中MnSO4的质量分数为
您最近一年使用:0次
2024-01-19更新
|
235次组卷
|
3卷引用:北京市西城区2023-2024学年高二上学期期末考试化学试题
名校
7 . 二氧化硒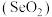 是重要的工业原料:
是重要的工业原料:
(1) 属于
属于______ (填“碱性氧化物”或“酸性氧化物”),利用这类物质的共性,饲料工业领域常用 与碱溶液反应生产亚硒酸钠
与碱溶液反应生产亚硒酸钠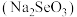 ,该反应的化学方程式为
,该反应的化学方程式为______ 。
(2) 是制备高纯硒的原料,请补全离子方程式:
是制备高纯硒的原料,请补全离子方程式:______ 。
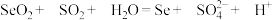
该过程是利用了 的
的______ (填“氧化性”或“还原性”)。
(3)硒元素的最高化合价为 价,预测
价,预测 有还原性,可用下列试剂中的
有还原性,可用下列试剂中的______ 检验(填字母序号)。
A. B.酸性
B.酸性 C.KI D.
C.KI D.
补全该反应的离子方程式:______ 。
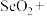 ______
______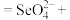 ______。
______。
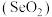 是重要的工业原料:
是重要的工业原料:(1)
 属于
属于 与碱溶液反应生产亚硒酸钠
与碱溶液反应生产亚硒酸钠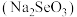 ,该反应的化学方程式为
,该反应的化学方程式为(2)
 是制备高纯硒的原料,请补全离子方程式:
是制备高纯硒的原料,请补全离子方程式: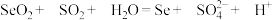
该过程是利用了
 的
的(3)硒元素的最高化合价为
 价,预测
价,预测 有还原性,可用下列试剂中的
有还原性,可用下列试剂中的A.
 B.酸性
B.酸性 C.KI D.
C.KI D.
补全该反应的离子方程式:
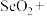 ______
______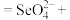 ______。
______。
您最近一年使用:0次
2024-01-18更新
|
160次组卷
|
3卷引用:北京师范大学燕化附属中学2023-2024学年高一上学期期中考试化学试卷
8 . NH3经一系列反应可以得到HNO3,如下图所示。
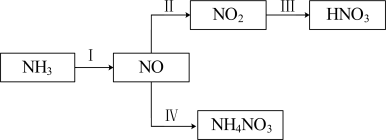
(1)I中,NH3和O2在催化剂作用下反应,其化学方程式是________ 。
(2)Ⅱ中,2NO(g)+O2 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
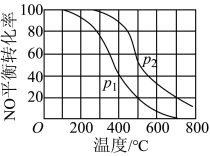
①比较P1、P2的大小关系:______ 。
②随温度升高,该反应平衡常数变化的趋势是______ 。(填“增大”、“减小”或“不变”)
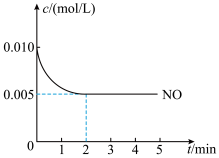
③2NO(g)+O2 2NO2(g)是制造硝酸的重要反应之一、在800℃时,向容积为1L的密闭容器中充入0.010mol NO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
2NO2(g)是制造硝酸的重要反应之一、在800℃时,向容积为1L的密闭容器中充入0.010mol NO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
a.2min内,v(O2)=________ mol/(L·min)。
b.800℃时,该反应的化学平衡常数为_______ 。
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2 (g) N2O4(g) △H1;2NO2 (g)
N2O4(g) △H1;2NO2 (g) N2O2 (l) △H2;下列能量变化示意图中,正确的是(选填字母)
N2O2 (l) △H2;下列能量变化示意图中,正确的是(选填字母) ____ 。
A. B.
B.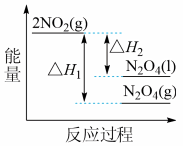 C.
C.
②N2O4与O2、H2O化合的化学方程式是____ 。
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示:
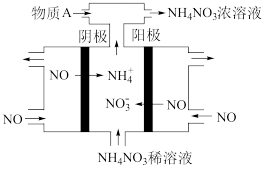
①阳极反应方程式为:___________
②为使电解产物全部转化为NH4NO3,需补充物质A,A是____ 。

(1)I中,NH3和O2在催化剂作用下反应,其化学方程式是
(2)Ⅱ中,2NO(g)+O2
 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
①比较P1、P2的大小关系:
②随温度升高,该反应平衡常数变化的趋势是
③2NO(g)+O2
 2NO2(g)是制造硝酸的重要反应之一、在800℃时,向容积为1L的密闭容器中充入0.010mol NO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
2NO2(g)是制造硝酸的重要反应之一、在800℃时,向容积为1L的密闭容器中充入0.010mol NO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。a.2min内,v(O2)=
b.800℃时,该反应的化学平衡常数为

(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2 (g)
 N2O4(g) △H1;2NO2 (g)
N2O4(g) △H1;2NO2 (g) N2O2 (l) △H2;下列能量变化示意图中,正确的是(选填字母)
N2O2 (l) △H2;下列能量变化示意图中,正确的是(选填字母) A.
 B.
B. C.
C.
②N2O4与O2、H2O化合的化学方程式是
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示:

①阳极反应方程式为:
②为使电解产物全部转化为NH4NO3,需补充物质A,A是
您最近一年使用:0次
名校
解题方法
9 . 某兴趣小组探究KIO3和Na2SO3在酸性条件下的反应,操作过程如下表:
已知:IO +5I-+6H+=3I2+3H2O。
+5I-+6H+=3I2+3H2O。
(1)针对实验现象,该小组同学提出以下猜想:
①猜想I:t秒前KIO3被Na2SO3还原生成I2,但由于溶液中存在Na2SO3,I2被消耗。将该反应离子方程式补充完整:___________
I2+SO +H2O=SO
+H2O=SO +□___________+□___________
+□___________+□___________
该条件下还原性:SO
___________ I-(填“>”“=”或“<”)。若猜想成立,向反应后的蓝色溶液中再次加入少量___________ (填试剂),蓝色迅速消失,随后再次变蓝。
②猜想Ⅱ:t秒前KIO3被Na2SO3还原为I-,无I2生成;t秒后,Na2SO3被消耗完,IO 继续与I-反应生成I2,
继续与I-反应生成I2,___________ (填现象)。
(2)该小组同学利用原电池原理进一步探究KIO3和Na2SO3的反应,实验方案如下:
①操作I中IO 在a电极放电时的还原产物是
在a电极放电时的还原产物是___________ 。
②操作Ⅱ中放电一段时间后,a电极附近溶液出现蓝色的原因可能是:
i.___________ (结合化学用语进行分析、解释)。
ii.b极区c(SO )不断减小,还原性减弱。
)不断减小,还原性减弱。
③下列说法正确的是___________ 。
a.a电极附近蓝色不再褪去,表明SO 已完全被氧化
已完全被氧化
b.操作Ⅱ中,溶液变蓝时,电流表读数变小;蓝色消失时,电流表读数又增大
c.反应结束后,向b电极附近再次滴加Na2SO3溶液,a电极附近蓝色无变化
综上所述,KIO3和Na2SO3在酸性条件下反应,IO 先被还原为I-;当Na2SO3完全反应后,IO
先被还原为I-;当Na2SO3完全反应后,IO 与I-继续反应生成I2。
与I-继续反应生成I2。
| 装置 | 操作 | 现象 |
 | 向酸化的KIO3溶液中加入2滴淀粉溶液,再加入少量Na2SO3溶液。 | 开始,无明显现象;t秒后溶液突然变为蓝色。 |
 +5I-+6H+=3I2+3H2O。
+5I-+6H+=3I2+3H2O。(1)针对实验现象,该小组同学提出以下猜想:
①猜想I:t秒前KIO3被Na2SO3还原生成I2,但由于溶液中存在Na2SO3,I2被消耗。将该反应离子方程式补充完整:
I2+SO
 +H2O=SO
+H2O=SO +□___________+□___________
+□___________+□___________该条件下还原性:SO

②猜想Ⅱ:t秒前KIO3被Na2SO3还原为I-,无I2生成;t秒后,Na2SO3被消耗完,IO
 继续与I-反应生成I2,
继续与I-反应生成I2,(2)该小组同学利用原电池原理进一步探究KIO3和Na2SO3的反应,实验方案如下:
| 装置 | 操作及现象 |
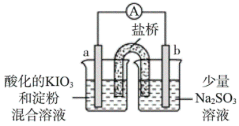 | I.开始放电时,a电极附近溶液一直未变蓝;取出a电极附近溶液于试管中,溶液变蓝。 |
| Ⅱ.放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失重复多次后,蓝色不再褪去。 | |
Ⅲ.放电后,在b电极附近溶液中检测出SO 。 。 |
 在a电极放电时的还原产物是
在a电极放电时的还原产物是②操作Ⅱ中放电一段时间后,a电极附近溶液出现蓝色的原因可能是:
i.
ii.b极区c(SO
 )不断减小,还原性减弱。
)不断减小,还原性减弱。③下列说法正确的是
a.a电极附近蓝色不再褪去,表明SO
 已完全被氧化
已完全被氧化b.操作Ⅱ中,溶液变蓝时,电流表读数变小;蓝色消失时,电流表读数又增大
c.反应结束后,向b电极附近再次滴加Na2SO3溶液,a电极附近蓝色无变化
综上所述,KIO3和Na2SO3在酸性条件下反应,IO
 先被还原为I-;当Na2SO3完全反应后,IO
先被还原为I-;当Na2SO3完全反应后,IO 与I-继续反应生成I2。
与I-继续反应生成I2。
您最近一年使用:0次
名校
10 . 阅读下面一段材料并回答问题。
(1)K2FeO4中铁元素的化合价为___________ 。
(2)制备K2FeO4需要在___________ (填“酸性”、“碱性”或“中性”)环境中进行。
(3)下列关于K2FeO4的说法中,不正确的是___________ 。
a.是强氧化性的盐
b.固体保存需要防潮
c.其消毒和净化水的原理相同
d.其净水优点有:作用快、安全性好、无异味
(4)将K2FeO4与水反应的化学方程式补充完整:___________ 。
4K2FeO4+口H2O=口Fe(OH)3(胶体)+口__________+口KOH
(5)消毒净化500m3水,至少需要K2FeO4的质量为___________ kg。[M(K2FeO4)=198g/mol]
| 高铁酸钾使用说明书 【化学式】K2FeO4 【性状]暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气 K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用 【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1L水投放5mgK2FeO4即可达到卫生标准…… |
(2)制备K2FeO4需要在
(3)下列关于K2FeO4的说法中,不正确的是
a.是强氧化性的盐
b.固体保存需要防潮
c.其消毒和净化水的原理相同
d.其净水优点有:作用快、安全性好、无异味
(4)将K2FeO4与水反应的化学方程式补充完整:
4K2FeO4+口H2O=口Fe(OH)3(胶体)+口__________+口KOH
(5)消毒净化500m3水,至少需要K2FeO4的质量为
您最近一年使用:0次
2024-01-12更新
|
168次组卷
|
4卷引用:北京师范大学2023--2024学年附属实验中学高一上学期化学12月统练