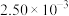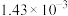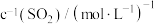名校
解题方法
1 . 某实验小组为了探究“氧化剂对 检验
检验 的影响”,进行实验1:
的影响”,进行实验1:
(1)向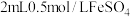 溶液中滴加1滴
溶液中滴加1滴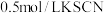 溶液,无明显现象,通入
溶液,无明显现象,通入 ,无明显变化。
,无明显变化。
①该实验的目的是_______ 。
②用离子方程式表示a中出现浅红色的原因:_______ 、_______ 。
(2)对a中溶液呈浅红色的原因,甲同学提出以下假设。
假设1:氯水加入量少,氧化 生成的
生成的 浓度低。
浓度低。
设计实验ⅰ排除了假设1:取a中浅红色溶液,操作 a ,观察到溶液浅红色消失
假设2:氯水氧化性强,氧化了部分 。
。
(已知: 与
与 可在溶液中大量共存;
可在溶液中大量共存; 易被氧化为
易被氧化为 )
)
进行实验ⅱ证明假设2成立:向 水中滴加1滴
水中滴加1滴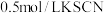 溶液,滴加1滴饱和氯水,操作b,产生白色沉淀,证明溶液里含有
溶液,滴加1滴饱和氯水,操作b,产生白色沉淀,证明溶液里含有 。
。
①操作a为_______ 。操作b是_______ 。
②补全ⅱ中 被
被 氧化的离子方程式:
氧化的离子方程式:_______ 。
_______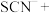 _______
_______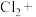 _______=_______
_______=_______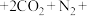 _______
_______ _______
_______
(3)乙同学针对上述实验1的现象做了进一步思考并设计了实验2,分别取上述溶液于试管中,向其中滴加一定浓度的 溶液至溶液红色褪去,同时生成白色沉淀(其成分仅为
溶液至溶液红色褪去,同时生成白色沉淀(其成分仅为 )。记录消耗
)。记录消耗 溶液的体积,实验记录如表:
溶液的体积,实验记录如表:
则由d~g可以得出的结论是_______ (答出2点)。
 检验
检验 的影响”,进行实验1:
的影响”,进行实验1:| 实验1 | 试剂 | 现象 | |
| 试管 | 滴管(各1滴) | ||
 | 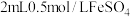 溶液与1滴 溶液与1滴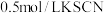 溶液 溶液 | a.饱和氯水 | 溶液立即变为浅红色 |
| b.稀硝酸 | 溶液立即变为红色 | ||
c.5% 溶液 溶液 | 溶液立即变为深红色,无气体产生 | ||
(1)向
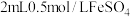 溶液中滴加1滴
溶液中滴加1滴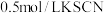 溶液,无明显现象,通入
溶液,无明显现象,通入 ,无明显变化。
,无明显变化。①该实验的目的是
②用离子方程式表示a中出现浅红色的原因:
(2)对a中溶液呈浅红色的原因,甲同学提出以下假设。
假设1:氯水加入量少,氧化
 生成的
生成的 浓度低。
浓度低。设计实验ⅰ排除了假设1:取a中浅红色溶液,
假设2:氯水氧化性强,氧化了部分
 。
。(已知:
 与
与 可在溶液中大量共存;
可在溶液中大量共存; 易被氧化为
易被氧化为 )
)进行实验ⅱ证明假设2成立:向
 水中滴加1滴
水中滴加1滴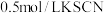 溶液,滴加1滴饱和氯水,操作b,产生白色沉淀,证明溶液里含有
溶液,滴加1滴饱和氯水,操作b,产生白色沉淀,证明溶液里含有 。
。①操作a为
②补全ⅱ中
 被
被 氧化的离子方程式:
氧化的离子方程式:_______
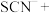 _______
_______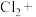 _______=_______
_______=_______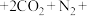 _______
_______ _______
_______(3)乙同学针对上述实验1的现象做了进一步思考并设计了实验2,分别取上述溶液于试管中,向其中滴加一定浓度的
 溶液至溶液红色褪去,同时生成白色沉淀(其成分仅为
溶液至溶液红色褪去,同时生成白色沉淀(其成分仅为 )。记录消耗
)。记录消耗 溶液的体积,实验记录如表:
溶液的体积,实验记录如表:| 实验2 | 试管 | 消耗 溶液的体积(mL) 溶液的体积(mL) |
 | d. 水与1滴 水与1滴 溶液和1滴 溶液和1滴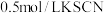 溶液 溶液 | 2.40 |
| e.实验a中溶液 | 1.52 | |
| f.实验b中溶液 | 1.60 | |
| g.实验c中溶液 | 1.84 |
您最近一年使用:0次
名校
解题方法
2 . 高效净水剂高铁酸钾 制备流程如图所示,下列离子方程式正确的是
制备流程如图所示,下列离子方程式正确的是

 制备流程如图所示,下列离子方程式正确的是
制备流程如图所示,下列离子方程式正确的是
A. 净水原理: 净水原理: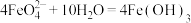 (胶体) (胶体) |
B.用 溶液吸收尾气 溶液吸收尾气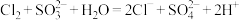 |
C.反应Ⅱ: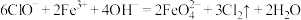 |
D.反应Ⅲ: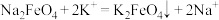 |
您最近一年使用:0次
3 . 钛(T)被称为“未来金属”,钛合金广泛应用于多个领域。
(1)工业上由钛铁矿(主要成分为 )在高温下经氯化得到
)在高温下经氯化得到 ,再制取金属钛的流程如图
,再制取金属钛的流程如图

① 元素在元素周期表的位置是
元素在元素周期表的位置是_______ 。
②基态 原子的简化电子排布式是
原子的简化电子排布式是_______ 。
③补全反应器中发生反应的化学方程式:_______ 。

④由合成器得到的粗产品是 、
、 、
、 的混合物,可采用真空蒸馏的方法分离得到
的混合物,可采用真空蒸馏的方法分离得到 。依据下表信息,加热的温度略高于
。依据下表信息,加热的温度略高于_______  即可。
即可。
(2)超高硬度生物材料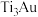 合金是理想的人工髋关节和膝关节材料,其晶体有
合金是理想的人工髋关节和膝关节材料,其晶体有 、
、 两种结构,如下图所示。
两种结构,如下图所示。

① 晶胞中,
晶胞中, 原子周围与它最近且距离相等的
原子周围与它最近且距离相等的 原子有
原子有_______ 个。
② 的晶胞边长为
的晶胞边长为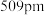 ,每个晶胞面上有两个
,每个晶胞面上有两个 原子。
原子。 晶体的密度是
晶体的密度是_______  (列出计算式)。(已知:阿伏加德罗常数为
(列出计算式)。(已知:阿伏加德罗常数为 ,
,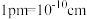 )
)
③与 晶体相比,
晶体相比, 晶体有更长的
晶体有更长的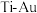 键键长。上述两种晶体中硬度较高的是
键键长。上述两种晶体中硬度较高的是_______ (填“ ”或“
”或“ ”)。
”)。
(1)工业上由钛铁矿(主要成分为
 )在高温下经氯化得到
)在高温下经氯化得到 ,再制取金属钛的流程如图
,再制取金属钛的流程如图
①
 元素在元素周期表的位置是
元素在元素周期表的位置是②基态
 原子的简化电子排布式是
原子的简化电子排布式是③补全反应器中发生反应的化学方程式:

④由合成器得到的粗产品是
 、
、 、
、 的混合物,可采用真空蒸馏的方法分离得到
的混合物,可采用真空蒸馏的方法分离得到 。依据下表信息,加热的温度略高于
。依据下表信息,加热的温度略高于 即可。
即可。 |  |  |  | |
熔点/ |  | 648.8 | 714 | 1667 |
沸点/ | 136.4 | 1090 | 1412 | 3287 |
(2)超高硬度生物材料
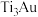 合金是理想的人工髋关节和膝关节材料,其晶体有
合金是理想的人工髋关节和膝关节材料,其晶体有 、
、 两种结构,如下图所示。
两种结构,如下图所示。
①
 晶胞中,
晶胞中, 原子周围与它最近且距离相等的
原子周围与它最近且距离相等的 原子有
原子有②
 的晶胞边长为
的晶胞边长为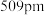 ,每个晶胞面上有两个
,每个晶胞面上有两个 原子。
原子。 晶体的密度是
晶体的密度是 (列出计算式)。(已知:阿伏加德罗常数为
(列出计算式)。(已知:阿伏加德罗常数为 ,
,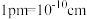 )
)③与
 晶体相比,
晶体相比, 晶体有更长的
晶体有更长的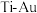 键键长。上述两种晶体中硬度较高的是
键键长。上述两种晶体中硬度较高的是 ”或“
”或“ ”)。
”)。
您最近一年使用:0次
名校
4 . 绿色植物标本用醋酸铜 处理后颜色更鲜艳、稳定。某化学小组制备醋酸铜晶体并测定产品中铜的含量,实验如下。
处理后颜色更鲜艳、稳定。某化学小组制备醋酸铜晶体并测定产品中铜的含量,实验如下。
I.醋酸铜晶体的制备
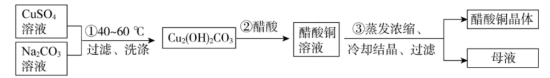
(1)①中控制温度为40-60度的原因是_______ 。
(2)②中化学方程式是_______ 。
(3)③中采用的实验方法依据醋酸铜的性质是_______ 。
Ⅱ.测定产品中铜的含量
i.取 醋酸铜产品于具塞锥形瓶中,用稀醋酸溶解,加入过量
醋酸铜产品于具塞锥形瓶中,用稀醋酸溶解,加入过量 溶液,产生
溶液,产生 沉淀,溶液呈棕黄色;
沉淀,溶液呈棕黄色;
ii.用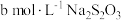 标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用
标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用 标准溶液滴定至蓝色近于消失:
标准溶液滴定至蓝色近于消失:
iii.向所得浊液中加入 溶液,充分摇动,溶液蓝色加深:
溶液,充分摇动,溶液蓝色加深:
iv.继续用 标准溶液滴定iii中浊液至终点,消耗标准溶液
标准溶液滴定iii中浊液至终点,消耗标准溶液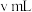 。
。
已知:① ,
, 溶液和
溶液和 溶液颜色均为无色;
溶液颜色均为无色;
②常温下,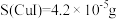
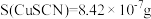
③ 易吸附
易吸附 ,
, 不吸附
不吸附 。被吸附的
。被吸附的 不与淀粉显色。
不与淀粉显色。
(4) i中发生反应的离子方程式是_______ 。
(5)结合平衡原理解释i中加入 的目的
的目的_______ 。
(6)醋酸铜产品中铜元素的质量分数是_______ 。
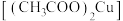 处理后颜色更鲜艳、稳定。某化学小组制备醋酸铜晶体并测定产品中铜的含量,实验如下。
处理后颜色更鲜艳、稳定。某化学小组制备醋酸铜晶体并测定产品中铜的含量,实验如下。I.醋酸铜晶体的制备

(1)①中控制温度为40-60度的原因是
(2)②中化学方程式是
(3)③中采用的实验方法依据醋酸铜的性质是
Ⅱ.测定产品中铜的含量
i.取
 醋酸铜产品于具塞锥形瓶中,用稀醋酸溶解,加入过量
醋酸铜产品于具塞锥形瓶中,用稀醋酸溶解,加入过量 溶液,产生
溶液,产生 沉淀,溶液呈棕黄色;
沉淀,溶液呈棕黄色;ii.用
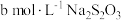 标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用
标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用 标准溶液滴定至蓝色近于消失:
标准溶液滴定至蓝色近于消失:iii.向所得浊液中加入
 溶液,充分摇动,溶液蓝色加深:
溶液,充分摇动,溶液蓝色加深:iv.继续用
 标准溶液滴定iii中浊液至终点,消耗标准溶液
标准溶液滴定iii中浊液至终点,消耗标准溶液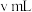 。
。已知:①
 ,
, 溶液和
溶液和 溶液颜色均为无色;
溶液颜色均为无色;②常温下,
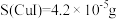
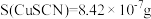
③
 易吸附
易吸附 ,
, 不吸附
不吸附 。被吸附的
。被吸附的 不与淀粉显色。
不与淀粉显色。(4) i中发生反应的离子方程式是
(5)结合平衡原理解释i中加入
 的目的
的目的(6)醋酸铜产品中铜元素的质量分数是
您最近一年使用:0次
名校
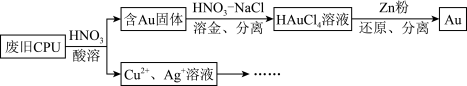
5 . 用如图方法回收废旧CPU中的单质 (金)、
(金)、 和
和 。
。 溶解。②
溶解。② :
:
(1)浓、稀 均可作酸溶试剂,溶解等量的
均可作酸溶试剂,溶解等量的 消耗
消耗 的物质的量不同,写出消耗
的物质的量不同,写出消耗 物质的量少的反应的化学方程式:
物质的量少的反应的化学方程式:________ 。
(2) 与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。
与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。
①将溶金反应的化学方程式补充完整:_____ 
②关于溶金的下列说法正确的是_____ 。
A.用到了 的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性
的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性
C.用浓盐酸与 也可使
也可使 溶解
溶解
(3)若用 粉将溶液中的
粉将溶液中的 完全还原,则参加反应的
完全还原,则参加反应的 的物质的量为
的物质的量为_____  。
。
(4)用适当浓度的盐酸、 溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收
溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收 和
和 (图中标注的试剂和物质均不同)。
(图中标注的试剂和物质均不同)。_____ ,试剂2是_________ 。
 (金)、
(金)、 和
和 。
。
 溶解。②
溶解。② :
:(1)浓、稀
 均可作酸溶试剂,溶解等量的
均可作酸溶试剂,溶解等量的 消耗
消耗 的物质的量不同,写出消耗
的物质的量不同,写出消耗 物质的量少的反应的化学方程式:
物质的量少的反应的化学方程式:(2)
 与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。
与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。①将溶金反应的化学方程式补充完整:

②关于溶金的下列说法正确的是
A.用到了
 的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性
的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性C.用浓盐酸与
 也可使
也可使 溶解
溶解(3)若用
 粉将溶液中的
粉将溶液中的 完全还原,则参加反应的
完全还原,则参加反应的 的物质的量为
的物质的量为 。
。(4)用适当浓度的盐酸、
 溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收
溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收 和
和 (图中标注的试剂和物质均不同)。
(图中标注的试剂和物质均不同)。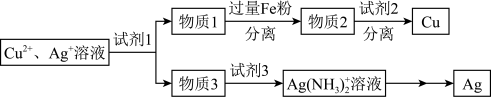
您最近一年使用:0次
名校
6 . 氨气 是一种重要的化工原料,其中约80%用来生产各种氮肥。
是一种重要的化工原料,其中约80%用来生产各种氮肥。
(1)氨气的制备
①实验室通过加热 和
和 的混合物制取氨,该反应的化学方程式为
的混合物制取氨,该反应的化学方程式为___________ 。
②工业上以氮气和氢气为原料合成氨,该反应的化学方程式为___________ 。其中氮元素的化合价___________ (填“升高”或“降低”)。
③我国科研团队借助一种固体催化剂 ,在常温、常压和可见光条件下合成了氨,其过程如图所示。该反应的化学方程式为
,在常温、常压和可见光条件下合成了氨,其过程如图所示。该反应的化学方程式为___________ 。反应中每转移 ,生成
,生成 的体积为
的体积为___________ L(标准状况下)。
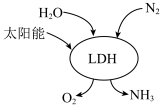
(2)氮肥的制备和应用
主要转化途径如下(转化所需试剂及条件已略去):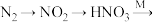 硝酸盐[如
硝酸盐[如 ]。
]。
①写出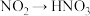 的化学方程式
的化学方程式___________ 。
②将 转化为
转化为 ,列举两种不同类别的化合物M
,列举两种不同类别的化合物M___________ (写化学式)。
③ 常作为水培植物营养液的氮肥来源,若配制
常作为水培植物营养液的氮肥来源,若配制 的
的 溶液
溶液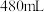 ,需要
,需要 固体的质量
固体的质量___________ g。
 是一种重要的化工原料,其中约80%用来生产各种氮肥。
是一种重要的化工原料,其中约80%用来生产各种氮肥。(1)氨气的制备
①实验室通过加热
 和
和 的混合物制取氨,该反应的化学方程式为
的混合物制取氨,该反应的化学方程式为②工业上以氮气和氢气为原料合成氨,该反应的化学方程式为
③我国科研团队借助一种固体催化剂
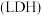 ,在常温、常压和可见光条件下合成了氨,其过程如图所示。该反应的化学方程式为
,在常温、常压和可见光条件下合成了氨,其过程如图所示。该反应的化学方程式为 ,生成
,生成 的体积为
的体积为
(2)氮肥的制备和应用
主要转化途径如下(转化所需试剂及条件已略去):
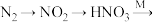 硝酸盐[如
硝酸盐[如 ]。
]。①写出
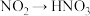 的化学方程式
的化学方程式②将
 转化为
转化为 ,列举两种不同类别的化合物M
,列举两种不同类别的化合物M③
 常作为水培植物营养液的氮肥来源,若配制
常作为水培植物营养液的氮肥来源,若配制 的
的 溶液
溶液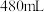 ,需要
,需要 固体的质量
固体的质量
您最近一年使用:0次
7 . 硫酸亚铁晶体( )是一种重要的无机化工原料,应用广泛。
)是一种重要的无机化工原料,应用广泛。
Ⅰ.硫酸亚铁晶体的制备
用焙烧铁矿石产生的红渣(主要成分为 ,含有少量
,含有少量 等)为原料生产硫酸亚铁晶体的工艺流程如下。
等)为原料生产硫酸亚铁晶体的工艺流程如下。
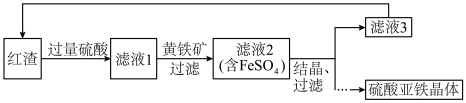
(1)红渣和硫酸发生反应的离子方程式是______ 。
(2)硫酸浸取后过滤,滤渣中含有______ (填化学式)。
(3)黄铁矿的主要成分是 ,其作用是
,其作用是______ 。
(4)流程中可循环利用的物质有______ 、 。
。
(5)若用含 的滤液3制备
的滤液3制备 ,可选用的试剂是
,可选用的试剂是______ 和______ 。
(6)产品纯度测定
已知:
取 硫酸亚铁晶体产品,用稀
硫酸亚铁晶体产品,用稀 和新煮沸过的蒸馏水溶解后,立即滴入
和新煮沸过的蒸馏水溶解后,立即滴入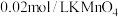 溶液至恰好完全反应,共消耗
溶液至恰好完全反应,共消耗 溶液
溶液 。
。 的质量分数是
的质量分数是______ ( 的摩尔质量是
的摩尔质量是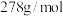 )。
)。
Ⅱ.用制备颜料铵铁蓝.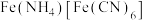
(7) 用稀
用稀 溶解后,加入
溶解后,加入 溶液和
溶液和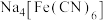 溶液,加热,产生白色沉淀
溶液,加热,产生白色沉淀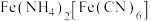 。酸性条件下再加入
。酸性条件下再加入 溶液,充分反应,得到铵铁蓝。补全离子方程式:
溶液,充分反应,得到铵铁蓝。补全离子方程式:____
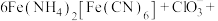 ______
______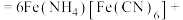 ______+______+______
______+______+______
 )是一种重要的无机化工原料,应用广泛。
)是一种重要的无机化工原料,应用广泛。Ⅰ.硫酸亚铁晶体的制备
用焙烧铁矿石产生的红渣(主要成分为
 ,含有少量
,含有少量 等)为原料生产硫酸亚铁晶体的工艺流程如下。
等)为原料生产硫酸亚铁晶体的工艺流程如下。
(1)红渣和硫酸发生反应的离子方程式是
(2)硫酸浸取后过滤,滤渣中含有
(3)黄铁矿的主要成分是
 ,其作用是
,其作用是(4)流程中可循环利用的物质有
 。
。(5)若用含
 的滤液3制备
的滤液3制备 ,可选用的试剂是
,可选用的试剂是(6)产品纯度测定
已知:

取
 硫酸亚铁晶体产品,用稀
硫酸亚铁晶体产品,用稀 和新煮沸过的蒸馏水溶解后,立即滴入
和新煮沸过的蒸馏水溶解后,立即滴入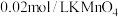 溶液至恰好完全反应,共消耗
溶液至恰好完全反应,共消耗 溶液
溶液 。
。 的质量分数是
的质量分数是 的摩尔质量是
的摩尔质量是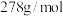 )。
)。Ⅱ.用制备颜料铵铁蓝.
(7)
 用稀
用稀 溶解后,加入
溶解后,加入 溶液和
溶液和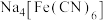 溶液,加热,产生白色沉淀
溶液,加热,产生白色沉淀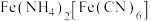 。酸性条件下再加入
。酸性条件下再加入 溶液,充分反应,得到铵铁蓝。补全离子方程式:
溶液,充分反应,得到铵铁蓝。补全离子方程式: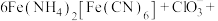 ______
______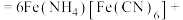 ______+______+______
______+______+______
您最近一年使用:0次
名校
解题方法
8 . 某小组同学在实验室制备高铁酸钾(K2FeO4), 并探究制备的适宜条件。制备K2FeO4的实验装置如下(夹持装置略)。
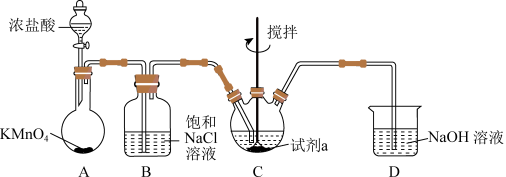
资料:K2FeO4为紫色固体,微溶于KOH溶液。
(1)装置A 中产生Cl2的化学方程式是____________ (锰元素被还原为Mn2+)。
(2)研究试剂a对K2FeO4产率的影响,对比实验如下。
注:上述实验中,溶液总体积、FeCl3和Fe(NO3)3的物质的量、Cl₂的通入量均相同。
①实验II、III产生K2FeO4,将方程式补充完整:___________ 。
还原反应: Cl2+2e=2Cl-;
氧化反应: 。
。
②对实验I 未产生K2FeO4而实验II能产生的原因提出假设:实验II溶液碱性较强,增强+3价铁的还原性。以下实验证实了该假设。

步骤1:通入Cl2, 电压表示数为V1;
步骤2:向右侧烧杯中加入___________ (填试剂),电压表示数为V2(V2>V1)。
③反思装置B 的作用:用饱和NaCl溶液除去HCl,目的是___________ 。
④实验II中K2FeO4的产率比实验III低,试解释原因:___________ 。
(3)向实验II所得紫色溶液中继续通入Cl2,观察到溶液紫色变浅。可能原因是通入Cl2后发生_________ (填离子方程式)而使溶液碱性减弱,进而导致K2FeO4分解。
(4)综上,制备K2FeO4的适宜条件是__________ 。

资料:K2FeO4为紫色固体,微溶于KOH溶液。
(1)装置A 中产生Cl2的化学方程式是
(2)研究试剂a对K2FeO4产率的影响,对比实验如下。
| 实验编号 | 试剂a | 实验现象 |
| I | FeCl3和少量KOH | 无明显现象 |
| Ⅱ | FeCl3和过量KOH | 得到紫色溶液,无紫色固体 |
| Ⅲ | Fe(NO3)3和过量KOH | 得到紫色溶液(颜色比Ⅱ深),有紫色固体 |
①实验II、III产生K2FeO4,将方程式补充完整:
还原反应: Cl2+2e=2Cl-;
氧化反应:
 。
。②对实验I 未产生K2FeO4而实验II能产生的原因提出假设:实验II溶液碱性较强,增强+3价铁的还原性。以下实验证实了该假设。

步骤1:通入Cl2, 电压表示数为V1;
步骤2:向右侧烧杯中加入
③反思装置B 的作用:用饱和NaCl溶液除去HCl,目的是
④实验II中K2FeO4的产率比实验III低,试解释原因:
(3)向实验II所得紫色溶液中继续通入Cl2,观察到溶液紫色变浅。可能原因是通入Cl2后发生
(4)综上,制备K2FeO4的适宜条件是
您最近一年使用:0次
9 . 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
I.制取氢气
(1)甲醇和水蒸气制取氢气的过程中有下列反应:
CH3OH(g) CO(g)+2H2(g) △H=+91 kJ·mol-1
CO(g)+2H2(g) △H=+91 kJ·mol-1
CO(g)+H2O(g) CO2(g)+H2 (g) △H=-4lkJ·mol-1
CO2(g)+H2 (g) △H=-4lkJ·mol-1
写出以甲醇为原料制取氢气的热化学方程式___________ 。
(2)理论上,能提高H2平衡产率的措施有___________ (写出一条即可)。
II.储存氢气
硼氢化钠(NaBH4) 是研究最广泛的储氢材料之一;
已知: i.B的电负性为2.0 H的电负性为2.1
ii.25℃下NaBH4 在水中的溶解度为55g,NaBO2在水中的溶解度为0.28g
(3)向NaBH4 水溶液中加入催化剂Ru/NGR后,能够迅速反应,生成偏硼酸钠(NaBO2) 和氢气。写出该反应的化学方程式___________ 。
(4)在研究浓度对催化剂Ru/NGR 活性的影响时,发现B 点后(见下图)增加NaBH4的浓度,制氢速率反而下降,推断可能的原因是___________ 。

(5)用惰性电极电解NaBO2 溶液可制得NaBH4, 实现物质的循环使用,制备装置如图所示。
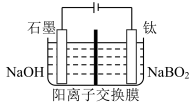
①钛电极的电极反应式是___________ ;
②电解过程中,阴极区溶液pH___________ 。(填“增大”“减小”或“不变”)
I.制取氢气
(1)甲醇和水蒸气制取氢气的过程中有下列反应:
CH3OH(g)
 CO(g)+2H2(g) △H=+91 kJ·mol-1
CO(g)+2H2(g) △H=+91 kJ·mol-1CO(g)+H2O(g)
 CO2(g)+H2 (g) △H=-4lkJ·mol-1
CO2(g)+H2 (g) △H=-4lkJ·mol-1写出以甲醇为原料制取氢气的热化学方程式
(2)理论上,能提高H2平衡产率的措施有
II.储存氢气
硼氢化钠(NaBH4) 是研究最广泛的储氢材料之一;
已知: i.B的电负性为2.0 H的电负性为2.1
ii.25℃下NaBH4 在水中的溶解度为55g,NaBO2在水中的溶解度为0.28g
(3)向NaBH4 水溶液中加入催化剂Ru/NGR后,能够迅速反应,生成偏硼酸钠(NaBO2) 和氢气。写出该反应的化学方程式
(4)在研究浓度对催化剂Ru/NGR 活性的影响时,发现B 点后(见下图)增加NaBH4的浓度,制氢速率反而下降,推断可能的原因是

(5)用惰性电极电解NaBO2 溶液可制得NaBH4, 实现物质的循环使用,制备装置如图所示。

①钛电极的电极反应式是
②电解过程中,阴极区溶液pH
您最近一年使用:0次
名校
10 . 白葡萄酒含有糖、醇、有机酸、维生素等营养物质, 作为必要的添加剂,具有减缓氧化、防腐、调酸等作用。某学习小组用“直接碘量法”对灌装后存放不同时间的白葡萄酒样品中
作为必要的添加剂,具有减缓氧化、防腐、调酸等作用。某学习小组用“直接碘量法”对灌装后存放不同时间的白葡萄酒样品中 浓度的变化规律进行探究。
浓度的变化规律进行探究。
(1)滴定前准备 各取存放了2个月、6个月、10个月的白葡萄酒样品5.00mL,分别放入三个盛有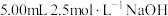 溶液的碘量瓶中。将碘量瓶在冰水浴中冷却,继续加入
溶液的碘量瓶中。将碘量瓶在冰水浴中冷却,继续加入 硫酸及1mL淀粉溶液,充分超声震荡3min。
硫酸及1mL淀粉溶液,充分超声震荡3min。
①样品中 和NaOH溶液反应的离子方程式为
和NaOH溶液反应的离子方程式为________ 。
②下列说法正确的是________ (填字母序号)。
a.如果样品颜色较深,应对样品脱色后再进行滴定
b.因 在碱性条件下会发生歧化,故需要充分酸化后再滴定
在碱性条件下会发生歧化,故需要充分酸化后再滴定
c.超声震荡过程中温度显著升高,用冰水浴降温有利于 的测定
的测定
(2)滴定过程 待碘量瓶温度稳定后,用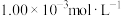 碘的标准溶液滴定。
碘的标准溶液滴定。
①滴定过程中,碘量瓶中发生反应的离子方程式为________ 。
②达到滴定终点时,碘量瓶中的现象是________ 。
(3)数据处理及应用 每个样品进行三次平行滴定实验,记录消耗碘的标准溶液体积的平均值,并进行相关计算,结果如下表。
已知: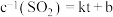 (k、b为常数),该函数对应的图像如下图所示。
(k、b为常数),该函数对应的图像如下图所示。
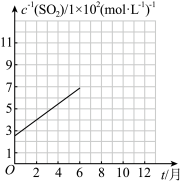
①表中
________ 。
②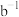 表达的实际含义是
表达的实际含义是________ 。
(4)实验改进及反思 小组同学先将白葡萄酒中二氧化硫充分蒸出,并用足量碱性溶液完全吸收,再将溶液酸化后用碘的标准溶液滴定。发现测定结果比“直接碘量法”更低。分析“直接碘量法”测定数据偏高的可能原因________ 。
 作为必要的添加剂,具有减缓氧化、防腐、调酸等作用。某学习小组用“直接碘量法”对灌装后存放不同时间的白葡萄酒样品中
作为必要的添加剂,具有减缓氧化、防腐、调酸等作用。某学习小组用“直接碘量法”对灌装后存放不同时间的白葡萄酒样品中 浓度的变化规律进行探究。
浓度的变化规律进行探究。(1)滴定前准备 各取存放了2个月、6个月、10个月的白葡萄酒样品5.00mL,分别放入三个盛有
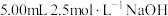 溶液的碘量瓶中。将碘量瓶在冰水浴中冷却,继续加入
溶液的碘量瓶中。将碘量瓶在冰水浴中冷却,继续加入 硫酸及1mL淀粉溶液,充分超声震荡3min。
硫酸及1mL淀粉溶液,充分超声震荡3min。①样品中
 和NaOH溶液反应的离子方程式为
和NaOH溶液反应的离子方程式为②下列说法正确的是
a.如果样品颜色较深,应对样品脱色后再进行滴定
b.因
 在碱性条件下会发生歧化,故需要充分酸化后再滴定
在碱性条件下会发生歧化,故需要充分酸化后再滴定c.超声震荡过程中温度显著升高,用冰水浴降温有利于
 的测定
的测定(2)滴定过程 待碘量瓶温度稳定后,用
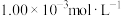 碘的标准溶液滴定。
碘的标准溶液滴定。①滴定过程中,碘量瓶中发生反应的离子方程式为
②达到滴定终点时,碘量瓶中的现象是
(3)数据处理及应用 每个样品进行三次平行滴定实验,记录消耗碘的标准溶液体积的平均值,并进行相关计算,结果如下表。
存放时间t/月 | 2 | 6 | 10 |
V(碘的标准溶液)/mL | 12.50 | 7.14 | 5.00 |
|
|
| m |
| n | 700 | p |
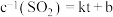 (k、b为常数),该函数对应的图像如下图所示。
(k、b为常数),该函数对应的图像如下图所示。
①表中

②
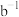 表达的实际含义是
表达的实际含义是(4)实验改进及反思 小组同学先将白葡萄酒中二氧化硫充分蒸出,并用足量碱性溶液完全吸收,再将溶液酸化后用碘的标准溶液滴定。发现测定结果比“直接碘量法”更低。分析“直接碘量法”测定数据偏高的可能原因
您最近一年使用:0次