硫代硫酸钠(Na2S2O3)是重要的化工原料易溶于水,在中性或碱性环境下稳定,在酸性溶液水,分解产生S、SO2。
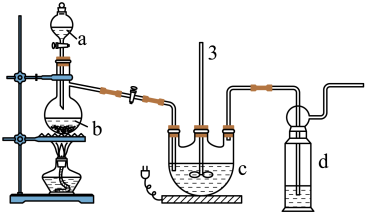
Ⅰ.Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示,其C中试剂为Na2S和Na2SO3的混合液。
(1)b中反应的离子方程式为_____ 。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是_____ 。
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是_____ 。
(4)制备得到的Na2S2O3中可能含有Na2SO3、Na2SO4等杂质。设计实验,检测产品中是否存在Na2SO4:取少量产品_____ 。
Ⅱ.探究Na2S2O3与金属阳离子的氧化还原反应。
资料:ⅰ.Fe3++3S2O
 Fe(S2O3)
Fe(S2O3)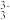 (紫黑色)
(紫黑色)
ⅱ.Ag2S2O3为白色沉淀,Ag2S2O3可溶于过量的S2O
(5)根据实验①的现象,初步判断最终Fe3+被S2O 还原为Fe2+,通过
还原为Fe2+,通过_____ (填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅰ的现象:_____ 。
(6)同浓度氧化性:Ag+>Fe3+。实验②中Ag+未发生氧化还原反应的原因是_____ 。
(7)进一步探究Ag+和S2O 反应。
反应。
实验③中白色絮状沉淀最后变为黑色沉淀(Ag2S)的化学方程式如下,填入合适的物质和系数:_____ 。
Ag2S2O3+_____=Ag2S+_____
(8)根据以上实验,Na2S2O3与金属阳离子发生氧化还原反应和_____ 有关(写出两条)。

Ⅰ.Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示,其C中试剂为Na2S和Na2SO3的混合液。
(1)b中反应的离子方程式为
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是
(4)制备得到的Na2S2O3中可能含有Na2SO3、Na2SO4等杂质。设计实验,检测产品中是否存在Na2SO4:取少量产品
Ⅱ.探究Na2S2O3与金属阳离子的氧化还原反应。
资料:ⅰ.Fe3++3S2O

 Fe(S2O3)
Fe(S2O3)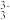 (紫黑色)
(紫黑色)ⅱ.Ag2S2O3为白色沉淀,Ag2S2O3可溶于过量的S2O

| 装置 | 编号 | 试剂X | 实验现象 |
 | ① | Fe(NO3)3溶液 | 混合后溶液先变成紫黑色,30s后溶液几乎变为无色 |
| ② | AgNO3溶液 | 先生成白色絮状沉淀,振荡后,沉淀溶解,得到无色溶液 |
(5)根据实验①的现象,初步判断最终Fe3+被S2O
 还原为Fe2+,通过
还原为Fe2+,通过(6)同浓度氧化性:Ag+>Fe3+。实验②中Ag+未发生氧化还原反应的原因是
(7)进一步探究Ag+和S2O
 反应。
反应。| 装置 | 编号 | 试剂X | 实验现象 |
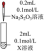 | ② | AgNO3溶液 | 先生成白色絮状沉淀,沉淀很快变成黄色、棕色,最后为黑色沉淀。 |
Ag2S2O3+_____=Ag2S+_____
(8)根据以上实验,Na2S2O3与金属阳离子发生氧化还原反应和
更新时间:2024-03-28 20:20:49
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
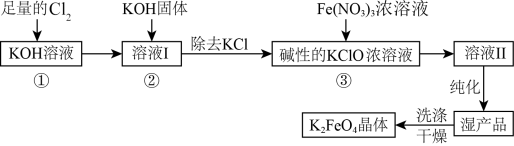
【推荐1】次氯酸盐具有强氧化性。在碱性条件下,利用 氧化
氧化 生成高铁酸钾
生成高铁酸钾 的工艺流程如下:
的工艺流程如下:
已知:①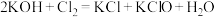 (条件:温度较低);
(条件:温度较低);
②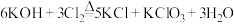 (条件:温度较高)。
(条件:温度较高)。
回答下列问题:
(1)反应①应在___________ (填“温度较高”或“温度较低”)的情况下进行,该反应的离子方程式为___________ 。
(2)在溶液I中加入 固体的目的是
固体的目的是___________ 。
(3)从溶液Ⅱ中分离出 后,还会有副产品
后,还会有副产品 、
、 ,则反应③中发生的离子反应方程式为
,则反应③中发生的离子反应方程式为___________ 。
(4)目前,人们针对 的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高
的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高 水溶液稳定性的物质是___________(填字母)。
水溶液稳定性的物质是___________(填字母)。
 氧化
氧化 生成高铁酸钾
生成高铁酸钾 的工艺流程如下:
的工艺流程如下:
已知:①
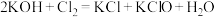 (条件:温度较低);
(条件:温度较低);②
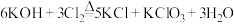 (条件:温度较高)。
(条件:温度较高)。回答下列问题:
(1)反应①应在
(2)在溶液I中加入
 固体的目的是
固体的目的是(3)从溶液Ⅱ中分离出
 后,还会有副产品
后,还会有副产品 、
、 ,则反应③中发生的离子反应方程式为
,则反应③中发生的离子反应方程式为(4)目前,人们针对
 的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高
的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高 水溶液稳定性的物质是___________(填字母)。
水溶液稳定性的物质是___________(填字母)。A. | B. | C. | D. |
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如图:

已知:①还原性:Cl->Co2+;
②Fe3+和C2O 结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的____ 。
(2)滤渣的主要成分为____ (填化学式)。
(3)从含铝废液得到Al(OH)3的离子方程式为____ 。
(4)滤液A中的溶质除HCl、LiCl外还有____ (填化学式)。写出LiCoO2和盐酸反应的化学方程式____ 。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见表,请补充完整表中问题。已知:①CoC2O4在空气中加热时的气体产物为CO2。
②固体失重率=对应温度下样品失重的质量/样品的初始质量。
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02mol·L-1的Li2SO4和浓度为0.02mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为____ mol·L-1。
(7)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是____ 。

已知:①还原性:Cl->Co2+;
②Fe3+和C2O
 结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:(1)废旧电池初步处理为粉末状的目的
(2)滤渣的主要成分为
(3)从含铝废液得到Al(OH)3的离子方程式为
(4)滤液A中的溶质除HCl、LiCl外还有
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见表,请补充完整表中问题。已知:①CoC2O4在空气中加热时的气体产物为CO2。
②固体失重率=对应温度下样品失重的质量/样品的初始质量。
| 序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
| I | 120~220 | CoC2O4·2H2O=CoC2O4+2H2O | 19.67% |
| II | 300~350 | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02mol·L-1的Li2SO4和浓度为0.02mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为
(7)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是
您最近半年使用:0次
【推荐3】钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用。从钛白工业废酸(含钪、钛、铁、锰等离子)中提取氧化钪(Sc2O3)的一种流程如下:

回答下列问题:
(1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是_______________ 。
(2)先加入氨水调节pH=3,过滤,滤渣主要成分是__________ ;再向滤液加入氨水调节pH=6,滤液中Sc3+的浓度为_____________ 。(已知:Ksp[Mn(OH)2]=1.9×10-13、Ksp[Fe(OH)3]=2.6×10-39,Ksp[Sc(OH)3]=9.0×10-31)
(3)用草酸“沉钪”。25 ℃时pH=2的草酸溶液中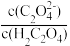 =
=__________ (保留两位有效数字)。写出“沉钪”得到草酸钪的离子方程式________________________ 。【已知Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5】
(4)草酸钪“灼烧”氧化的化学方程式为________________ 。

回答下列问题:
(1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是
(2)先加入氨水调节pH=3,过滤,滤渣主要成分是
(3)用草酸“沉钪”。25 ℃时pH=2的草酸溶液中
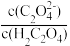 =
=(4)草酸钪“灼烧”氧化的化学方程式为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】铈的氧化物在半导体材料、高级颜料及汽车尾气的净化器方面有广泛应用。以氟碳酸铈(主要含CeFCO3)为原料制备CeO2的工艺流程如下:

已知:①CeO2具有较强的氧化性,难溶于一般的酸或碱。
②F-能和很多金属离子形成较为稳定的配合物,如Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF ;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
③Ce4+能被萃取剂TBP萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”后的固体产物中含有CeO2和CeF4,CeO2和CeF4的物质的量之比为3:1,“酸浸”时发生反应的离子方程式为_______ 。
(2)“反萃取”步骤中发生反应的离子方程式为_______ 。

已知:①CeO2具有较强的氧化性,难溶于一般的酸或碱。
②F-能和很多金属离子形成较为稳定的配合物,如Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF
 ;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。③Ce4+能被萃取剂TBP萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”后的固体产物中含有CeO2和CeF4,CeO2和CeF4的物质的量之比为3:1,“酸浸”时发生反应的离子方程式为
(2)“反萃取”步骤中发生反应的离子方程式为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
(一)利用如下图所示装置制备氯水
(1)A中圆底烧瓶内发生反应的离子方程式为______ ,B中饱和食盐水的作用为______ 。
(二)氧化性强弱探究:
(2)实验I中,ii的离子方程式为________ 。
(3)实验ii中,由i和ii可以得出的结论为________ 。
(4)①甲同学认为:实验II观察到________ 现象,可得出结论:氧化性:Br2>I2。
②乙同学对上述实验进行反思,认为实验II不能充分证明氧化性Br2>I2,他补做了实验III。
补做实验III的目的为_________ 。
(一)利用如下图所示装置制备氯水

(1)A中圆底烧瓶内发生反应的离子方程式为
(二)氧化性强弱探究:
| 实验I | i.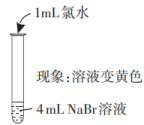 | ii.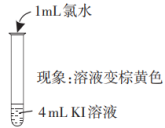 |
| 实验II | 取i中的黄色溶液少许,加入KI溶液,再加入淀粉溶液。 | |
(3)实验ii中,由i和ii可以得出的结论为
(4)①甲同学认为:实验II观察到
②乙同学对上述实验进行反思,认为实验II不能充分证明氧化性Br2>I2,他补做了实验III。
| 实验iii | 另取i中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液。 |
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
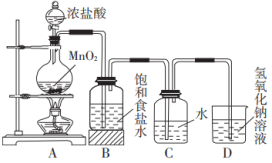
【推荐3】氯气是一种重要的化工原料,它的发现和研究经过了化学家们的不懈努力。
(1)舍勒发现氯气的方法是实验室制取氯气(如图)的主要方法之一。
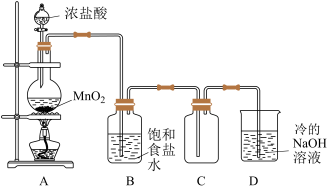
①盛装浓盐酸的仪器名称为_____ ;装置A中发生反应的化学方程式为___________ 。
②装置B中饱和食盐水的作用是___________ 。
③装置D中发生反应的离子方程式为___________ 。
(2)含氧化合物亚氯酸钠( )是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
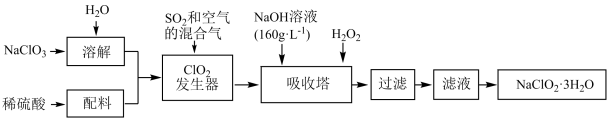
已知:纯 易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全。
易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全。
① 发生器中发生反应的离子方程式为
发生器中发生反应的离子方程式为_____ ,在发生器中鼓入空气的作用可能是_____ 。
②吸收塔中为防止 被还原成NaCl,可用还原性适中的
被还原成NaCl,可用还原性适中的 作还原剂,写出吸收塔中发生反应的化学方程式:
作还原剂,写出吸收塔中发生反应的化学方程式:_____ ;除 外还可以选择的还原剂是
外还可以选择的还原剂是_____ (填字母)。
A. B.
B. C.
C.
(1)舍勒发现氯气的方法是实验室制取氯气(如图)的主要方法之一。

①盛装浓盐酸的仪器名称为
②装置B中饱和食盐水的作用是
③装置D中发生反应的离子方程式为
(2)含氧化合物亚氯酸钠(
 )是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
已知:纯
 易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全。
易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全。①
 发生器中发生反应的离子方程式为
发生器中发生反应的离子方程式为②吸收塔中为防止
 被还原成NaCl,可用还原性适中的
被还原成NaCl,可用还原性适中的 作还原剂,写出吸收塔中发生反应的化学方程式:
作还原剂,写出吸收塔中发生反应的化学方程式: 外还可以选择的还原剂是
外还可以选择的还原剂是A.
 B.
B. C.
C.
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】A、B、C、D均为中学化学中常见的物质,它们之间转化关系如图所示(部分产物和条件已略去),回答下列问题:

(1)若A为能形成温室效应的气体,D为NaOH溶液,则C的化学式为_____________ 。
(2)若常温时A为气态氢化物,B为淡黄色固体单质,则A与C反应生成B的化学方程式为_____________ ,氧化剂与还原剂物质的量之比_____________ 。
(3)若A为黄绿色气体,D为常见金属,则A与C生成B的离子方程式为_____________ 。向C溶液滴加NaOH溶液的现象_____________ 。

(1)若A为能形成温室效应的气体,D为NaOH溶液,则C的化学式为
(2)若常温时A为气态氢化物,B为淡黄色固体单质,则A与C反应生成B的化学方程式为
(3)若A为黄绿色气体,D为常见金属,则A与C生成B的离子方程式为
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】研究硫及其化合物的性质,对我们的发展有重要意义。
1.硫及其化合物的价类二维图体现了化学变化之美,根据图示回答问题。

(1)A的化学式为___________ ,A与C反应可生成淡黄色的固体,该反应氧化产物与还原产物的质量比是___________ 。
(2)E的浓溶液与铜在加热条件下可发生化学反应,写出化学方程式___________ 。该反应体现了E的性质为___________ 。
(3)物质G在反应中既可做氧化剂,又可做还原剂,当它做氧化剂时,还原产物可能是___________(填选项)
II.二氧化硫的功与过
(4)SO2能使___________ (填试剂名称)溶液褪色,说明SO2具有漂白性。因此可用作草帽、纸张等物质的漂白剂。若将足量的SO2通入到紫色石蕊溶液中,可观察到的现象是___________ 。
(5)SO2是导致酸雨形成主要原因之一,工业上常用NaClO碱性溶液吸收二氧化硫,发生反应: (未配平)。理论上消耗29.8gNaClO,可吸收标准状况下
(未配平)。理论上消耗29.8gNaClO,可吸收标准状况下___________ L的SO2气体。
(6)国家对葡萄酒中二氧化硫的含量有上限规定。某种检测方法用到碘水和淀粉。请写出二氧化硫和碘水反应的化学方程式___________ 。
1.硫及其化合物的价类二维图体现了化学变化之美,根据图示回答问题。

(1)A的化学式为
(2)E的浓溶液与铜在加热条件下可发生化学反应,写出化学方程式
(3)物质G在反应中既可做氧化剂,又可做还原剂,当它做氧化剂时,还原产物可能是___________(填选项)
| A.Na2S | B.Na2SO4 | C.SO2 | D.S |
II.二氧化硫的功与过
(4)SO2能使
(5)SO2是导致酸雨形成主要原因之一,工业上常用NaClO碱性溶液吸收二氧化硫,发生反应:
 (未配平)。理论上消耗29.8gNaClO,可吸收标准状况下
(未配平)。理论上消耗29.8gNaClO,可吸收标准状况下(6)国家对葡萄酒中二氧化硫的含量有上限规定。某种检测方法用到碘水和淀粉。请写出二氧化硫和碘水反应的化学方程式
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】几种中学常见的单质及化合物的相互转化关系如图(部分反应物或产物已省略):

已知:①甲、乙、丁为单质,其余为化合物。
②A是黄铁矿的主要成分,由两种元素组成,其原子个数比为l︰2,元素质量之比为7︰8。
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,反应④中乙转化为一种常见的温室气体。
试根据上述信息,回答下列问题:
(1)A的化学式为___ ;甲所含元素的原子结构示意图___ 。
(2)工业上用A为原料来制备D,其中反应②在___ (填设备名称)中进行,选用浓硫酸来吸收C而不用H的目的为:___ 。
(3)F与丁单质反应也可以得到G,试写出该反应的离子方程式:___ 。
(4)写出反应⑤的化学方程式___ 。
(5)化合物M与H组成元素相同,可以将G转化为F,且不引进新杂质。试写出M在酸性环境下将G氧化为F的离子方程式:___ 。

已知:①甲、乙、丁为单质,其余为化合物。
②A是黄铁矿的主要成分,由两种元素组成,其原子个数比为l︰2,元素质量之比为7︰8。
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,反应④中乙转化为一种常见的温室气体。
试根据上述信息,回答下列问题:
(1)A的化学式为
(2)工业上用A为原料来制备D,其中反应②在
(3)F与丁单质反应也可以得到G,试写出该反应的离子方程式:
(4)写出反应⑤的化学方程式
(5)化合物M与H组成元素相同,可以将G转化为F,且不引进新杂质。试写出M在酸性环境下将G氧化为F的离子方程式:
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:

请回答下列问题:
(1)步骤①所得废渣的成分是____________ 写化学式),操作I的名称______ 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是____________________________ 。
③中X试剂为___________________ 。
(3)⑤的离子方程式为________________________ 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为__________ ;
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<_____________ 。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有______________ 和_______ 。

请回答下列问题:
(1)步骤①所得废渣的成分是
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+ 2nHA(有机层)
 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)②中萃取时必须加入适量碱,其原因是
③中X试剂为
(3)⑤的离子方程式为
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】下图为铜丝与浓硫酸反应并验证其产物性质的实验装置。
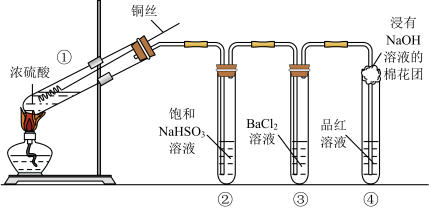
(1)①中反应的化学方程式是______ 。其中铜发生了______ (填“氧化”或“还原”)反应,判断依据为_____ 。
(2)②中饱和NaHSO3溶液的作用是除去①中挥发出的硫酸。加热一段时间后,③中溶液依然澄清,④中溶液褪色。想要立即终止铜与硫酸的反应,最恰当的方法是______ 。
a.上移铜丝,使其脱离硫酸
b.撤去酒精灯
c.拔去橡胶塞倒出硫酸
(3)反应停止后,待装置冷却,把③取下后将其中溶液分成两份做如下实验:
完成上述反应的离子方程式。
(4)④中棉花团的作用是_______ 。
(5)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色。取少量蓝色溶液于试管中,滴加NaOH溶液至过量,出现的现象是______ 。

(1)①中反应的化学方程式是
(2)②中饱和NaHSO3溶液的作用是除去①中挥发出的硫酸。加热一段时间后,③中溶液依然澄清,④中溶液褪色。想要立即终止铜与硫酸的反应,最恰当的方法是
a.上移铜丝,使其脱离硫酸
b.撤去酒精灯
c.拔去橡胶塞倒出硫酸
(3)反应停止后,待装置冷却,把③取下后将其中溶液分成两份做如下实验:
| 加入试剂 | 现象 | 反应的离子方程式 | |
| 第一份 | 加入NaOH溶液 | 有白色沉淀生成 | |
| 第二份 | 加入氯水 | 有白色沉淀生成 |
(4)④中棉花团的作用是
(5)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色。取少量蓝色溶液于试管中,滴加NaOH溶液至过量,出现的现象是
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】化学是一门以实验为基础的自然科学,是研究物质的性质的重要途径。某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
已知:Na2SO3+H2SO4(浓) Na2SO4+SO2↑+H2O,请回答下列问题:
Na2SO4+SO2↑+H2O,请回答下列问题:
(1) 装置A中盛放浓硫酸的仪器名称是__________________ 。
(2) 实验过程中,C中的现象是____________ ,说明SO2具有_________ 性。
(3) 实验过程中,观察到装置B中出现了明显的白色沉淀。为探究该白色沉淀的成分,该小组同学进行了如下实验:

根据实验事实判断该白色沉淀的成分是_______________ (填化学式),产生该白色沉淀的原因可能是_____________ (填字母编号)。
a.BaSO3既不溶于水也不溶于酸
b.BaCl2溶液中可能溶解有氧气
c.BaCl2溶液中可能混有NaOH
d.由A制得的SO2气体中可能混有氧气
(4)如果将装置A中的浓H2SO4换作浓HNO3,对此实验是否有影响并说明理由_________________
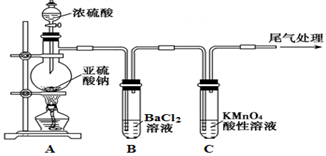
已知:Na2SO3+H2SO4(浓)
 Na2SO4+SO2↑+H2O,请回答下列问题:
Na2SO4+SO2↑+H2O,请回答下列问题:(1) 装置A中盛放浓硫酸的仪器名称是
(2) 实验过程中,C中的现象是
(3) 实验过程中,观察到装置B中出现了明显的白色沉淀。为探究该白色沉淀的成分,该小组同学进行了如下实验:

根据实验事实判断该白色沉淀的成分是
a.BaSO3既不溶于水也不溶于酸
b.BaCl2溶液中可能溶解有氧气
c.BaCl2溶液中可能混有NaOH
d.由A制得的SO2气体中可能混有氧气
(4)如果将装置A中的浓H2SO4换作浓HNO3,对此实验是否有影响并说明理由
您最近半年使用:0次



