研究小组制备次氯酸钠(NaClO)、探究其性质并测定其物质的量浓度。
I.制备NaClO
实验装置如下图:

(1)A为氯气发生装置,反应为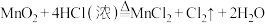 ,氧化剂与还原剂物质的量之比为
,氧化剂与还原剂物质的量之比为_________ 。
(2)B中饱和NaCl溶液的作用是________ 。
(3)C为NaClO制备装置,反应的离子方程式为_______ 。
Ⅱ.探究NaClO的性质
(4)从物质类别看,NaClO属于________ ,可能与某些酸反应。小组同学将红色纸条浸入NaClO溶液后,纸条褪色,向溶液中通入 后,褪色更加明显,说明NaClO与
后,褪色更加明显,说明NaClO与 和
和 生成
生成_______ (写化学式)。
(5)NaClO具有氧化性,预测依据是_______ 。小组同学向NaClO溶液中加入过量的KI溶液,加入适量稀硫酸,加入淀粉,溶液变蓝,无黄绿色气体产生。该反应的离子方程式为_______ 。
Ⅲ.测定NaClO溶液的物质的量浓度
步骤i:配制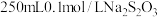 (摩尔质量为158g/mol)标准溶液。
(摩尔质量为158g/mol)标准溶液。
(6)计算需要 固体的质量是
固体的质量是_____ g。
(7)用到的仪器有:天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和_______ 。
(8)下列情况中,会使所配溶液浓度偏小的是___________ (填字母)。
a.配制溶液所用的容器中有蒸馏水 b.转移时,未洗涤烧杯和玻璃棒
c.定容时,眼睛仰视刻度线 d.摇匀后发现凹液面最低处低于刻度线
步骤ii:用 标准溶液通过实验测得250mLNaClO溶液与足量KI反应生成
标准溶液通过实验测得250mLNaClO溶液与足量KI反应生成 的物质的量为0.05mol。
的物质的量为0.05mol。
(9)计算NaClO溶液的物质的量浓度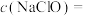
______ mol/L。
I.制备NaClO
实验装置如下图:

(1)A为氯气发生装置,反应为
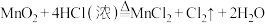 ,氧化剂与还原剂物质的量之比为
,氧化剂与还原剂物质的量之比为(2)B中饱和NaCl溶液的作用是
(3)C为NaClO制备装置,反应的离子方程式为
Ⅱ.探究NaClO的性质
(4)从物质类别看,NaClO属于
 后,褪色更加明显,说明NaClO与
后,褪色更加明显,说明NaClO与 和
和 生成
生成(5)NaClO具有氧化性,预测依据是
Ⅲ.测定NaClO溶液的物质的量浓度
步骤i:配制
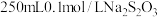 (摩尔质量为158g/mol)标准溶液。
(摩尔质量为158g/mol)标准溶液。(6)计算需要
 固体的质量是
固体的质量是(7)用到的仪器有:天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和
(8)下列情况中,会使所配溶液浓度偏小的是
a.配制溶液所用的容器中有蒸馏水 b.转移时,未洗涤烧杯和玻璃棒
c.定容时,眼睛仰视刻度线 d.摇匀后发现凹液面最低处低于刻度线
步骤ii:用
 标准溶液通过实验测得250mLNaClO溶液与足量KI反应生成
标准溶液通过实验测得250mLNaClO溶液与足量KI反应生成 的物质的量为0.05mol。
的物质的量为0.05mol。(9)计算NaClO溶液的物质的量浓度
更新时间:2024-03-01 10:32:29
|
相似题推荐
【推荐1】碘元素是人体必需的微量元素之一。某学习小组在实验室进行海带提碘的探究,实验过程如下:
Ⅰ.海带中碘元素的确定
(1)同学们称取一定量干海带,将海带先剪碎,然后用水浸泡、洗净、晾干,放入_______ (填仪器名称)中灼烧至海带完全成灰烬,然后继续进行下列流程。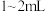 ,加入
,加入 稀硫酸、
稀硫酸、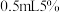 的
的 溶液,然后再加入
溶液,然后再加入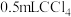 ,振荡后静置,若观察到
,振荡后静置,若观察到_______ (填实验现象),则证明海带中含有碘元素,上述过程中涉及的离子反应方程式为_______ 。
Ⅱ.海带提碘 中,可采取的操作是
中,可采取的操作是_______ 。
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需经过蒸馏,指出图实验装置中存在的错误之处_______ 。
Ⅲ.人体碘的重要来源之一是食用加碘食盐(含 )。为测定加碘食盐中的碘含量,学习小组设计如下实验:
)。为测定加碘食盐中的碘含量,学习小组设计如下实验: 食盐样品,加适量蒸馏水使其完全溶解;
食盐样品,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化所得溶液,加入足量 溶液,使
溶液,使 与
与 反应完全生成
反应完全生成 ;
;
③向②中混合液逐滴加入浓度为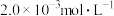 的
的 溶液,恰好反应完全时,消耗
溶液,恰好反应完全时,消耗 溶液
溶液 。(已知:
。(已知: )
)
(5)写出步骤②中发生反应的离子方程式_______ 。
(6)上述实验样品中碘元素的含量为_______ 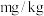 (用含w的代数式表示)。
(用含w的代数式表示)。
Ⅰ.海带中碘元素的确定
(1)同学们称取一定量干海带,将海带先剪碎,然后用水浸泡、洗净、晾干,放入

 ,加入
,加入 稀硫酸、
稀硫酸、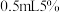 的
的 溶液,然后再加入
溶液,然后再加入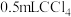 ,振荡后静置,若观察到
,振荡后静置,若观察到Ⅱ.海带提碘

 中,可采取的操作是
中,可采取的操作是(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需经过蒸馏,指出图实验装置中存在的错误之处
Ⅲ.人体碘的重要来源之一是食用加碘食盐(含
 )。为测定加碘食盐中的碘含量,学习小组设计如下实验:
)。为测定加碘食盐中的碘含量,学习小组设计如下实验: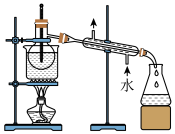
 食盐样品,加适量蒸馏水使其完全溶解;
食盐样品,加适量蒸馏水使其完全溶解;②用稀硫酸酸化所得溶液,加入足量
 溶液,使
溶液,使 与
与 反应完全生成
反应完全生成 ;
;③向②中混合液逐滴加入浓度为
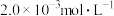 的
的 溶液,恰好反应完全时,消耗
溶液,恰好反应完全时,消耗 溶液
溶液 。(已知:
。(已知: )
)(5)写出步骤②中发生反应的离子方程式
(6)上述实验样品中碘元素的含量为
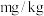 (用含w的代数式表示)。
(用含w的代数式表示)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】 是一种高效,安全的消毒剂,可用于取代
是一种高效,安全的消毒剂,可用于取代 。实验室制备
。实验室制备 的原理是用亚氯酸钠固体与纯净干燥的氯气反应:
的原理是用亚氯酸钠固体与纯净干燥的氯气反应: 。如图是实验室用于制备和收集一定量纯净
。如图是实验室用于制备和收集一定量纯净 的装置(某些夹持装置省略)。
的装置(某些夹持装置省略)。

(1)圆底烧瓶装有 ,发生反应的化学方程式为:
,发生反应的化学方程式为:___________ ,在该反应中浓盐酸表现的性质是___________ (填序号)。
a、只有还原性 b、还原性和酸性 c、只有氧化性 d、氧化性和酸性
(2)实验中相关气体在不同溶剂中的溶解性如下表所示:
 、
、 、
、 装置中的试剂依次是
装置中的试剂依次是___________ 、___________ 、___________ (填序号)。
a、 溶液 b、浓硫酸 c、饱和食盐水 d、
溶液 b、浓硫酸 c、饱和食盐水 d、 e、饱和石灰水
e、饱和石灰水
(3) 处应选用的收集装置是
处应选用的收集装置是___________ (填序号),其中与 装置导管相连的导管口是
装置导管相连的导管口是___________ (填接口字母)。

(4)家用的二氧化氯( )泡腾消毒片由
)泡腾消毒片由 、固体酸及辅助剂混合制得,使用时只需将泡腾片放入水中,5~10分钟即可完全溶解,释放出
、固体酸及辅助剂混合制得,使用时只需将泡腾片放入水中,5~10分钟即可完全溶解,释放出 。
。
①二氧化氯泡腾片使用时需要加水,水的作用是___________ ;
②补全泡腾片在水中发生反应的离子方程式:___________

(5)消毒剂的消毒效率常用单位质量的消毒剂得到的电子数表示。经过计算可知,理论上 的消毒效率是
的消毒效率是 的
的___________ 倍(保留两位小数)。
 是一种高效,安全的消毒剂,可用于取代
是一种高效,安全的消毒剂,可用于取代 。实验室制备
。实验室制备 的原理是用亚氯酸钠固体与纯净干燥的氯气反应:
的原理是用亚氯酸钠固体与纯净干燥的氯气反应: 。如图是实验室用于制备和收集一定量纯净
。如图是实验室用于制备和收集一定量纯净 的装置(某些夹持装置省略)。
的装置(某些夹持装置省略)。
(1)圆底烧瓶装有
 ,发生反应的化学方程式为:
,发生反应的化学方程式为:a、只有还原性 b、还原性和酸性 c、只有氧化性 d、氧化性和酸性
(2)实验中相关气体在不同溶剂中的溶解性如下表所示:
 |  |  | |
| 水 | 极易溶 | 可溶 | 极易溶 |
 | 难溶 | 易溶 | 难溶 |
 、
、 、
、 装置中的试剂依次是
装置中的试剂依次是a、
 溶液 b、浓硫酸 c、饱和食盐水 d、
溶液 b、浓硫酸 c、饱和食盐水 d、 e、饱和石灰水
e、饱和石灰水(3)
 处应选用的收集装置是
处应选用的收集装置是 装置导管相连的导管口是
装置导管相连的导管口是
(4)家用的二氧化氯(
 )泡腾消毒片由
)泡腾消毒片由 、固体酸及辅助剂混合制得,使用时只需将泡腾片放入水中,5~10分钟即可完全溶解,释放出
、固体酸及辅助剂混合制得,使用时只需将泡腾片放入水中,5~10分钟即可完全溶解,释放出 。
。
①二氧化氯泡腾片使用时需要加水,水的作用是
②补全泡腾片在水中发生反应的离子方程式:

(5)消毒剂的消毒效率常用单位质量的消毒剂得到的电子数表示。经过计算可知,理论上
 的消毒效率是
的消毒效率是 的
的
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】铁是人体必需的微量元素之一,医学上常用FeSO4糖衣片给贫血病人补铁。某兴趣小组欲用酸性KMnO4溶液来测定某补铁剂中FeSO4的含量(设该药品中的其它成分不与硫酸、KMnO4反应)。
实验步骤:
步骤一:精确配制0.200mol/L的KMnO4溶液;
步骤二:取10片除去糖衣的药片,研碎,加适量稀硫酸使其完全溶解;
步骤三:用所配KMnO4溶液测量步骤二溶液中FeSO4的含量,记录消耗KMnO4溶液的体积。
请回答:
(1)步骤一中用KMnO4固体配制250mL0.200moL/L的KMnO4溶液。
①所需玻璃仪器除了胶头滴管,玻璃棒外还必须用到_______ 。
②下列说法正确的是_______ 。

A.用洁净未干燥的容量瓶配制溶液会导致所配溶液浓度偏低
B.洗涤液都注入容量瓶后,使溶液混合均匀的操作如图
C.定容时仰视刻度线会导致所配溶液浓度偏低
D.定容摇匀后发现液面低于容量瓶刻度线,不做任何处理
(2)某同学三次实验消耗的KMnO4溶液体积数据如下:
(已知反应5Fe2++ +8H+=5Fe3++Mn2++4H2O)
+8H+=5Fe3++Mn2++4H2O)
根据该同学的实验数据,计算每片补铁剂中含FeSO4的质量为_______ g。
(3)该同学发观测定结果明显低于理论值,可能原因是_______ 。
实验步骤:
步骤一:精确配制0.200mol/L的KMnO4溶液;
步骤二:取10片除去糖衣的药片,研碎,加适量稀硫酸使其完全溶解;
步骤三:用所配KMnO4溶液测量步骤二溶液中FeSO4的含量,记录消耗KMnO4溶液的体积。
请回答:
(1)步骤一中用KMnO4固体配制250mL0.200moL/L的KMnO4溶液。
①所需玻璃仪器除了胶头滴管,玻璃棒外还必须用到
②下列说法正确的是

A.用洁净未干燥的容量瓶配制溶液会导致所配溶液浓度偏低
B.洗涤液都注入容量瓶后,使溶液混合均匀的操作如图
C.定容时仰视刻度线会导致所配溶液浓度偏低
D.定容摇匀后发现液面低于容量瓶刻度线,不做任何处理
(2)某同学三次实验消耗的KMnO4溶液体积数据如下:
(已知反应5Fe2++
 +8H+=5Fe3++Mn2++4H2O)
+8H+=5Fe3++Mn2++4H2O)| 测定次数 | 第1次 | 第2次 | 第3次 |
| V(KMnO4溶液)/mL | 19.98 | 20.02 | 20.00 |
(3)该同学发观测定结果明显低于理论值,可能原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】锌是一种重要的金属,锌及其化合物被广泛应用于汽车、建筑、船舶、电池等行业。现某科研小组以固体废锌催化剂(主要成分是 ,含少量
,含少量 、
、 、
、 、
、 等杂质)为原料制备锌的工艺流程如图所示:
等杂质)为原料制备锌的工艺流程如图所示:
①“浸取”时, 和
和 转化为
转化为 、
、 进入溶液。
进入溶液。
② 时,
时, ,
, 。
。
③深度除杂标准:溶液中 ≤2.0×10-6。
≤2.0×10-6。
(1)“浸取”温度为 ,锌的浸出率可达
,锌的浸出率可达 ,继续升温浸出率反而下降,其原因为
,继续升温浸出率反而下降,其原因为___________ 。
(2)“滤渣1”的主要成分为 、
、___________ 。
(3)“深度除锰”是将残留的 转化为
转化为 ,写出该过程的离子方程式
,写出该过程的离子方程式___________ 。
(4)“深度除铜”时,锌的最终回收率,除铜效果(用反应后溶液中的铜锌比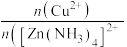 表示)与
表示)与 加入量的关系曲线如图所示。
加入量的关系曲线如图所示。
①当 达到一定量的时候,锌的最终回收率下降的原因是
达到一定量的时候,锌的最终回收率下降的原因是___________ (用离子方程式解释)。
②“深度除铜”时 加入量最优选择
加入量最优选择___________ (填标号)。
A.100% B.110% C.120% D.130%
(5) 原子能形成多种配位化合物,一种锌的配合物结构如图:
原子能形成多种配位化合物,一种锌的配合物结构如图:___________ 。
②基态 原子的价电子排布式为
原子的价电子排布式为___________ 。
 ,含少量
,含少量 、
、 、
、 、
、 等杂质)为原料制备锌的工艺流程如图所示:
等杂质)为原料制备锌的工艺流程如图所示: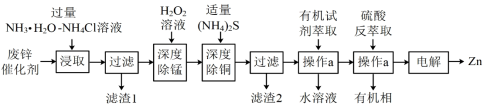
①“浸取”时,
 和
和 转化为
转化为 、
、 进入溶液。
进入溶液。②
 时,
时, ,
, 。
。③深度除杂标准:溶液中
 ≤2.0×10-6。
≤2.0×10-6。(1)“浸取”温度为
 ,锌的浸出率可达
,锌的浸出率可达 ,继续升温浸出率反而下降,其原因为
,继续升温浸出率反而下降,其原因为(2)“滤渣1”的主要成分为
 、
、(3)“深度除锰”是将残留的
 转化为
转化为 ,写出该过程的离子方程式
,写出该过程的离子方程式(4)“深度除铜”时,锌的最终回收率,除铜效果(用反应后溶液中的铜锌比
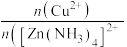 表示)与
表示)与 加入量的关系曲线如图所示。
加入量的关系曲线如图所示。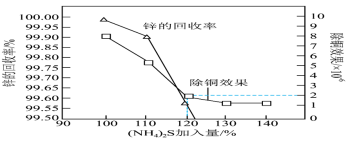
①当
 达到一定量的时候,锌的最终回收率下降的原因是
达到一定量的时候,锌的最终回收率下降的原因是②“深度除铜”时
 加入量最优选择
加入量最优选择A.100% B.110% C.120% D.130%
(5)
 原子能形成多种配位化合物,一种锌的配合物结构如图:
原子能形成多种配位化合物,一种锌的配合物结构如图:
②基态
 原子的价电子排布式为
原子的价电子排布式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】依据图中氮元素及其化合物的转化关系,回答问题:

(1)图1中,X的化学式为___________ ,从化合价上看,X具有___________ 性(填“氧化”或“还原”)。
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为___________ 。
②下列试剂不能用于干燥NH3的是___________ (填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
③若要收集一瓶氨气,请将图2装置补充完整___________ (在图2虚框内画出连接图)。

④烧杯中倒扣漏斗的作用___________ ,体现了NH3的性质为___________
(3)回答下列关于硝酸的问题:
①配平硝酸型酸雨形成的反应方程式:___________ 。
___________NO2+___________H2O=___________HNO3+___________NO
②铜和稀硝酸反应的离子方程式___________ 。
③铜和浓硝酸反应的化学方程式___________ 。

(1)图1中,X的化学式为
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为
②下列试剂不能用于干燥NH3的是
A.浓硫酸 B.碱石灰 C.NaOH固体
③若要收集一瓶氨气,请将图2装置补充完整

④烧杯中倒扣漏斗的作用
(3)回答下列关于硝酸的问题:
①配平硝酸型酸雨形成的反应方程式:
___________NO2+___________H2O=___________HNO3+___________NO
②铜和稀硝酸反应的离子方程式
③铜和浓硝酸反应的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】某工厂酸性废液中含有Fe3+、Al3+、Fe2+、 ,以该废液为原料制备Fe2O3的工艺流程如下(部分操作和条件略去):
,以该废液为原料制备Fe2O3的工艺流程如下(部分操作和条件略去):

已知:NH3·H2O与Al3+反应生成Al(OH)3沉淀;NH4HCO3在热水中会分解。
(1)写出“还原”步骤中反应的离子方程式:_______ 。
(2)从流程中分析,“滤渣”的主要成分是_______ 。
(3)加入碳酸氢铵后过滤,发现滤液仍然浑浊,可能的原因是_______ ,用90 °C热水洗涤FeCO3沉淀的目的是_______ 。
(4)“灼烧氧化”发生反应的化学方程式为_______ 。
(5)若工业上“灼烧氧化”174.0 t FeCO3得到117.6 t产品,则该产品中Fe2O3的纯度为_______ (设产品中杂质只有FeO,保留一位小数)。
 ,以该废液为原料制备Fe2O3的工艺流程如下(部分操作和条件略去):
,以该废液为原料制备Fe2O3的工艺流程如下(部分操作和条件略去):
已知:NH3·H2O与Al3+反应生成Al(OH)3沉淀;NH4HCO3在热水中会分解。
(1)写出“还原”步骤中反应的离子方程式:
(2)从流程中分析,“滤渣”的主要成分是
(3)加入碳酸氢铵后过滤,发现滤液仍然浑浊,可能的原因是
(4)“灼烧氧化”发生反应的化学方程式为
(5)若工业上“灼烧氧化”174.0 t FeCO3得到117.6 t产品,则该产品中Fe2O3的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】“鲜花保鲜剂”能延长鲜花的寿命,使人愉悦身心。如表是500mL“鲜花保鲜剂”中含有的成分,阅读后完成以下问题:
(1)500mL“鲜花保鲜剂”中硫酸钾的物质的量是___________ ,溶液中含___________ 个SO ,溶液中SO
,溶液中SO 的物质的量浓度是
的物质的量浓度是___________ mol/L。
(2)鉴定“鲜花保鲜剂”中含有K+的实验方法为___________。
(3)某同学在配制500mL“鲜花保鲜剂”溶液时,向容量瓶中转移溶液的操作如图所示,请指出图中的两处错误。①___________ ;②___________ 。

(4)本实验中,会用到胶头滴管,作用及操作是___________ 。
(5)在溶液配制过程中,下列操作造成所得溶液浓度偏小的是___________。
| 成分 | 质量(g) |
| 蔗糖(C12H22O11) | 25.000 |
| 硫酸钾 | 0.870 |
| 阿司匹林 | 0.180 |
| 高锰酸钾 | 0.316 |
| 硝酸银 | 0.075 |
(1)500mL“鲜花保鲜剂”中硫酸钾的物质的量是
 ,溶液中SO
,溶液中SO 的物质的量浓度是
的物质的量浓度是(2)鉴定“鲜花保鲜剂”中含有K+的实验方法为___________。
| A.显色法 | B.沉淀法 | C.气体法 | D.焰色试验 |
(3)某同学在配制500mL“鲜花保鲜剂”溶液时,向容量瓶中转移溶液的操作如图所示,请指出图中的两处错误。①

(4)本实验中,会用到胶头滴管,作用及操作是
(5)在溶液配制过程中,下列操作造成所得溶液浓度偏小的是___________。
| A.定容时俯视容量瓶刻度线 |
| B.容量瓶未干燥,里面有少量蒸馏水 |
| C.溶液由烧杯转移到容量瓶时有少量溶液溅到瓶外 |
| D.定容摇匀后发现液面低于容量瓶的刻度线,未做处理 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】实验室用63%的浓 (其密度为
(其密度为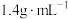 )配制240mL
)配制240mL 稀
稀 。
。
(1)此浓硝酸的物质的量浓度为_______  ,需要63%的浓硝酸
,需要63%的浓硝酸_______ mL。
(2)实验时还需选用的仪器有烧杯、玻璃棒、胶头滴管、_______ 、_______ 。
(3)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是_______ (填序号)。
①量取浓硝酸时俯视读数
②量取浓硝酸后的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
③容量瓶使用时未干燥
④定容时俯视刻度线
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
 (其密度为
(其密度为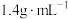 )配制240mL
)配制240mL 稀
稀 。
。(1)此浓硝酸的物质的量浓度为
 ,需要63%的浓硝酸
,需要63%的浓硝酸(2)实验时还需选用的仪器有烧杯、玻璃棒、胶头滴管、
(3)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是
①量取浓硝酸时俯视读数
②量取浓硝酸后的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
③容量瓶使用时未干燥
④定容时俯视刻度线
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】复方硫酸亚铁胶囊是一种补充铁剂的药物,用于防治缺铁性贫血。某名牌硫酸亚铁补铁剂每粒胶囊含铁60毫克。某研究性学习小组利用实验验证该药物中铁含量是否合格,通过查阅资料获知:
i.该胶囊中铁的存在形式为:FeSO4·7H2O,易溶于水。
ii.KMnO4溶液呈紫红色,广泛用作氧化剂,在酸性环境下能与FeSO4溶液反应,同时紫红色消失,反应方程式为:10FeSO4+2KMnO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O
iii.KMnO4式量158,常温下为紫黑色结晶或颗粒。
现设计实验操作如下(设该药片中的其他成分不与KMnO4反应):
①配制0.10mol/LKMnO4溶液
②取10粒该胶囊中的粉末,加入100.00mL蒸馏水充分溶解
③加入0.10mol/LKMnO4溶液,记下所消耗KMnO4溶液的体积
(1)测定过程中发生反应的离子方程式为_______ 。
(2)现配制250mL0.10mol/LKMnO4溶液,则需要_______ gKMnO4固体,选择的玻璃仪器有_______ 。
(3)在称量KMnO4固体之后,进行了下列操作:
①待KMnO4溶液的温度与室温一致后,沿玻璃棒注入容量瓶中
②往容量瓶中加蒸馏水至液面离容量瓶刻度线1~2cm,该用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切
③将称好的KMnO4固体放入烧杯中,加入适量蒸馏水,并用玻璃棒搅动,使其混合均匀
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶
上述操作中,正确的顺序是(填序号)____ 。
(4)某同学进行了3次测定,所得消耗KMnO4溶液的体积数据如下:
根据这个同学的实验数据,计算每粒胶囊中铁含量____ (填“是”、“否”)合格。
(5)维生素C是一种很好的还原剂,有人说该补铁剂和维生素C一起服用,更有利于吸收,你认为是否合理__ ,原因是__ 。
i.该胶囊中铁的存在形式为:FeSO4·7H2O,易溶于水。
ii.KMnO4溶液呈紫红色,广泛用作氧化剂,在酸性环境下能与FeSO4溶液反应,同时紫红色消失,反应方程式为:10FeSO4+2KMnO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O
iii.KMnO4式量158,常温下为紫黑色结晶或颗粒。
现设计实验操作如下(设该药片中的其他成分不与KMnO4反应):
①配制0.10mol/LKMnO4溶液
②取10粒该胶囊中的粉末,加入100.00mL蒸馏水充分溶解
③加入0.10mol/LKMnO4溶液,记下所消耗KMnO4溶液的体积
(1)测定过程中发生反应的离子方程式为
(2)现配制250mL0.10mol/LKMnO4溶液,则需要
(3)在称量KMnO4固体之后,进行了下列操作:
①待KMnO4溶液的温度与室温一致后,沿玻璃棒注入容量瓶中
②往容量瓶中加蒸馏水至液面离容量瓶刻度线1~2cm,该用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切
③将称好的KMnO4固体放入烧杯中,加入适量蒸馏水,并用玻璃棒搅动,使其混合均匀
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶
上述操作中,正确的顺序是(填序号)
(4)某同学进行了3次测定,所得消耗KMnO4溶液的体积数据如下:
| 测定次数 | 1 | 2 | 3 |
| V[KMnO4(aq)]/mL | 20.00 | 20.10 | 19.90 |
(5)维生素C是一种很好的还原剂,有人说该补铁剂和维生素C一起服用,更有利于吸收,你认为是否合理
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】已知氯化亚铁的熔点674℃、沸点1023℃;三氯化铁在300℃以上易升华,易溶于水并且有强烈的吸水性。在500℃条件下氯化亚铁与氧气可能发生多种反应,反应之一为:12FeCl2 +3O2 2Fe2O3 +8FeCl3。某研究小组选用以下装置(夹持装置省略,装置可重复选用)进行反应的探究。回答下列问题:
2Fe2O3 +8FeCl3。某研究小组选用以下装置(夹持装置省略,装置可重复选用)进行反应的探究。回答下列问题:
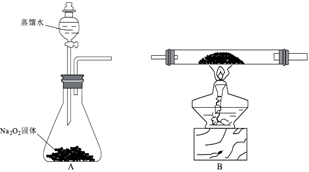

(1)装置的合理连接顺序为A、_____________ 、D,其中E装置U形管左边设计为粗导管的目的是__________________ 。
(2)A装置中发生反应的化学方程式为__________________________ 。
(3)反应过程发现,装置B中除生成红棕色固体外,还观察到黄绿色气体,生成该气体的化学方程式为____________________________ 。
(4)待B中充分反应后,停止加热后,还需持续通氧气至_______________ 。
(5)设计实验:
①利用E装置U形管里的固体验证Fe(OH)3是弱碱:_________________________________ 。
②测定装置B的残留固体中铁元素的质量分数:_____________________________________ 。
 2Fe2O3 +8FeCl3。某研究小组选用以下装置(夹持装置省略,装置可重复选用)进行反应的探究。回答下列问题:
2Fe2O3 +8FeCl3。某研究小组选用以下装置(夹持装置省略,装置可重复选用)进行反应的探究。回答下列问题:

(1)装置的合理连接顺序为A、
(2)A装置中发生反应的化学方程式为
(3)反应过程发现,装置B中除生成红棕色固体外,还观察到黄绿色气体,生成该气体的化学方程式为
(4)待B中充分反应后,停止加热后,还需持续通氧气至
(5)设计实验:
①利用E装置U形管里的固体验证Fe(OH)3是弱碱:
②测定装置B的残留固体中铁元素的质量分数:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】碲是ⅥA 族元素,其单质和化合物在化工生产等方面具有广泛地应用。
(1)TeO2 是两性氧化物,微溶于水,可溶于强酸或强碱。TeO2 和足量 NaOH 溶液发生反应的离子方程式为_____ 。
(2)从粗铜精炼的阳极泥(主要含有 Cu2Te)中提取粗碲的一种工艺流程如图:
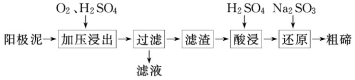
①已知加压酸浸时控制溶液的 pH 为 5.0,生成 TeO2 沉淀。如果 H2SO4 溶液浓度过大,产生 的后果是______________________________________________ 。
②对滤渣“酸浸”后,将 Na2SO3 加入 Te(SO4)2 溶液中进行“还原”得到固态碲,该反应的离子 方程式是______________________________________________ 。
③“还原”得到固态碲后分离出粗碲后,对粗碲进行洗涤,判断洗涤干净的实验操作和现象是_____ 。
(3)已知阳极泥中 Cu2Te 的含量为 a%,则 m 吨阳极泥理论上可制得纯度为 n%的粗碲_____ 吨。
(1)TeO2 是两性氧化物,微溶于水,可溶于强酸或强碱。TeO2 和足量 NaOH 溶液发生反应的离子方程式为
(2)从粗铜精炼的阳极泥(主要含有 Cu2Te)中提取粗碲的一种工艺流程如图:

①已知加压酸浸时控制溶液的 pH 为 5.0,生成 TeO2 沉淀。如果 H2SO4 溶液浓度过大,产生 的后果是
②对滤渣“酸浸”后,将 Na2SO3 加入 Te(SO4)2 溶液中进行“还原”得到固态碲,该反应的离子 方程式是
③“还原”得到固态碲后分离出粗碲后,对粗碲进行洗涤,判断洗涤干净的实验操作和现象是
(3)已知阳极泥中 Cu2Te 的含量为 a%,则 m 吨阳极泥理论上可制得纯度为 n%的粗碲
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】利用电解铜废液(主要成分是 、
、 等)浸出烟尘(主要成分是CuO、ZnO、PbO等)制备硫酸铜和硫酸锌的工艺路线如图所示。
等)浸出烟尘(主要成分是CuO、ZnO、PbO等)制备硫酸铜和硫酸锌的工艺路线如图所示。

已知:有机物HR难溶于水,可以捕获 ,其原理为
,其原理为 。
。
回答下列问题:
(1)“浸出”时,为了提高浸出率,可以采取措施___________ (答两种),滤渣的主要成分是___________ (写化学式),写出ZnO和硫酸反应的离子方程式___________ 。
(2)浸出率随电解废液用量的变化如下图,最佳电解废液用量是___________ mL/g。

(3)“水层”经___________ 、___________ 、过滤、洗涤,得到 晶体。
晶体。
(4)“反蒸”时可以加入___________,有利于硫酸铜固体析出。
(5)已知: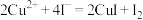 ,
, 。称取硫酸铜固体5.0g,加入适量稀硫酸和水配成溶液,加入过量的KI溶液(杂质不参与反应),再加入几滴淀粉溶液,用
。称取硫酸铜固体5.0g,加入适量稀硫酸和水配成溶液,加入过量的KI溶液(杂质不参与反应),再加入几滴淀粉溶液,用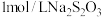 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液30mL,硫酸铜固体的纯度为
溶液30mL,硫酸铜固体的纯度为______ 。
 、
、 等)浸出烟尘(主要成分是CuO、ZnO、PbO等)制备硫酸铜和硫酸锌的工艺路线如图所示。
等)浸出烟尘(主要成分是CuO、ZnO、PbO等)制备硫酸铜和硫酸锌的工艺路线如图所示。
已知:有机物HR难溶于水,可以捕获
 ,其原理为
,其原理为 。
。回答下列问题:
(1)“浸出”时,为了提高浸出率,可以采取措施
(2)浸出率随电解废液用量的变化如下图,最佳电解废液用量是

(3)“水层”经
 晶体。
晶体。(4)“反蒸”时可以加入___________,有利于硫酸铜固体析出。
| A.HR | B.硫酸溶液 | C.蒸馏水 | D.NaOH溶液 |
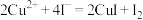 ,
, 。称取硫酸铜固体5.0g,加入适量稀硫酸和水配成溶液,加入过量的KI溶液(杂质不参与反应),再加入几滴淀粉溶液,用
。称取硫酸铜固体5.0g,加入适量稀硫酸和水配成溶液,加入过量的KI溶液(杂质不参与反应),再加入几滴淀粉溶液,用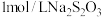 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液30mL,硫酸铜固体的纯度为
溶液30mL,硫酸铜固体的纯度为
您最近一年使用:0次



