1 . K2FeO4是常见的水处理剂,其原理如图所示。请回答下列问题:
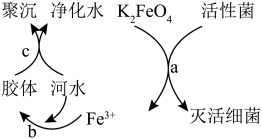
(1)高铁酸钾(K2FeO4)中铁元素的化合价为________ .
(2)过程a中K2FeO4体现________ (填“氧化”或“还原”)性,氧化产物是________ 。
(3)过程b反应的离子方程式为________ ,过程c属于________ (填“物理”或“化学”)变化。
(4)碱性条件下用Fe(OH)3和KClO反应制备K2FeO4。配平其反应的化学方程式:________ 。
Fe(OH)3+_______KOH+_______KClO=_______ K2FeO4+_______KCl+_______H2O
(5)根据以上K2FeO4净水原理,相比于Cl2,其优点是________ 。

(1)高铁酸钾(K2FeO4)中铁元素的化合价为
(2)过程a中K2FeO4体现
(3)过程b反应的离子方程式为
(4)碱性条件下用Fe(OH)3和KClO反应制备K2FeO4。配平其反应的化学方程式:
Fe(OH)3+_______KOH+_______KClO=_______ K2FeO4+_______KCl+_______H2O
(5)根据以上K2FeO4净水原理,相比于Cl2,其优点是
您最近一年使用:0次
解题方法
2 . 水体中过量氨氮(以NH3表示)含量过高会导致水体富营养化。用次氯酸钠除去氨氮的一种原理如图所示。下列说法正确的是
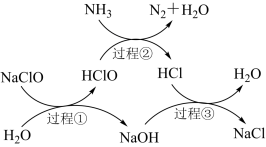

| A.过程①②③均属于氧化还原反应 |
| B.在较高温度下,氨氮去除率会降低 |
| C.每生成一个N2分子,转移6个电子 |
D.过程②中氧化剂与还原剂的物质的量之比是 |
您最近一年使用:0次
解题方法
3 . 根据所学知识回答下列问题:
(1)H2O2是常见氧化剂,为了验证其氧化性,进行了下列实验:
①取2mLH2O2于试管中,通入H2S气体,溶液变浑浊,反应的化学方程式为__________ 。
②有同学认为Na2SO3也有还原性,可以选择其作为试剂验证H2O2氧化性。该观点是否正确,请从化合价的角度说明理由:__________ 。
(2)饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,某饮用水研究人员提出两种处理方案:
的浓度,某饮用水研究人员提出两种处理方案:
方案一:碱性条件下用 还原[氧化产物为
还原[氧化产物为 ]
] 生成
生成 ,反应中氧化剂和还原剂物质的量之比为
,反应中氧化剂和还原剂物质的量之比为__________ 。
方案二:在碱性条件下,用铝粉处理,已知反应时Al与 为
为 ,且Al转化为
,且Al转化为 ,被氧化的元素是
,被氧化的元素是__________ ,还原产物是__________ ,请写出反应的离子方程式:__________ 。
(1)H2O2是常见氧化剂,为了验证其氧化性,进行了下列实验:
①取2mLH2O2于试管中,通入H2S气体,溶液变浑浊,反应的化学方程式为
②有同学认为Na2SO3也有还原性,可以选择其作为试剂验证H2O2氧化性。该观点是否正确,请从化合价的角度说明理由:
(2)饮用水中的
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,某饮用水研究人员提出两种处理方案:
的浓度,某饮用水研究人员提出两种处理方案:方案一:碱性条件下用
 还原[氧化产物为
还原[氧化产物为 ]
] 生成
生成 ,反应中氧化剂和还原剂物质的量之比为
,反应中氧化剂和还原剂物质的量之比为方案二:在碱性条件下,用铝粉处理,已知反应时Al与
 为
为 ,且Al转化为
,且Al转化为 ,被氧化的元素是
,被氧化的元素是
您最近一年使用:0次
解题方法
4 . 物质分类与转化是学习化学的基石,如图为氯及其化合物的“价-类”二维图,请正确回答下列问题:
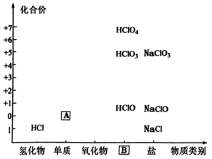
(1)填写二维图缺失的内容:化学式A__________ ;类别B__________ 。
(2)A可与热的 浓溶液反应生成
浓溶液反应生成 和
和 ,写出反应的化学方程式
,写出反应的化学方程式__________ 。
(3)关于盐酸与 反应,同学们有不同意见,甲同学认为发生反应:
反应,同学们有不同意见,甲同学认为发生反应: ,该反应属于
,该反应属于__________ 反应类型(填四大基本反应类型);乙同学认为发生氧化还原反应,因为他曾经看到一篇报道称:某家庭主妇在清洗卫生间时,因混合使用“洁厕灵”(主要成分是稀盐酸)与“84”消毒液(主要成分是 )而发生氯气中毒事件。请写出反应方程式
)而发生氯气中毒事件。请写出反应方程式__________ ,该反应从化合价角度体现了盐酸具有__________ 性。

(1)填写二维图缺失的内容:化学式A
(2)A可与热的
 浓溶液反应生成
浓溶液反应生成 和
和 ,写出反应的化学方程式
,写出反应的化学方程式(3)关于盐酸与
 反应,同学们有不同意见,甲同学认为发生反应:
反应,同学们有不同意见,甲同学认为发生反应: ,该反应属于
,该反应属于 )而发生氯气中毒事件。请写出反应方程式
)而发生氯气中毒事件。请写出反应方程式
您最近一年使用:0次
5 . 钠是一种非常活泼、具有广泛应用的金属。
(1)金属钠非常活泼,通常保存在___________ 里,以隔绝空气。
(2)汽车安全气囊的气体发生剂 :可由金属钠生产。某汽车安全气囊内含
:可由金属钠生产。某汽车安全气囊内含 、
、 和
和 等物质。
等物质。
①当汽车发生较严重的碰撞时,引发 分解
分解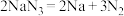 ,从而为气囊充气。用单线桥表示该反应电子转移的方向数目
,从而为气囊充气。用单线桥表示该反应电子转移的方向数目___________ 。
②产生的Na立即与 发生置换反应生成
发生置换反应生成 ,化学方程式是:
,化学方程式是:___________ 。
③ 是冷却剂,吸收产气过程释放的热量。
是冷却剂,吸收产气过程释放的热量。 起冷却作用时发生反应的化学方程式为:
起冷却作用时发生反应的化学方程式为:___________ 。
(3)工业通过电解NaCl生产金属钠: ,过程如图:
,过程如图:
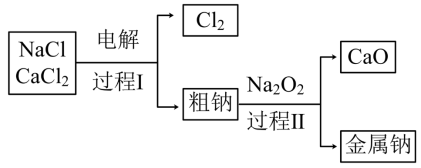
已知:电解时需要将NaCl加热至熔融状态。NaCl的熔点为801℃,为降低能耗,通常加入 从而把培点降至约580℃。
从而把培点降至约580℃。
①NaCl固体加热至熔融状态,目的是___________ 。
②粗钠中含有少量杂质Ca,过程Ⅱ在加热条件下除去Ca的化学方程式是:___________ 。
③过程Ⅰ中, 能发生像NaCl那样的电解反应而被消耗。但在过程1中
能发生像NaCl那样的电解反应而被消耗。但在过程1中 却不断地被重新生成,原因是:
却不断地被重新生成,原因是:___________ 。
(1)金属钠非常活泼,通常保存在
(2)汽车安全气囊的气体发生剂
 :可由金属钠生产。某汽车安全气囊内含
:可由金属钠生产。某汽车安全气囊内含 、
、 和
和 等物质。
等物质。①当汽车发生较严重的碰撞时,引发
 分解
分解 ,从而为气囊充气。用单线桥表示该反应电子转移的方向数目
,从而为气囊充气。用单线桥表示该反应电子转移的方向数目②产生的Na立即与
 发生置换反应生成
发生置换反应生成 ,化学方程式是:
,化学方程式是:③
 是冷却剂,吸收产气过程释放的热量。
是冷却剂,吸收产气过程释放的热量。 起冷却作用时发生反应的化学方程式为:
起冷却作用时发生反应的化学方程式为:(3)工业通过电解NaCl生产金属钠:
 ,过程如图:
,过程如图:
已知:电解时需要将NaCl加热至熔融状态。NaCl的熔点为801℃,为降低能耗,通常加入
 从而把培点降至约580℃。
从而把培点降至约580℃。①NaCl固体加热至熔融状态,目的是
②粗钠中含有少量杂质Ca,过程Ⅱ在加热条件下除去Ca的化学方程式是:
③过程Ⅰ中,
 能发生像NaCl那样的电解反应而被消耗。但在过程1中
能发生像NaCl那样的电解反应而被消耗。但在过程1中 却不断地被重新生成,原因是:
却不断地被重新生成,原因是:
您最近一年使用:0次
解题方法
6 . 以软锰矿(含 及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯
及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯 的实验步骤如下:
的实验步骤如下:
(1)浸取。实验室浸取软锰矿的装置如图所示:
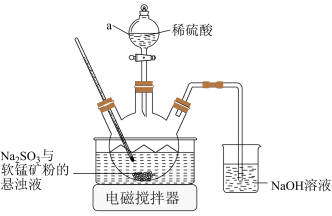
①为了提高软锰矿的浸出速率和浸取率,上述装置中采取的措施有_____ 。(答出一点即可)
②仪器a为_____ ;NaOH溶液的作用是_____ 。
③反应通常在70℃下反应,写出 转化为
转化为 的离子方程式
的离子方程式_____ 。
(2)除杂。向已经除去铁、铝、硅元素的 溶液(pH约为5)中加入NaF溶液,溶液中
溶液(pH约为5)中加入NaF溶液,溶液中 、
、 形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为
形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为_____ (用必要的离子方程式结合勒夏特列原理解释)。
(3)沉锰。向 溶液中缓慢滴加
溶液中缓慢滴加 溶液,过滤、洗涤、干燥,得到
溶液,过滤、洗涤、干燥,得到 固体。解释生成
固体。解释生成 固体所需要的平衡理论有
固体所需要的平衡理论有_____ 。
a、 的沉淀溶解平衡 b、
的沉淀溶解平衡 b、 的水解平衡 c、
的水解平衡 c、 的电离平衡 d、
的电离平衡 d、 的电离平衡
的电离平衡
(4)热解。将 置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、
置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、 ,加热,充分反应后过滤、洗涤、干燥,即可获得高纯
,加热,充分反应后过滤、洗涤、干燥,即可获得高纯 (已知:加热条件下
(已知:加热条件下 在酸性溶液中转化为
在酸性溶液中转化为 和
和 )。检验是否“洗涤”干净的操作方法为
)。检验是否“洗涤”干净的操作方法为_____ 。
 及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯
及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯 的实验步骤如下:
的实验步骤如下:(1)浸取。实验室浸取软锰矿的装置如图所示:

①为了提高软锰矿的浸出速率和浸取率,上述装置中采取的措施有
②仪器a为
③反应通常在70℃下反应,写出
 转化为
转化为 的离子方程式
的离子方程式(2)除杂。向已经除去铁、铝、硅元素的
 溶液(pH约为5)中加入NaF溶液,溶液中
溶液(pH约为5)中加入NaF溶液,溶液中 、
、 形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为
形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为(3)沉锰。向
 溶液中缓慢滴加
溶液中缓慢滴加 溶液,过滤、洗涤、干燥,得到
溶液,过滤、洗涤、干燥,得到 固体。解释生成
固体。解释生成 固体所需要的平衡理论有
固体所需要的平衡理论有a、
 的沉淀溶解平衡 b、
的沉淀溶解平衡 b、 的水解平衡 c、
的水解平衡 c、 的电离平衡 d、
的电离平衡 d、 的电离平衡
的电离平衡(4)热解。将
 置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、
置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、 ,加热,充分反应后过滤、洗涤、干燥,即可获得高纯
,加热,充分反应后过滤、洗涤、干燥,即可获得高纯 (已知:加热条件下
(已知:加热条件下 在酸性溶液中转化为
在酸性溶液中转化为 和
和 )。检验是否“洗涤”干净的操作方法为
)。检验是否“洗涤”干净的操作方法为
您最近一年使用:0次
名校
解题方法
7 . 次氯酸消毒液高效安全,适用于一般物体表面消毒、空间和环境消毒。实验室利用如下装置制取氯气并制取次氯酸消毒液。
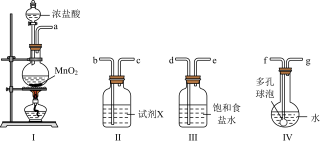
回答下列问题:
(1)装置合理的连接顺序为a→___________ (按气流方向填各接口的编号)。
(2)装置Ⅰ中反应的化学方程式是___________ 。
(3)装置Ⅱ中试剂X是___________ ;装置Ⅲ的作用是___________ ;装置Ⅳ中多孔球泡的作用为___________ 。
(4)反应结束后,取V中少量液体于试管中,滴入几滴石蕊观察到的现象是___________ ,请结合离子方程式说明原因___________ 。

回答下列问题:
(1)装置合理的连接顺序为a→
(2)装置Ⅰ中反应的化学方程式是
(3)装置Ⅱ中试剂X是
(4)反应结束后,取V中少量液体于试管中,滴入几滴石蕊观察到的现象是
您最近一年使用:0次
名校
8 . 高效灭菌消毒剂 气态时不稳定,受热或光照易分解,浓度过高时甚至会发生爆炸。工业上通常以氯酸盐(
气态时不稳定,受热或光照易分解,浓度过高时甚至会发生爆炸。工业上通常以氯酸盐( )、过氧化氢和碳酸盐为主要原料制备稳定性
)、过氧化氢和碳酸盐为主要原料制备稳定性 溶液的流程如图:
溶液的流程如图:
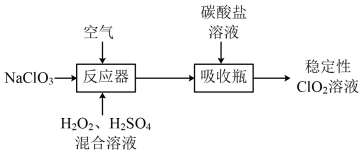
(1)①反应器中发生的主要反应为_________ (离子方程式)。
②制备时向反应器中通入空气的作用是_________ 。
(2)反应器中的反应温度控制在80℃左右为宜。
①工业上采用的加热方式为_________ 。
②当温度超过80℃, 的收率
的收率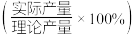 随温度升高而减小,其原因可能是
随温度升高而减小,其原因可能是_________ (写出两条即可)。
(3)吸收瓶中发生反应 获得稳定性
获得稳定性 溶液。当有
溶液。当有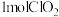 参加反应,转移的电子数为
参加反应,转移的电子数为_________  。
。
(4)亚氯酸钠( )也是一种高效的消毒剂和漂白剂。
)也是一种高效的消毒剂和漂白剂。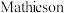 法制备亚氯酸钠的流程如下:
法制备亚氯酸钠的流程如下:
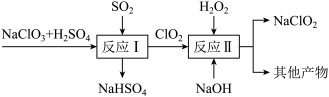
请写出反应 的化学方程式
的化学方程式_________ ;反应 中的其他产物包含
中的其他产物包含_________ 。
 气态时不稳定,受热或光照易分解,浓度过高时甚至会发生爆炸。工业上通常以氯酸盐(
气态时不稳定,受热或光照易分解,浓度过高时甚至会发生爆炸。工业上通常以氯酸盐( )、过氧化氢和碳酸盐为主要原料制备稳定性
)、过氧化氢和碳酸盐为主要原料制备稳定性 溶液的流程如图:
溶液的流程如图:
(1)①反应器中发生的主要反应为
②制备时向反应器中通入空气的作用是
(2)反应器中的反应温度控制在80℃左右为宜。
①工业上采用的加热方式为
②当温度超过80℃,
 的收率
的收率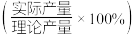 随温度升高而减小,其原因可能是
随温度升高而减小,其原因可能是(3)吸收瓶中发生反应
 获得稳定性
获得稳定性 溶液。当有
溶液。当有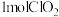 参加反应,转移的电子数为
参加反应,转移的电子数为 。
。(4)亚氯酸钠(
 )也是一种高效的消毒剂和漂白剂。
)也是一种高效的消毒剂和漂白剂。 法制备亚氯酸钠的流程如下:
法制备亚氯酸钠的流程如下:
请写出反应
 的化学方程式
的化学方程式 中的其他产物包含
中的其他产物包含
您最近一年使用:0次
名校
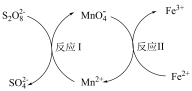
9 . 实验室常用 标定
标定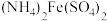 ,同时使
,同时使 再生,其反应原理如图所示。下列说法错误的是
再生,其反应原理如图所示。下列说法错误的是
 标定
标定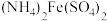 ,同时使
,同时使 再生,其反应原理如图所示。下列说法错误的是
再生,其反应原理如图所示。下列说法错误的是
A.反应I中 是还原剂 是还原剂 |
B. 和 和 在水溶液中不能大量共存 在水溶液中不能大量共存 |
C.由反应 、 、 可知,氧化性: 可知,氧化性: |
D.反应 的离子方程式为: 的离子方程式为: |
您最近一年使用:0次
名校
解题方法
10 . 下列离子方程式正确的是
A. 与 与 溶液的反应: 溶液的反应: |
B.向澄清石灰水中滴加少量 溶液: 溶液: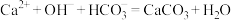 |
C.制备 胶体: 胶体: |
D.酸性 溶液和双氧水混合: 溶液和双氧水混合: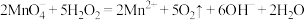 |
您最近一年使用:0次



