名校
1 . 二氯异氰尿酸钠(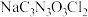 )是一种高效广谱杀菌消毒剂,它常温下为白色固体,难溶于冷水。工业上合成二氯异氰尿酸钠的方法有多种,其中NaClO法是向NaOH溶液通入
)是一种高效广谱杀菌消毒剂,它常温下为白色固体,难溶于冷水。工业上合成二氯异氰尿酸钠的方法有多种,其中NaClO法是向NaOH溶液通入 产生高浓度NaClO溶液,然后与氰尿酸(
产生高浓度NaClO溶液,然后与氰尿酸( )反应制取二氯异氰尿酸钠。从下面选择所需装置完成实验。
)反应制取二氯异氰尿酸钠。从下面选择所需装置完成实验。
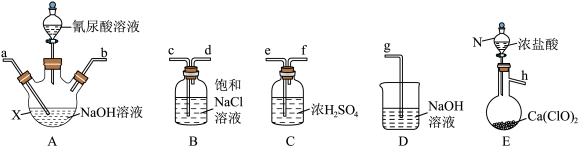
已知:
回答下列问题:
(1)按气流从左至右,导管口连接顺序为___________ 。(填小写字母)
(2)若发现实际操作过程中仪器N中浓盐酸不易流下,可将仪器N换为___________ 。
(3)装置A中制备NaClO溶液完成的现象是___________ ,在加氰尿酸溶液过程仍需不断通入 的理由是
的理由是___________ 。实验过程中若温度过度,pH过小会生成 ,写出
,写出 生成
生成 的化学方程式
的化学方程式______________________ 。
(4)有效氯含量是判断产品质量的标准。实验采用碘量法测定产物有效氯的含量,原理为: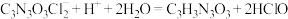 ,
, ,
, ,准确称取0.5600g样品,配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用0.1000mol/L
,准确称取0.5600g样品,配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用0.1000mol/L  标准溶液滴定至溶液呈微黄色,加入指示剂继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入指示剂继续滴定至终点,消耗 溶液15.00mL。
溶液15.00mL。
①配制样品溶液时,需要用到的玻璃仪器除烧杯、玻璃棒和量筒外,还需要___________ 。
②滴定至溶液呈微黄色时,加入的指示剂是___________ ,该样品的有效氯为___________ %。(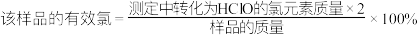 ,保留三位有效数字)
,保留三位有效数字)
③下列操作将导致样品有效氯测定值偏低的是___________ (填标号)。
a.碘量瓶中加入稀硫酸的量过少
b.滴定前滴定管未排气泡滴定后气泡消失
c.读数时,滴定前仰视、滴定后俯视
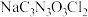 )是一种高效广谱杀菌消毒剂,它常温下为白色固体,难溶于冷水。工业上合成二氯异氰尿酸钠的方法有多种,其中NaClO法是向NaOH溶液通入
)是一种高效广谱杀菌消毒剂,它常温下为白色固体,难溶于冷水。工业上合成二氯异氰尿酸钠的方法有多种,其中NaClO法是向NaOH溶液通入 产生高浓度NaClO溶液,然后与氰尿酸(
产生高浓度NaClO溶液,然后与氰尿酸( )反应制取二氯异氰尿酸钠。从下面选择所需装置完成实验。
)反应制取二氯异氰尿酸钠。从下面选择所需装置完成实验。
已知:

回答下列问题:
(1)按气流从左至右,导管口连接顺序为
(2)若发现实际操作过程中仪器N中浓盐酸不易流下,可将仪器N换为
(3)装置A中制备NaClO溶液完成的现象是
 的理由是
的理由是 ,写出
,写出 生成
生成 的化学方程式
的化学方程式(4)有效氯含量是判断产品质量的标准。实验采用碘量法测定产物有效氯的含量,原理为:
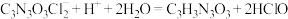 ,
, ,
, ,准确称取0.5600g样品,配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用0.1000mol/L
,准确称取0.5600g样品,配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用0.1000mol/L  标准溶液滴定至溶液呈微黄色,加入指示剂继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入指示剂继续滴定至终点,消耗 溶液15.00mL。
溶液15.00mL。①配制样品溶液时,需要用到的玻璃仪器除烧杯、玻璃棒和量筒外,还需要
②滴定至溶液呈微黄色时,加入的指示剂是
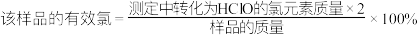 ,保留三位有效数字)
,保留三位有效数字)③下列操作将导致样品有效氯测定值偏低的是
a.碘量瓶中加入稀硫酸的量过少
b.滴定前滴定管未排气泡滴定后气泡消失
c.读数时,滴定前仰视、滴定后俯视
您最近一年使用:0次
2023-11-23更新
|
280次组卷
|
3卷引用:山东省济南市2023-2024学年高三上学期11月期中考试化学试题
解题方法
2 . 钒酸钇(YVO4)广泛应用于光纤通信领域,一种用废钒催化剂(含 V2O5、K2O、SiO2少量Fe2O3制取YVO4的工艺流程如下:

已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。 回答下列问题:
(1)V2O2(OH)4中V元素的化合价为___________ 。
(2)“还原酸浸”时,钒以VO2+浸出,“浸出液”中还含有的金属离子是___________ 。V2O5被还原的离子方程式为___________ 。
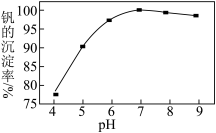
(3)常温下,“钒、钾分离”时,pH 对钒的沉淀率的影响如图所示:pH>7时,随pH增大钒的沉淀率降低的原因可能是___________ 。
(4)结合“碱溶”和“沉钒”可知, 、
、 氧化性更强的是
氧化性更强的是___________ ,“沉钒”时发生反应的化学方程式为___________ 。
(5)某废钒催化剂中V2O5的含量为26.0%,某工厂用1吨该废钒催化剂且用该工艺流程生产YVO4,整个流程中V的损耗率为30.0%,则最终得到 YVO4___________ 。

已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。 回答下列问题:
(1)V2O2(OH)4中V元素的化合价为
(2)“还原酸浸”时,钒以VO2+浸出,“浸出液”中还含有的金属离子是
(3)常温下,“钒、钾分离”时,pH 对钒的沉淀率的影响如图所示:pH>7时,随pH增大钒的沉淀率降低的原因可能是

(4)结合“碱溶”和“沉钒”可知,
 、
、 氧化性更强的是
氧化性更强的是(5)某废钒催化剂中V2O5的含量为26.0%,某工厂用1吨该废钒催化剂且用该工艺流程生产YVO4,整个流程中V的损耗率为30.0%,则最终得到 YVO4
您最近一年使用:0次
名校
3 . 二氧化氯消毒剂是国际公认的高效消毒灭菌剂。
(1)制备 的一种反应为:
的一种反应为: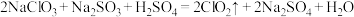 ,用单线桥法标出其电子转移的方向和数目
,用单线桥法标出其电子转移的方向和数目_____ 。
(2)实验室可用亚氯酸钠( )溶液与氯气反应制
)溶液与氯气反应制 ,此反应的化学方程式为
,此反应的化学方程式为_____ 。
(3) 可将废水中的
可将废水中的 转化为
转化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应中氧化剂与还原剂的物质的量之比是
,该反应中氧化剂与还原剂的物质的量之比是_____ 。
(4) 可经过题图所示的转化制取
可经过题图所示的转化制取 。已知“反应Ⅱ”为复分解反应。
。已知“反应Ⅱ”为复分解反应。
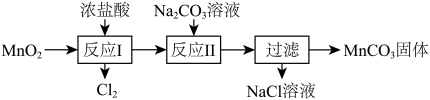
①“反应Ⅰ”的离子方程式为_____ 。
②过滤之后是洗涤,判断 沉淀是否洗涤干净的方法是
沉淀是否洗涤干净的方法是_____ 。
(5)一种“二氧化氯泡腾片”有效成分为 、
、 、
、 ,该泡腾片能快速溶于水,产生大量气泡,得到
,该泡腾片能快速溶于水,产生大量气泡,得到 溶液。取某品牌泡腾片1片溶于水配成
溶液。取某品牌泡腾片1片溶于水配成 溶液,为测定溶液中
溶液,为测定溶液中 的含量,进行了下列实验:
的含量,进行了下列实验:
①取该溶液 ,加入锥形瓶中,用稀硫酸调节溶液
,加入锥形瓶中,用稀硫酸调节溶液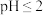 ,再加入足量
,再加入足量 晶体,发生反应:
晶体,发生反应: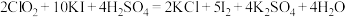
②用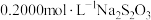 溶液和生成的碘单质反应,化学方程式如下:
溶液和生成的碘单质反应,化学方程式如下: ,恰好完全反应时消耗
,恰好完全反应时消耗 溶液
溶液 。则配成的
。则配成的 溶液中
溶液中 的物质的量浓度为
的物质的量浓度为_____ 。
(1)制备
 的一种反应为:
的一种反应为: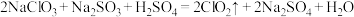 ,用单线桥法标出其电子转移的方向和数目
,用单线桥法标出其电子转移的方向和数目(2)实验室可用亚氯酸钠(
 )溶液与氯气反应制
)溶液与氯气反应制 ,此反应的化学方程式为
,此反应的化学方程式为(3)
 可将废水中的
可将废水中的 转化为
转化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应中氧化剂与还原剂的物质的量之比是
,该反应中氧化剂与还原剂的物质的量之比是(4)
 可经过题图所示的转化制取
可经过题图所示的转化制取 。已知“反应Ⅱ”为复分解反应。
。已知“反应Ⅱ”为复分解反应。
①“反应Ⅰ”的离子方程式为
②过滤之后是洗涤,判断
 沉淀是否洗涤干净的方法是
沉淀是否洗涤干净的方法是(5)一种“二氧化氯泡腾片”有效成分为
 、
、 、
、 ,该泡腾片能快速溶于水,产生大量气泡,得到
,该泡腾片能快速溶于水,产生大量气泡,得到 溶液。取某品牌泡腾片1片溶于水配成
溶液。取某品牌泡腾片1片溶于水配成 溶液,为测定溶液中
溶液,为测定溶液中 的含量,进行了下列实验:
的含量,进行了下列实验:①取该溶液
 ,加入锥形瓶中,用稀硫酸调节溶液
,加入锥形瓶中,用稀硫酸调节溶液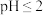 ,再加入足量
,再加入足量 晶体,发生反应:
晶体,发生反应: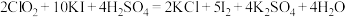
②用
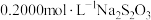 溶液和生成的碘单质反应,化学方程式如下:
溶液和生成的碘单质反应,化学方程式如下: ,恰好完全反应时消耗
,恰好完全反应时消耗 溶液
溶液 。则配成的
。则配成的 溶液中
溶液中 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
解题方法
4 . 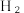 是一种理想的清洁能源,
是一种理想的清洁能源,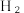 的制取与储存是氢能源利用领域的研究热点,探索绿色化制氢是化学界的一个热门话题。
的制取与储存是氢能源利用领域的研究热点,探索绿色化制氢是化学界的一个热门话题。
(1)氧缺位铁酸铜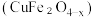 可用作太阳能热化学循环分解
可用作太阳能热化学循环分解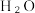 制取
制取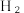 的催化剂。
的催化剂。
①氧缺位铁酸铜分解水制氢分为两步。已知第一步反应为: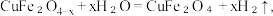 ,写出第二步反应的化学方程式
,写出第二步反应的化学方程式___________ 。
②下图为电化学方法获得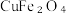 的原理装置图,写出其阳极的电极反应式
的原理装置图,写出其阳极的电极反应式___________ 。

(2)一种利用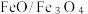 之间的相互转化,来裂解水制取
之间的相互转化,来裂解水制取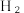 ,的工艺流程如下图所示。该工艺制氢的总反应为
,的工艺流程如下图所示。该工艺制氢的总反应为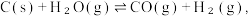 相比于水和碳在高温下直接接触反应来制氢,分析该工艺制氢的最大优点为
相比于水和碳在高温下直接接触反应来制氢,分析该工艺制氢的最大优点为___________ 。

(3)硼氢化钠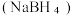 的强碱溶液在催化剂作用下可与水反应可获取
的强碱溶液在催化剂作用下可与水反应可获取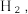 ,其可能的反应机理如下图所示。
,其可能的反应机理如下图所示。
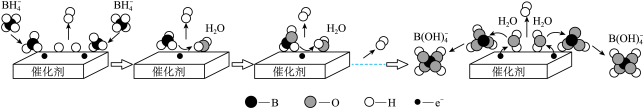
已知:常温下,NaB(OH)₄在水中的溶解度不大,易以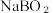 ₂形式结晶析出。
₂形式结晶析出。
①写出图示最后一个步骤的反应机理___________ 。
②用 来代替
来代替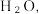 根据上述反应机理,反应后生成的气体中应含有
根据上述反应机理,反应后生成的气体中应含有___________ 。
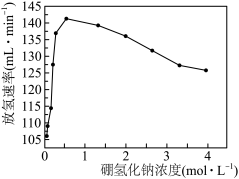
③其他条件相同时,测得平均每克催化剂使用量下,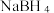 的浓度和放氢速率的变化关系如图所示。解释当
的浓度和放氢速率的变化关系如图所示。解释当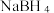 浓度大于
浓度大于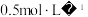 时,放氢速率减小的原因可能是
时,放氢速率减小的原因可能是___________ 。
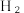 是一种理想的清洁能源,
是一种理想的清洁能源,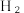 的制取与储存是氢能源利用领域的研究热点,探索绿色化制氢是化学界的一个热门话题。
的制取与储存是氢能源利用领域的研究热点,探索绿色化制氢是化学界的一个热门话题。(1)氧缺位铁酸铜
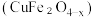 可用作太阳能热化学循环分解
可用作太阳能热化学循环分解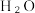 制取
制取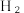 的催化剂。
的催化剂。①氧缺位铁酸铜分解水制氢分为两步。已知第一步反应为:
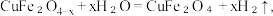 ,写出第二步反应的化学方程式
,写出第二步反应的化学方程式②下图为电化学方法获得
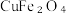 的原理装置图,写出其阳极的电极反应式
的原理装置图,写出其阳极的电极反应式
(2)一种利用
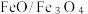 之间的相互转化,来裂解水制取
之间的相互转化,来裂解水制取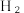 ,的工艺流程如下图所示。该工艺制氢的总反应为
,的工艺流程如下图所示。该工艺制氢的总反应为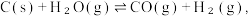 相比于水和碳在高温下直接接触反应来制氢,分析该工艺制氢的最大优点为
相比于水和碳在高温下直接接触反应来制氢,分析该工艺制氢的最大优点为
(3)硼氢化钠
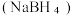 的强碱溶液在催化剂作用下可与水反应可获取
的强碱溶液在催化剂作用下可与水反应可获取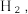 ,其可能的反应机理如下图所示。
,其可能的反应机理如下图所示。
已知:常温下,NaB(OH)₄在水中的溶解度不大,易以
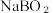 ₂形式结晶析出。
₂形式结晶析出。①写出图示最后一个步骤的反应机理
②用
 来代替
来代替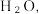 根据上述反应机理,反应后生成的气体中应含有
根据上述反应机理,反应后生成的气体中应含有③其他条件相同时,测得平均每克催化剂使用量下,
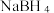 的浓度和放氢速率的变化关系如图所示。解释当
的浓度和放氢速率的变化关系如图所示。解释当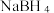 浓度大于
浓度大于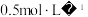 时,放氢速率减小的原因可能是
时,放氢速率减小的原因可能是
您最近一年使用:0次
名校
5 . 物质集合M中含有常见物质Na2O2、NaHCO3、Al、SO2、Fe、NH3、Na、Cl2,这些物质按照以下方法进行分类后如图所示,其中A组为单质,B组为化合物,请按照要求回答问题。
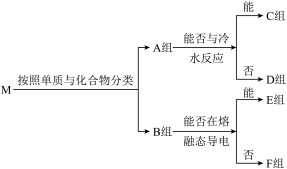
(1)该分类方法为_______ ,
(2)B组物质中属于非电解质的为_______ ,其中能作制冷剂的物质的电子式为_______ 。
(3)C组物质中有的能与水剧烈反应,该反应中氧化剂和还原剂物质的量之比为_______ 。
(4)D组物质中其中一种物质可以制备出另外一种物质,请写出一种该反应在工业上的应用:_______ 。
(5)请写出F组中的酸性氧化物与酸性KMnO4溶液反应的离子方程式:_______ 。
(6)在密闭容器中,将E组中的混合物加热反应,若混合物中金属原子与氧原子的物质的量之比为1:2,混合加热充分反应后,排出气体,剩余固体的成分为_______ ;

(1)该分类方法为
(2)B组物质中属于非电解质的为
(3)C组物质中有的能与水剧烈反应,该反应中氧化剂和还原剂物质的量之比为
(4)D组物质中其中一种物质可以制备出另外一种物质,请写出一种该反应在工业上的应用:
(5)请写出F组中的酸性氧化物与酸性KMnO4溶液反应的离子方程式:
(6)在密闭容器中,将E组中的混合物加热反应,若混合物中金属原子与氧原子的物质的量之比为1:2,混合加热充分反应后,排出气体,剩余固体的成分为
您最近一年使用:0次
2023-11-06更新
|
115次组卷
|
3卷引用:山东省聊城颐中外国语学校2023-2024学年高三上学期期中考试化学试题
解题方法
6 . 高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂。已知: K2FeO4易溶于水、微溶于浓碱溶液,不溶于乙醇,在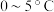 的强碱性溶液中较稳定。实验室中常用KClO在强碱性介质中与 Fe(NO3)3;溶液反应制备 K2FeO4,装置如图所示(夹持装置略)。
的强碱性溶液中较稳定。实验室中常用KClO在强碱性介质中与 Fe(NO3)3;溶液反应制备 K2FeO4,装置如图所示(夹持装置略)。
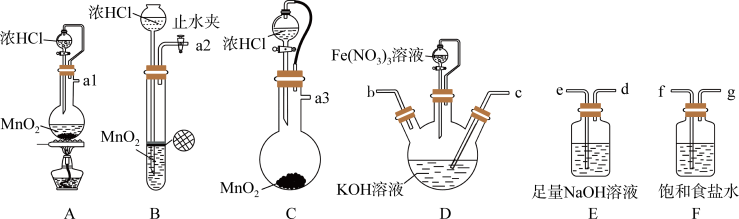
回答下列问题:
(1)D装置中盛装 Fe(NO3)3溶液的分液漏斗右侧的导管的作用是___________ 。
(2)选择上述装置制备K2FeO4,按气流从左到右的方向,合理的连接顺序为___________ (填仪器接口字母,仪器不可重复使用)。
(3)写出 KClO 在强碱性介质中与 Fe(NO3)3反应生成 K2FeO4的离子方程式___________ 。若滴加Fe(NO3)3溶液的速度过快,导致的后果是___________ 。
(4)制备的高铁酸钾粗产品中含有KCl、KOH等杂质,以下为提纯步骤:
①取一定量的高铁酸钾粗产品,溶于冷的稀KOH溶液;
②过滤,将滤液置于冰水浴中,向滤液中加入试剂 X;
③搅拌、静置、过滤,用乙醇洗涤2~3次,在真空干燥箱中干燥。
步骤②中加入的试剂 X是___________ (可供选择的试剂:蒸馏水、饱和 NaOH溶液、稀NaOH 溶液、饱和 KOH溶液、稀 KOH溶液),原因是___________ 。
(5)测定 K2FeO4产品的纯度:称取2.00 g制得的 K2FeO4,产品溶于适量___________ (填试剂名称)中,加入足量 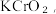 充分反应后过滤,将滤液转移到250mL容量瓶中定容。 以上溶液配制过程中需要用到玻璃棒,它的作用为
充分反应后过滤,将滤液转移到250mL容量瓶中定容。 以上溶液配制过程中需要用到玻璃棒,它的作用为___________ 。用___________ (填仪器名称)量取上述配置好的溶液25.00mL于试管中,一定条件下滴入  溶液充分反应,消耗溶液体积为 26.00 mL。 该K2FeO4样品的纯度为
溶液充分反应,消耗溶液体积为 26.00 mL。 该K2FeO4样品的纯度为___________ %。
已知: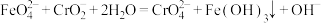
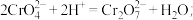

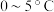 的强碱性溶液中较稳定。实验室中常用KClO在强碱性介质中与 Fe(NO3)3;溶液反应制备 K2FeO4,装置如图所示(夹持装置略)。
的强碱性溶液中较稳定。实验室中常用KClO在强碱性介质中与 Fe(NO3)3;溶液反应制备 K2FeO4,装置如图所示(夹持装置略)。
回答下列问题:
(1)D装置中盛装 Fe(NO3)3溶液的分液漏斗右侧的导管的作用是
(2)选择上述装置制备K2FeO4,按气流从左到右的方向,合理的连接顺序为
(3)写出 KClO 在强碱性介质中与 Fe(NO3)3反应生成 K2FeO4的离子方程式
(4)制备的高铁酸钾粗产品中含有KCl、KOH等杂质,以下为提纯步骤:
①取一定量的高铁酸钾粗产品,溶于冷的稀KOH溶液;
②过滤,将滤液置于冰水浴中,向滤液中加入试剂 X;
③搅拌、静置、过滤,用乙醇洗涤2~3次,在真空干燥箱中干燥。
步骤②中加入的试剂 X是
(5)测定 K2FeO4产品的纯度:称取2.00 g制得的 K2FeO4,产品溶于适量
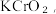 充分反应后过滤,将滤液转移到250mL容量瓶中定容。 以上溶液配制过程中需要用到玻璃棒,它的作用为
充分反应后过滤,将滤液转移到250mL容量瓶中定容。 以上溶液配制过程中需要用到玻璃棒,它的作用为 溶液充分反应,消耗溶液体积为 26.00 mL。 该K2FeO4样品的纯度为
溶液充分反应,消耗溶液体积为 26.00 mL。 该K2FeO4样品的纯度为已知:
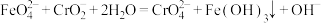
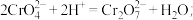

您最近一年使用:0次
7 . 废水脱氮工艺中有一种方法是在废水中加入过量NaClO,使 中的氮元素完全转化为N2,该反应可表示为
中的氮元素完全转化为N2,该反应可表示为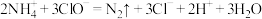 。下列说法正确的是
。下列说法正确的是
 中的氮元素完全转化为N2,该反应可表示为
中的氮元素完全转化为N2,该反应可表示为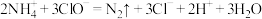 。下列说法正确的是
。下列说法正确的是A.反应中氮元素被氧化, 是还原剂 是还原剂 | B.还原性: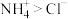 |
| C.反应中每生成1分子N2,转移3个电子 | D.经此法处理过的废水可以直接排放 |
您最近一年使用:0次
2023-11-02更新
|
102次组卷
|
3卷引用:山东省青岛市2023-2024学年第十七中学高一上学期化学期中试题
名校
解题方法
8 . 回答下列问题:
(1)①用双线桥法表示下列反应中电子转移的方向和数目:Cl2+SO2+2H2O=2HCl+H2SO4。___________
②在上述反应中,若反应消耗71.0 g Cl2,同时消耗标准状况下SO2的体积约为___________ L,转移电子的物质的量为___________ mol。
(2)二氧化氯是一种安全、高效的消毒剂,可以在极低的浓度下杀灭病菌。利用KClO3和浓盐酸在一定温度下可制备二氧化氯气体,同时产生黄绿色的气体。

①请写出上述反应的化学方程式并配平。___________
②若反应中转移的电子数为2NA个,则产生ClO2的物质的量为___________ 。
(1)①用双线桥法表示下列反应中电子转移的方向和数目:Cl2+SO2+2H2O=2HCl+H2SO4。
②在上述反应中,若反应消耗71.0 g Cl2,同时消耗标准状况下SO2的体积约为
(2)二氧化氯是一种安全、高效的消毒剂,可以在极低的浓度下杀灭病菌。利用KClO3和浓盐酸在一定温度下可制备二氧化氯气体,同时产生黄绿色的气体。

①请写出上述反应的化学方程式并配平。
②若反应中转移的电子数为2NA个,则产生ClO2的物质的量为
您最近一年使用:0次
解题方法
9 . 金属钛在医疗、航空、军工电子等领域使用非常广泛。以钛铁矿(主要成分为FeTiO3,还有Fe2O3、MgO、SiO2等杂质)为主要原料冶炼金属钛生产流程如图所示。
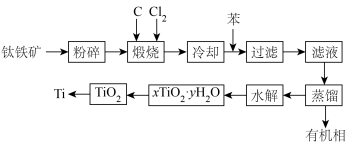
已知:
(1)煅烧过程中主要反应的化学方程式为___________ ,煅烧过程中发生的反应为吸热反应,该反应能够自发进行的原因是___________ 。
(2)“水解”发生的化学方程式为___________ 。
(3)在上述工艺流程中可以循环使用的物质是___________ 。
(4)测定产物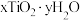 组成的方法如下:
组成的方法如下:
步骤一:取样品2.100g,在酸性条件下充分溶解,并用适量铝将 还原为
还原为 ,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,并用稀硫酸定容,得待测液。
,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,并用稀硫酸定容,得待测液。
步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用 的NH4Fe(SO4)2标准溶液滴定,将
的NH4Fe(SO4)2标准溶液滴定,将 氧化为
氧化为 。重复滴定2次。滴定所得相关数据如下表:
。重复滴定2次。滴定所得相关数据如下表:
①步骤一中用稀硫酸而不用水定容的原因是___________ 。
②通过计算确定该样品的组成为___________ 。
(5)从TiO2获得单质钛可以采用FFC-熔盐电脱氧法,具体流程为:将二氧化钛压制成型,经过预烧结,制备成电解体系的阴极,石墨作惰性阳极,以氯化钠、氯化钙为混合熔盐,在低于一定电压条件下电解,阴极生成金属钛。写出阴极的电极反应式___________ 。

已知:
| 物质 | 熔点(℃) | 沸点(℃) | 溶解性 |
| TiCl4 | -25 | 136 | 溶于苯,遇水分解放热,放出有毒的腐蚀性烟气 |
| FeCl3 | 306 | 315 | 易溶于水,难溶于苯等有机物 |
| MgCl2 | 714 | 1412 | 易溶于水,难溶于苯等有机物 |
| SiCl4 | -70 | 57.6 | 溶于苯、四氯化碳等非极性溶剂,遇水剧烈反应 |
(1)煅烧过程中主要反应的化学方程式为
(2)“水解”发生的化学方程式为
(3)在上述工艺流程中可以循环使用的物质是
(4)测定产物
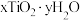 组成的方法如下:
组成的方法如下:步骤一:取样品2.100g,在酸性条件下充分溶解,并用适量铝将
 还原为
还原为 ,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,并用稀硫酸定容,得待测液。
,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,并用稀硫酸定容,得待测液。步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用
 的NH4Fe(SO4)2标准溶液滴定,将
的NH4Fe(SO4)2标准溶液滴定,将 氧化为
氧化为 。重复滴定2次。滴定所得相关数据如下表:
。重复滴定2次。滴定所得相关数据如下表:| 滴定序号 | 待测液体积/mL | 滴定起点读数/mL | 滴定终点读数/mL |
| 1 | 25.00 | 0.02 | 24.02 |
| 2 | 25.00 | 0.08 | 24.06 |
| 3 | 25.00 | 0.12 | 24.14 |
②通过计算确定该样品的组成为
(5)从TiO2获得单质钛可以采用FFC-熔盐电脱氧法,具体流程为:将二氧化钛压制成型,经过预烧结,制备成电解体系的阴极,石墨作惰性阳极,以氯化钠、氯化钙为混合熔盐,在低于一定电压条件下电解,阴极生成金属钛。写出阴极的电极反应式
您最近一年使用:0次
10 . 高铁酸钾(K2FeO4)可溶于水、微溶于浓KOH溶液;在强碱性溶液中比较稳定,在Fe或Fe(OH)3的催化作用下分解,是一种绿色高效的水处理剂。某实验小组用如图所示装置(加热夹持仪器已省略)制备KClO溶液,再用制得的KClO溶液与Fe(NO3)3溶液反应制备K2FeO4。

回答下列问题:
(1)K2FeO4中元素的化合价为___________ ,仪器X的名称为___________ 。
(2)现有①Fe(NO3)3溶液、②含KOH的KClO溶液,混合两种溶液时,将___________ (填序号,下同)滴入___________ 中,发生反应的化学方程式是___________ 。
(3)Cl2与KOH在较高温度下反应生成KClO3。在不改变KOH溶液的浓度和体积的条件下,控制反应在0-5℃进行。实验中可采取的措施是___________ ;在通入氯气的过程中,不断搅拌的目的是___________ 。
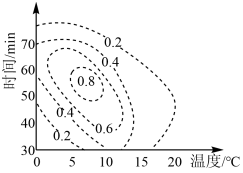
(4)K2FeO4的理论产率与合成条件相应曲面投影的关系如图所示(虚线上的数据表示K2FeO4理论产率),则制备K2FeO4最适宜的条件范围是___________ 。
(5)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3mol/LKOH稀溶液中;
②过滤;
③___________ ;
④搅拌、静置、过滤,用乙醇洗涤2-3次;
⑤在真空干燥箱中干燥。

回答下列问题:
(1)K2FeO4中元素的化合价为
(2)现有①Fe(NO3)3溶液、②含KOH的KClO溶液,混合两种溶液时,将
(3)Cl2与KOH在较高温度下反应生成KClO3。在不改变KOH溶液的浓度和体积的条件下,控制反应在0-5℃进行。实验中可采取的措施是
(4)K2FeO4的理论产率与合成条件相应曲面投影的关系如图所示(虚线上的数据表示K2FeO4理论产率),则制备K2FeO4最适宜的条件范围是

(5)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3mol/LKOH稀溶液中;
②过滤;
③
④搅拌、静置、过滤,用乙醇洗涤2-3次;
⑤在真空干燥箱中干燥。
您最近一年使用:0次



