名校
解题方法
1 . 五氧化二钒是工业制硫酸的催化剂。从废钒催化剂中(含有 、
、 、
、 、
、 、
、 、
、 等)回收钒,既能避免对环境的污染,又能节约宝贵的资源。回收工艺流程如下:
等)回收钒,既能避免对环境的污染,又能节约宝贵的资源。回收工艺流程如下:

已知:①“酸浸”时 和
和 先与稀硫酸反应分别生成
先与稀硫酸反应分别生成 和
和 。
。
②有机萃取剂萃取 的能力比萃取
的能力比萃取 的能力强。
的能力强。
③溶液中 与
与 可相互转化:
可相互转化: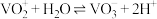
(1)“酸浸”时, 先与稀硫酸反应的化学方程式为
先与稀硫酸反应的化学方程式为___________ 。 的作用为
的作用为___________ 。
(2)滤渣2的主要成份为___________ 。
(3)“萃取”和“反萃取”时,将发生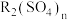 (水层)
(水层)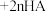 (有机层)
(有机层)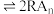 (有机层)
(有机层)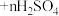 (水层)(R表示
(水层)(R表示 ,HA表示有机萃取剂),假设“滤液2”中
,HA表示有机萃取剂),假设“滤液2”中 ,“萃取”和“反萃取”每进行一次,
,“萃取”和“反萃取”每进行一次, 萃取率为80%,4次操作后,“滤液2”中残留的
萃取率为80%,4次操作后,“滤液2”中残留的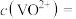
___________  (萃取率=
(萃取率= ×100%)
×100%)
(4)“氧化”过程中发生反应的离子方程式为___________ 。
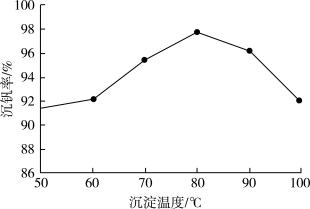
(5)“沉钒”时,通入氨气的作用是___________ ,以沉钒率( 沉淀中V的质量和废催化剂V的质量之比)表示该步反应钒的回收率。沉钒率与温度的关系如下图所示,请解释沉钒过程采取80℃的原因是
沉淀中V的质量和废催化剂V的质量之比)表示该步反应钒的回收率。沉钒率与温度的关系如下图所示,请解释沉钒过程采取80℃的原因是___________ 。
 、
、 、
、 、
、 、
、 、
、 等)回收钒,既能避免对环境的污染,又能节约宝贵的资源。回收工艺流程如下:
等)回收钒,既能避免对环境的污染,又能节约宝贵的资源。回收工艺流程如下:
已知:①“酸浸”时
 和
和 先与稀硫酸反应分别生成
先与稀硫酸反应分别生成 和
和 。
。②有机萃取剂萃取
 的能力比萃取
的能力比萃取 的能力强。
的能力强。③溶液中
 与
与 可相互转化:
可相互转化: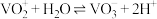
(1)“酸浸”时,
 先与稀硫酸反应的化学方程式为
先与稀硫酸反应的化学方程式为 的作用为
的作用为(2)滤渣2的主要成份为
(3)“萃取”和“反萃取”时,将发生
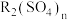 (水层)
(水层)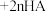 (有机层)
(有机层)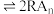 (有机层)
(有机层)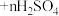 (水层)(R表示
(水层)(R表示 ,HA表示有机萃取剂),假设“滤液2”中
,HA表示有机萃取剂),假设“滤液2”中 ,“萃取”和“反萃取”每进行一次,
,“萃取”和“反萃取”每进行一次, 萃取率为80%,4次操作后,“滤液2”中残留的
萃取率为80%,4次操作后,“滤液2”中残留的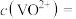
 (萃取率=
(萃取率= ×100%)
×100%)(4)“氧化”过程中发生反应的离子方程式为
(5)“沉钒”时,通入氨气的作用是
 沉淀中V的质量和废催化剂V的质量之比)表示该步反应钒的回收率。沉钒率与温度的关系如下图所示,请解释沉钒过程采取80℃的原因是
沉淀中V的质量和废催化剂V的质量之比)表示该步反应钒的回收率。沉钒率与温度的关系如下图所示,请解释沉钒过程采取80℃的原因是
您最近一年使用:0次
名校
解题方法
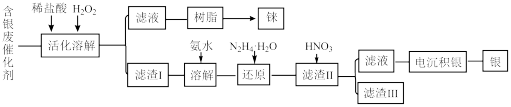
2 . 工业上利用含银废催化剂(含金属银和铼,少量MgO、 、
、 等)分离回收银和铼。工艺流程如图所示,下列说法正确的是
等)分离回收银和铼。工艺流程如图所示,下列说法正确的是
已知:AgCl能与 反应生成
反应生成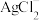 、
、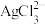 。
。
 、
、 等)分离回收银和铼。工艺流程如图所示,下列说法正确的是
等)分离回收银和铼。工艺流程如图所示,下列说法正确的是
已知:AgCl能与
 反应生成
反应生成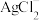 、
、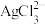 。
。| A.活化溶解时,增大盐酸浓度,加快溶解速率,有利于提高铼和银的回收率 |
| B.还原过程中产生无毒气体,则氧化剂、还原剂的物质的量之比为1∶4 |
| C.溶解滤渣Ⅱ时,选择浓硝酸比稀硝酸效果更好 |
| D.本工艺中可循环利用的物质是硝酸 |
您最近一年使用:0次
2022-11-15更新
|
402次组卷
|
2卷引用:山东省德州市2022-2023学年高三上学期期中考试化学试题
3 . 将 通入足量
通入足量 溶液中,完全反应后再加入
溶液中,完全反应后再加入 溶液,发生的两个化学反应
溶液,发生的两个化学反应
①
②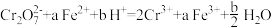 。
。
下列有关说法正确的是
 通入足量
通入足量 溶液中,完全反应后再加入
溶液中,完全反应后再加入 溶液,发生的两个化学反应
溶液,发生的两个化学反应①

②
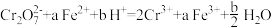 。
。下列有关说法正确的是
A.还原性: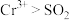 | B.方程式②中,a=6、b=7 |
C. 能将 能将 还原成 还原成 | D.方程式①中W为 |
您最近一年使用:0次
2022-11-14更新
|
78次组卷
|
2卷引用:山东省聊城第一中学2022-2023学年高一上学期11月期中考试化学试题
4 . 下列相关说法正确的是
| 化学反应方程式 | 相关说法 | |
| A | KClO3+6HCl=KCl+3Cl2↑+3H2O | 单线桥: |
| B | 2Fe3++Cu=2Fe2++Cu2+ | 氧化性:Cu>Fe2+ |
| C | 4CuO 2Cu2O+O2↑ 2Cu2O+O2↑ | 每生成1个O2,转移2个电子 |
| D | ____ClO-+_____Fe3++__OH-=___ + _____Cl-+______H2O + _____Cl-+______H2O | 化学计量数依次为: 3,2,10,2,3,5 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-14更新
|
185次组卷
|
3卷引用:山东省聊城第一中学2022-2023学年高一上学期11月期中考试化学试题
名校
解题方法
5 . 下列反应的离子方程式正确的是
A.酸性 溶液与 溶液与 反应: 反应: |
B. 溶液与 溶液与 溶液反应: 溶液反应: |
C. 溶液与NaOH溶液混合: 溶液与NaOH溶液混合: |
D.向水中通入 : : |
您最近一年使用:0次
2022-11-14更新
|
106次组卷
|
2卷引用:山东省青岛第一中学2022-2023学年高一上学期期中考试化学试题
名校
解题方法
6 . 下列离子方程式正确的是
A. 通入热的NaOH溶液: 通入热的NaOH溶液: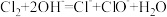 |
B.用醋酸和淀粉-KI溶液检验加碘盐中的 |
C. 溶液中加入 溶液中加入 产生沉淀: 产生沉淀: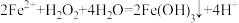 |
D. 溶液与少量的 溶液与少量的 溶液混合: 溶液混合: |
您最近一年使用:0次
解题方法
7 . K2FeO4常用于饮用水消毒,某兴趣小组在碱性条件下用KClO和Fe(NO3)3制备K2FeO4并测定其纯度,实验装置如图(夹持装置已省略)。

已知:K2FeO4具有强氧化性,可溶于水,微溶于浓KOH溶液,不溶于乙醇。
回答下列问题:
(1)仪器a的名称为____ 。
(2)碱性环境下KClO和Fe(NO3)3制备K2FeO4的离子方程式为____ 。
(3)向反应后的溶液中加入适量KOH固体,过滤,再用____ 洗涤(填标号)、干燥,得到产品。
(4)测定产品纯度:取1.32g产品溶于去氧蒸馏水中配成100mL溶液,取10.00mL所配溶液于锥形瓶中,滴加过量KI溶液,加入淀粉溶液,用0.1000mol•L-1的Na2S2O3标准溶液滴定,平行滴定3次,消耗Na2S2O3溶液体积平均为19.20mL,(已知:FeO 被还原为Fe3+,I2+2S2O
被还原为Fe3+,I2+2S2O =2I-+S4O
=2I-+S4O ,且杂质不参与反应).
,且杂质不参与反应).
①量取K2FeO4溶液,而选用____ 滴定管(填“酸式”或“碱式”)。
②产品中高铁酸钾的纯度为_____ 。
③下列操作会使实验结果偏低的是____ (填标号)。
A.用蒸馏水洗涤滴定管后立即注入Na2S2O3溶液至“0”刻度线以上
B.开始滴定时仰视读数,滴定结束后俯视读数
C.盛标准液的滴定管尖嘴处在滴定前有气泡,滴定后气泡消失
D.滴定时摇动锥形瓶,有少量液体溅出

已知:K2FeO4具有强氧化性,可溶于水,微溶于浓KOH溶液,不溶于乙醇。
回答下列问题:
(1)仪器a的名称为
(2)碱性环境下KClO和Fe(NO3)3制备K2FeO4的离子方程式为
(3)向反应后的溶液中加入适量KOH固体,过滤,再用
| A.H2O | B.95%乙醇 | C.NH4Cl溶液 | D.Fe(NO3)3溶液 |
 被还原为Fe3+,I2+2S2O
被还原为Fe3+,I2+2S2O =2I-+S4O
=2I-+S4O ,且杂质不参与反应).
,且杂质不参与反应).①量取K2FeO4溶液,而选用
②产品中高铁酸钾的纯度为
③下列操作会使实验结果偏低的是
A.用蒸馏水洗涤滴定管后立即注入Na2S2O3溶液至“0”刻度线以上
B.开始滴定时仰视读数,滴定结束后俯视读数
C.盛标准液的滴定管尖嘴处在滴定前有气泡,滴定后气泡消失
D.滴定时摇动锥形瓶,有少量液体溅出
您最近一年使用:0次
名校
解题方法
8 . 含镍催化剂在有机合成中应用广泛。某油脂厂制硬化油废弃的镍催化剂(主要含有 ,还含有
,还含有 、
、 )为原料制备
)为原料制备 ,及
,及 的工艺流程如下:
的工艺流程如下:
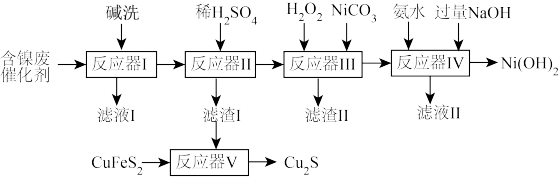
已知:①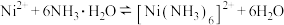
②制备过程中,降低 沉淀速率,可以避免沉淀团聚,提升产品性能回答下列问题:
沉淀速率,可以避免沉淀团聚,提升产品性能回答下列问题:
(1)反应器1中进行碱洗的主要目的是_______ 。
(2)保持其它条件不变,在不同温度下进行稀 溶浸,镍浸出率随时间变化如图。酸浸的最佳条件是
溶浸,镍浸出率随时间变化如图。酸浸的最佳条件是_______ 。

(3)反应器Ⅲ中加入 发生反应的离子方程式为
发生反应的离子方程式为_______ 。加入 的作用
的作用_______ 。
(4)反应器Ⅳ中,需先加氨水,再加过量 ,先加氨水的目的是
,先加氨水的目的是_______ 。
(5) 是一种不溶于水的黑色固体,但可溶于
是一种不溶于水的黑色固体,但可溶于 溶液,有研究指出
溶液,有研究指出 是该反应的催化剂,该过程的反应原理可用化学方程式表示为①
是该反应的催化剂,该过程的反应原理可用化学方程式表示为①_______ ;② 。
。
 ,还含有
,还含有 、
、 )为原料制备
)为原料制备 ,及
,及 的工艺流程如下:
的工艺流程如下:
已知:①
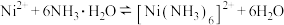
②制备过程中,降低
 沉淀速率,可以避免沉淀团聚,提升产品性能回答下列问题:
沉淀速率,可以避免沉淀团聚,提升产品性能回答下列问题:(1)反应器1中进行碱洗的主要目的是
(2)保持其它条件不变,在不同温度下进行稀
 溶浸,镍浸出率随时间变化如图。酸浸的最佳条件是
溶浸,镍浸出率随时间变化如图。酸浸的最佳条件是
(3)反应器Ⅲ中加入
 发生反应的离子方程式为
发生反应的离子方程式为 的作用
的作用(4)反应器Ⅳ中,需先加氨水,再加过量
 ,先加氨水的目的是
,先加氨水的目的是(5)
 是一种不溶于水的黑色固体,但可溶于
是一种不溶于水的黑色固体,但可溶于 溶液,有研究指出
溶液,有研究指出 是该反应的催化剂,该过程的反应原理可用化学方程式表示为①
是该反应的催化剂,该过程的反应原理可用化学方程式表示为① 。
。
您最近一年使用:0次
2022-11-11更新
|
188次组卷
|
2卷引用:山东省菏泽市郓城第一中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
9 . 三草酸合铁(Ⅲ)酸钾晶体 (
(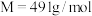 ),外观为翠绿色,溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料,也是有机反应中的一种重要催化剂。已知
),外观为翠绿色,溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料,也是有机反应中的一种重要催化剂。已知 与
与 在溶液中非常容易发生络合反应,生成难电离的
在溶液中非常容易发生络合反应,生成难电离的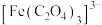 。
。 的制备过程如下:
的制备过程如下:
第一步溶解:用托盘天平称取4.0g 晶体,放入250
晶体,放入250 烧杯中,加入1
烧杯中,加入1 的稀
的稀 1
1 ,再加入
,再加入 15
15 ,加热使其溶解。
,加热使其溶解。
第二步沉淀:在上述溶液中加入1 的
的 20
20 ,搅拌并加热煮沸,形成
,搅拌并加热煮沸,形成 黄色沉淀,洗涤除去沉淀上附着的可溶物。
黄色沉淀,洗涤除去沉淀上附着的可溶物。
第三步氧化:向上述沉淀中加入10 饱和
饱和 溶液,水浴加热至40℃,滴加3%
溶液,水浴加热至40℃,滴加3% 溶液20
溶液20 ,不断搅拌溶液并维持温度在40℃左右,使
,不断搅拌溶液并维持温度在40℃左右,使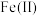 充分氧化为
充分氧化为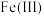 。反应充分后,将溶液加热煮沸。
。反应充分后,将溶液加热煮沸。
第四步得到产物:保持上述沉淀近沸状态,先加入1 的
的 7
7 ,然后趁热滴加1
,然后趁热滴加1
 1至2
1至2 使沉淀溶解,保持溶液的
使沉淀溶解,保持溶液的 在4到5之间,此时溶液呈翠绿色,趁热将溶液过滤,冷却放置、结晶、抽滤至干即得三草酸合铁(III)酸钾晶体4.2g。
在4到5之间,此时溶液呈翠绿色,趁热将溶液过滤,冷却放置、结晶、抽滤至干即得三草酸合铁(III)酸钾晶体4.2g。
请回答下列问题:
(1)将 晶体先溶解到1
晶体先溶解到1 的稀
的稀 中的原因是
中的原因是_______ 。
(2)第三步中加热煮沸的目的是_______ 。
(3)称量ag样品,溶于水,逐滴滴加b 的酸性
的酸性 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液v
溶液v ,请写出滴加过程中发生反应的离子方程式
,请写出滴加过程中发生反应的离子方程式_______ ,则该样品的纯度为_______ (用含a、b、v的代数式表示),列出产品产率的计算式_______ 。
(4)下列操作能可能导致产品产率降低的是_______。
(5)有同学根据已有知识认为 与
与 之间可以发生氧化还原反应,并设计了如下实验装置进行验证。
之间可以发生氧化还原反应,并设计了如下实验装置进行验证。

该装置中的电极材料为_______ ,若二者能反应,能观察到的实验现象是_______ 。
 (
(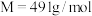 ),外观为翠绿色,溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料,也是有机反应中的一种重要催化剂。已知
),外观为翠绿色,溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料,也是有机反应中的一种重要催化剂。已知 与
与 在溶液中非常容易发生络合反应,生成难电离的
在溶液中非常容易发生络合反应,生成难电离的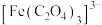 。
。 的制备过程如下:
的制备过程如下:第一步溶解:用托盘天平称取4.0g
 晶体,放入250
晶体,放入250 烧杯中,加入1
烧杯中,加入1 的稀
的稀 1
1 ,再加入
,再加入 15
15 ,加热使其溶解。
,加热使其溶解。第二步沉淀:在上述溶液中加入1
 的
的 20
20 ,搅拌并加热煮沸,形成
,搅拌并加热煮沸,形成 黄色沉淀,洗涤除去沉淀上附着的可溶物。
黄色沉淀,洗涤除去沉淀上附着的可溶物。第三步氧化:向上述沉淀中加入10
 饱和
饱和 溶液,水浴加热至40℃,滴加3%
溶液,水浴加热至40℃,滴加3% 溶液20
溶液20 ,不断搅拌溶液并维持温度在40℃左右,使
,不断搅拌溶液并维持温度在40℃左右,使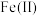 充分氧化为
充分氧化为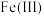 。反应充分后,将溶液加热煮沸。
。反应充分后,将溶液加热煮沸。第四步得到产物:保持上述沉淀近沸状态,先加入1
 的
的 7
7 ,然后趁热滴加1
,然后趁热滴加1
 1至2
1至2 使沉淀溶解,保持溶液的
使沉淀溶解,保持溶液的 在4到5之间,此时溶液呈翠绿色,趁热将溶液过滤,冷却放置、结晶、抽滤至干即得三草酸合铁(III)酸钾晶体4.2g。
在4到5之间,此时溶液呈翠绿色,趁热将溶液过滤,冷却放置、结晶、抽滤至干即得三草酸合铁(III)酸钾晶体4.2g。请回答下列问题:
(1)将
 晶体先溶解到1
晶体先溶解到1 的稀
的稀 中的原因是
中的原因是(2)第三步中加热煮沸的目的是
(3)称量ag样品,溶于水,逐滴滴加b
 的酸性
的酸性 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液v
溶液v ,请写出滴加过程中发生反应的离子方程式
,请写出滴加过程中发生反应的离子方程式(4)下列操作能可能导致产品产率降低的是_______。
| A.第三步操作中水浴温度过高 | B.第四步过滤操作时间过长 |
| C.过滤后未洗涤晶体 | D.抽滤后烘干产品 |
 与
与 之间可以发生氧化还原反应,并设计了如下实验装置进行验证。
之间可以发生氧化还原反应,并设计了如下实验装置进行验证。
该装置中的电极材料为
您最近一年使用:0次
2022-11-11更新
|
167次组卷
|
2卷引用:山东省菏泽市郓城第一中学2022-2023学年高二上学期期中考试化学试题
10 . 二草酸合铜(Ⅱ)酸钾(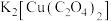 )可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
)可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
I.取已知浓度的 溶液,搅拌下滴加足量
溶液,搅拌下滴加足量 溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
Ⅱ.向草酸( )溶液中加入适量
)溶液中加入适量 固体,制得
固体,制得 和
和 混合溶液。
混合溶液。
Ⅲ.将Ⅱ的混合溶液加热至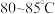 ,加入I中的黑色沉淀。全部溶解后,趁热过滤。将滤液用蒸汽浴加热浓缩,经一系列操作后,得到二草酸合铜(Ⅱ)酸钾晶体。
,加入I中的黑色沉淀。全部溶解后,趁热过滤。将滤液用蒸汽浴加热浓缩,经一系列操作后,得到二草酸合铜(Ⅱ)酸钾晶体。
回答下列问题:
(1)由 配制I中的
配制I中的 溶液,下列仪器中不需要的是
溶液,下列仪器中不需要的是_______ (填仪器名称)。
实验室中配制 的
的 溶液,需要称取
溶液,需要称取 固体的质量为
固体的质量为_______  。下列操作能导致所配制的
。下列操作能导致所配制的 溶液浓度偏大的是
溶液浓度偏大的是_______ 。
① 部分失水 ②容量瓶不干燥
部分失水 ②容量瓶不干燥
③未洗涤溶解固体所用的烧杯和玻璃棒 ④定容时俯视刻度线
(2)步骤I中过滤操作用到的玻璃仪器有_______ 。
(3)反应Ⅱ中原料配比为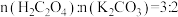 ,写出反应的化学方程式
,写出反应的化学方程式_______ 。
(4)产品纯度分析:
准确称取合成的晶体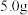 ,在氨水中溶解。试样完全溶解后转移至
,在氨水中溶解。试样完全溶解后转移至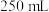 容量瓶中,加水至刻度线。取
容量瓶中,加水至刻度线。取 溶液用硫酸中和,并在硫酸溶液中用
溶液用硫酸中和,并在硫酸溶液中用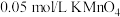 滴定试样中的
滴定试样中的 ,恰好完全反应时消耗的
,恰好完全反应时消耗的 溶液的体积为
溶液的体积为 。则产品中
。则产品中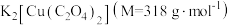 的纯度为
的纯度为_______  。(已知
。(已知 。产品中其它成分不与
。产品中其它成分不与 反应。)
反应。)
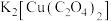 )可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
)可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:I.取已知浓度的
 溶液,搅拌下滴加足量
溶液,搅拌下滴加足量 溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。Ⅱ.向草酸(
 )溶液中加入适量
)溶液中加入适量 固体,制得
固体,制得 和
和 混合溶液。
混合溶液。Ⅲ.将Ⅱ的混合溶液加热至
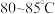 ,加入I中的黑色沉淀。全部溶解后,趁热过滤。将滤液用蒸汽浴加热浓缩,经一系列操作后,得到二草酸合铜(Ⅱ)酸钾晶体。
,加入I中的黑色沉淀。全部溶解后,趁热过滤。将滤液用蒸汽浴加热浓缩,经一系列操作后,得到二草酸合铜(Ⅱ)酸钾晶体。回答下列问题:
(1)由
 配制I中的
配制I中的 溶液,下列仪器中不需要的是
溶液,下列仪器中不需要的是
实验室中配制
 的
的 溶液,需要称取
溶液,需要称取 固体的质量为
固体的质量为 。下列操作能导致所配制的
。下列操作能导致所配制的 溶液浓度偏大的是
溶液浓度偏大的是①
 部分失水 ②容量瓶不干燥
部分失水 ②容量瓶不干燥③未洗涤溶解固体所用的烧杯和玻璃棒 ④定容时俯视刻度线
(2)步骤I中过滤操作用到的玻璃仪器有
(3)反应Ⅱ中原料配比为
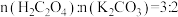 ,写出反应的化学方程式
,写出反应的化学方程式(4)产品纯度分析:
准确称取合成的晶体
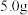 ,在氨水中溶解。试样完全溶解后转移至
,在氨水中溶解。试样完全溶解后转移至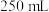 容量瓶中,加水至刻度线。取
容量瓶中,加水至刻度线。取 溶液用硫酸中和,并在硫酸溶液中用
溶液用硫酸中和,并在硫酸溶液中用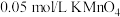 滴定试样中的
滴定试样中的 ,恰好完全反应时消耗的
,恰好完全反应时消耗的 溶液的体积为
溶液的体积为 。则产品中
。则产品中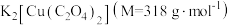 的纯度为
的纯度为 。(已知
。(已知 。产品中其它成分不与
。产品中其它成分不与 反应。)
反应。)
您最近一年使用:0次



