11-12高三上·山东潍坊·期中
填空题
|
较难(0.4)
|
1 . 盐酸、硫酸和硝酸是中学阶段常见的三种强酸。请就三者与金属铜的反应情况,回答下列问题:
(1)①在100mL 1 8 mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是___________
②有同学提出,若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,请判断该方案是否可行?若不可行,请说明原因。若可行,请写出反应的离子方程式式:___________ 。
(2)若将6.4g铜粉与一定量浓硝酸反应,当铜粉完全溶解时,生成气体(NO、NO2)共2.24L(标准状况),则反应中所消耗的硝酸的物质的量为____________ 。
(3)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水,该反应的化学方程式为:__________________ 。
(1)①在100mL 1 8 mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是
| A.40.32L | B.30.24L | C.20.16L | D.6.72L |
②有同学提出,若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,请判断该方案是否可行?若不可行,请说明原因。若可行,请写出反应的离子方程式式:
(2)若将6.4g铜粉与一定量浓硝酸反应,当铜粉完全溶解时,生成气体(NO、NO2)共2.24L(标准状况),则反应中所消耗的硝酸的物质的量为
(3)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水,该反应的化学方程式为:
您最近一年使用:0次
11-12高一上·黑龙江·期中
解题方法
2 . (1)在Fe3O4 +4CO 3Fe+4CO2的反应中,
3Fe+4CO2的反应中,____________ 是氧化剂,_________________ 是还原剂,_______ 元素被氧化,_______ 元素被还原。
(2)配平下列化学方程式并用单线桥法分析下列氧化还原反应中电子转移的方向和数目_________________ ,_____ Cu +___ HNO3(浓)===____ Cu(NO3)2+_____ NO2↑ +_____ H2O,浓硝酸表现出来的性质是_______________ (填写编号)。
①还原性 ②酸性 ③氧化性
 3Fe+4CO2的反应中,
3Fe+4CO2的反应中,(2)配平下列化学方程式并用单线桥法分析下列氧化还原反应中电子转移的方向和数目
①还原性 ②酸性 ③氧化性
您最近一年使用:0次
3 . 铜及其化合物在生产、生活中应用广泛。回答下列问题:
(1)用新制Cu(OH)2与葡萄糖反应可制备Cu2O,该反应中葡萄糖是__________ (填“氧化剂”或“还原剂”)。
(2)用H2O2、H2SO4混合溶液浸泡废印刷电路板可制备CuSO4以实现铜的回收利用,其离子方程式为_____________________ 。
(3)用NH4NO3氧化海绵铜(含Cu的CuO)生产CuCl的部分流程如下:
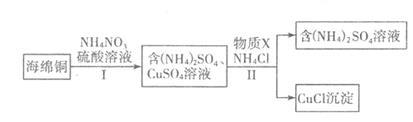
①步骤I中反应温度不宜过高的原因是_______________ ,当0.5 mol NH4NO3参加反应时,反应中有4 mol电子发生转移,则铜参加反应的离子方程式为_____________ 。
②步骤Ⅱ中物质X可选用_________________ (填字母),该物质需过量的原因,其一是加快反应速率,其二是___________ 。
a.Cu b.Cl2 c.H2O2 d.(NH4)2SO3
(1)用新制Cu(OH)2与葡萄糖反应可制备Cu2O,该反应中葡萄糖是
(2)用H2O2、H2SO4混合溶液浸泡废印刷电路板可制备CuSO4以实现铜的回收利用,其离子方程式为
(3)用NH4NO3氧化海绵铜(含Cu的CuO)生产CuCl的部分流程如下:

①步骤I中反应温度不宜过高的原因是
②步骤Ⅱ中物质X可选用
a.Cu b.Cl2 c.H2O2 d.(NH4)2SO3
您最近一年使用:0次
4 . 工业尾气SO2、NO2是污染大气、形成酸雨的罪魁祸首。请回答下列问题:
(1)用CO可以消除SO2污染。已知一定条件下,2CO(g)+O2(g)=2CO2(g)的能量变化如图所示,由固体S单质生成l molSO2(g)的焓变为-296kJ·mol 。
。

在相同条件下,CO与SO2反应生成单质S与CO2的热化学方程式为_______ 。
(2)异氰酸(化学式:HNCO,C为+4价)可用于消除尾气中的NO2.其反应原理为:HNCO+NO2→N2+CO2+ (未配平)。
(未配平)。
①上述反应的氧化剂是_______ 。
②配平后方框内应填写_______ 。
③每处理33.6LNO2(标准状况),反应中转移电子的物质的量为_______ 。
(1)用CO可以消除SO2污染。已知一定条件下,2CO(g)+O2(g)=2CO2(g)的能量变化如图所示,由固体S单质生成l molSO2(g)的焓变为-296kJ·mol
 。
。
在相同条件下,CO与SO2反应生成单质S与CO2的热化学方程式为
(2)异氰酸(化学式:HNCO,C为+4价)可用于消除尾气中的NO2.其反应原理为:HNCO+NO2→N2+CO2+
 (未配平)。
(未配平)。①上述反应的氧化剂是
②配平后方框内应填写
③每处理33.6LNO2(标准状况),反应中转移电子的物质的量为
您最近一年使用:0次
5 . 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2, 该反应的离子方程式为__________________ 。
(2)氢氧化铁与氢碘酸反应时可生成棕色物质,该反应的离子方程式为_______________ 。
(3)从海带中提取碘的过程中,下列说法正确的是______ 。

(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2, 该反应的离子方程式为
(2)氢氧化铁与氢碘酸反应时可生成棕色物质,该反应的离子方程式为
(3)从海带中提取碘的过程中,下列说法正确的是

您最近一年使用:0次
解题方法
6 . I 铁及其化合物之间的相互转化可用下式表示:

回答下列有关问题:
(1)检验硫酸铁溶液中是否存在Fe2+的方法是___________________ 。
(2)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2= 2Na2FeO4+2Na2O+2Na2SO4+O2↑
该反应中的还原剂是___________ ,每生成l mol Na2FeO4转移____________ mol电子。
(3)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:
Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:_______________ 。
②若反应过程中转移了0.3 mol电子,则还原产物的物质的量为___________ 。
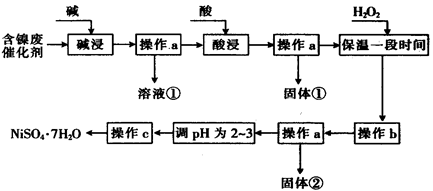
II某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备 。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
部分阳离子以氢氧化物形式沉淀时的pH如下:
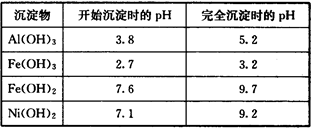
(1)“碱浸”过程中发生反应的离子方程式是____________ 。
(2)“酸浸”时所加入的酸是____________________ (填化学式)。
(3)加入H2O2时发生反应的离子方程式为__________________
(4)操作b为调节溶液的pH,你认为pH的调控范围是__________________
(5)NiS04·7Hz0可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为__________________ 。

回答下列有关问题:
(1)检验硫酸铁溶液中是否存在Fe2+的方法是
(2)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2= 2Na2FeO4+2Na2O+2Na2SO4+O2↑
该反应中的还原剂是
(3)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:
Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:
②若反应过程中转移了0.3 mol电子,则还原产物的物质的量为
II某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备
 。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
部分阳离子以氢氧化物形式沉淀时的pH如下:

(1)“碱浸”过程中发生反应的离子方程式是
(2)“酸浸”时所加入的酸是
(3)加入H2O2时发生反应的离子方程式为
(4)操作b为调节溶液的pH,你认为pH的调控范围是
(5)NiS04·7Hz0可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为
您最近一年使用:0次



