名校
1 . 2023年10月26日11时14分,神舟十七号载人飞船在酒泉卫星发射中心点火发射。飞船返回地球时,为了减弱返回舱着陆的速度,反推发动机的燃料是高氯酸铵 和铝粉混合物。请回答与高氮酸铵和铝粉相关元素的问题:
和铝粉混合物。请回答与高氮酸铵和铝粉相关元素的问题:
(1)二氧化氯 和过氧化氢均有强氧化性。
和过氧化氢均有强氧化性。
①Cl和O分别形成简单氢化物的稳定性比较_______ >_______
②在酸性条件下,由 和双氧水反应制备
和双氧水反应制备 ,其反应的离子方程式为
,其反应的离子方程式为_______ ;该反应中还原剂与氧化剂的物质的量之比为_______ 。
(2)高氯酸铵中铵根离子的电子式为_______ ;高氯酸铵和铝粉中的元素所形成的简单离子中,核外电子数相同、半径由小到大的顺序是_______ (用离子符号表示)。
(3)氮元素的非金属性较强,N2分子的性质比较稳定,其原因是_______ 。
(4)高氯酸铵和铝粉反应除了生成 和N2外,还有另外两种不含氮元素的物质生成,请写出其化学方程式
和N2外,还有另外两种不含氮元素的物质生成,请写出其化学方程式_______ 。
 和铝粉混合物。请回答与高氮酸铵和铝粉相关元素的问题:
和铝粉混合物。请回答与高氮酸铵和铝粉相关元素的问题:(1)二氧化氯
 和过氧化氢均有强氧化性。
和过氧化氢均有强氧化性。①Cl和O分别形成简单氢化物的稳定性比较
②在酸性条件下,由
 和双氧水反应制备
和双氧水反应制备 ,其反应的离子方程式为
,其反应的离子方程式为(2)高氯酸铵中铵根离子的电子式为
(3)氮元素的非金属性较强,N2分子的性质比较稳定,其原因是
(4)高氯酸铵和铝粉反应除了生成
 和N2外,还有另外两种不含氮元素的物质生成,请写出其化学方程式
和N2外,还有另外两种不含氮元素的物质生成,请写出其化学方程式
您最近一年使用:0次
名校
解题方法
2 . 如图是硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁的生产流程示意图:

请回答下列问题:
(1)酸浸时,将硫铁矿烧渣粉碎的原因是___________ 。
(2)酸浸、过滤后滤液A中的金属阳离子是___________ 。
(3)煅烧FeCO3生成产品I的化学方程式为___________ 。
(4)产品Ⅱ的化学式为___________ 。
(5)写出步骤Ⅳ反应的离子方程式___________ 。

请回答下列问题:
(1)酸浸时,将硫铁矿烧渣粉碎的原因是
(2)酸浸、过滤后滤液A中的金属阳离子是
(3)煅烧FeCO3生成产品I的化学方程式为
(4)产品Ⅱ的化学式为
(5)写出步骤Ⅳ反应的离子方程式
您最近一年使用:0次
名校
解题方法
3 . 用硝酸氧化蔗糖水解的产物可以制备草酸。实验过程如下:

①将蔗糖溶液与少许硫酸混合水浴加热;
②控制反应温度,边搅拌边缓慢滴加混酸(65% HNO3、98% H2SO4的混合溶液),装置如图1所示(加热、搅拌和仪器固定装置均已略去);
硝酸氧化蔗糖水解液过程中发生反应:C6H12O6+12HNO3 3H2C2O4+9NO2↑+3NO↑+9H2O
3H2C2O4+9NO2↑+3NO↑+9H2O
请回答下列问题:
(1)实验①加入少许硫酸的目的是___________ 。
(2)冷凝水进水方向是___________ 口(填“a”或“b”)。
(3)利用草酸晶体分解制备CO的原理为H2C2O4•xH2O CO↑+CO2↑+(x+1)H2O,欲获得纯净干燥的CO气体,应将分解气依次通过盛有
CO↑+CO2↑+(x+1)H2O,欲获得纯净干燥的CO气体,应将分解气依次通过盛有 ___________ 和 ___________ 的洗气瓶。
(4)将产品在90℃以下的恒温箱内烘干至恒重,得到二水合草酸。用酸性KMnO4标准溶液滴定,反应的离子方程式为2MnO +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。称取该样品0.12g,加适量水完全溶解,然后用0.020mol/L的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。称取该样品0.12g,加适量水完全溶解,然后用0.020mol/L的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为 ___________ 。滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为 ___________ 。

①将蔗糖溶液与少许硫酸混合水浴加热;
②控制反应温度,边搅拌边缓慢滴加混酸(65% HNO3、98% H2SO4的混合溶液),装置如图1所示(加热、搅拌和仪器固定装置均已略去);
硝酸氧化蔗糖水解液过程中发生反应:C6H12O6+12HNO3
 3H2C2O4+9NO2↑+3NO↑+9H2O
3H2C2O4+9NO2↑+3NO↑+9H2O请回答下列问题:
(1)实验①加入少许硫酸的目的是
(2)冷凝水进水方向是
(3)利用草酸晶体分解制备CO的原理为H2C2O4•xH2O
 CO↑+CO2↑+(x+1)H2O,欲获得纯净干燥的CO气体,应将分解气依次通过盛有
CO↑+CO2↑+(x+1)H2O,欲获得纯净干燥的CO气体,应将分解气依次通过盛有 (4)将产品在90℃以下的恒温箱内烘干至恒重,得到二水合草酸。用酸性KMnO4标准溶液滴定,反应的离子方程式为2MnO
 +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。称取该样品0.12g,加适量水完全溶解,然后用0.020mol/L的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。称取该样品0.12g,加适量水完全溶解,然后用0.020mol/L的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为
您最近一年使用:0次
4 . 氧化还原反应在工农业生产、日常生活中具有广泛用途,下图物质转化中实现了循环,减少了有害物质向环境的排放,回答下列问题。

(1)Na2Cr2O7中Cr元素的化合价是___________ ,在上述转化中,Cr元素化合价不变的步骤是___________ (填序号)。
(2)下列物质中能实现反应①转化的是___________ 。(填字母)
a.KMnO4 b.HCl c.O2
所选物质参与反应①转化中,Na2Cr2O7发生___________ 反应(填“氧化”或“还原”),该反应有黄绿色气体生成,写出反应的化学方程式:___________ 。
(3)向Cr(OH)3中加入NaOH浓溶液可实现反应③,写出该反应的化学方程式:___________ 。
(4)反应④在碱性条件下发生,反应的离子方程式为: ,请将
,请将 所缺的物质补充完整并配平方程式
所缺的物质补充完整并配平方程式___________ 。

(1)Na2Cr2O7中Cr元素的化合价是
(2)下列物质中能实现反应①转化的是
a.KMnO4 b.HCl c.O2
所选物质参与反应①转化中,Na2Cr2O7发生
(3)向Cr(OH)3中加入NaOH浓溶液可实现反应③,写出该反应的化学方程式:
(4)反应④在碱性条件下发生,反应的离子方程式为:
 ,请将
,请将 所缺的物质补充完整并配平方程式
所缺的物质补充完整并配平方程式
您最近一年使用:0次
5 . 储氢纳米碳管研究成功体现了科技的进步,但用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应的化学方程式为:C+K2Cr2O7+H2SO4→CO2↑+K2SO4+Cr2(SO4)3+H2O(未配平)。回答下列问题。
(1)该反应中,还原剂是___________ (填化学式),被还原的元素是___________ (填元素符号)。
(2)该反应中,K2Cr2O7表现出___________ (选填“氧化性”或“还原性”),K2Cr2O7发生了___________ (选填“氧化反应”或“还原反应”)。
(3)H2SO4在该反应中表现出___________(填字母)。
(4)配平上述方程式:________ 。每生成2分子H2O,该反应转移_________ 个电子。
(1)该反应中,还原剂是
(2)该反应中,K2Cr2O7表现出
(3)H2SO4在该反应中表现出___________(填字母)。
| A.只有酸性 | B.只有氧化性 | C.酸性和氧化性 | D.酸性和还原性 |
您最近一年使用:0次
6 . 请回答:
(1)Na2O2的电子式___________ 。
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由___________ 。
(3)KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为
_______KClO3+_______HCl(浓)=_______KCl+_______ClO2↑+_______Cl2↑+_______
① 请配平上述化学方程式。___________
② 浓盐酸在反应中显示出来的性质是___________
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
③若反应中生成标准状况下13.44L气体,则消耗还原剂的物质的量为___________ 。
④ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以单位物质的量得到的电子数表示)是H2O2的___________ 倍。
(4)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________ 。
(1)Na2O2的电子式
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由
(3)KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为
_______KClO3+_______HCl(浓)=_______KCl+_______ClO2↑+_______Cl2↑+_______

① 请配平上述化学方程式。
② 浓盐酸在反应中显示出来的性质是
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
③若反应中生成标准状况下13.44L气体,则消耗还原剂的物质的量为
④ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以单位物质的量得到的电子数表示)是H2O2的
(4)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
名校
7 . 高铁酸钾(K2FeO4)是一种高效的水处理剂,实验室制备K2FeO4的装置如图所示。(夹持装置略去)
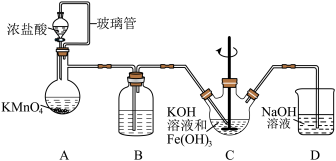
查阅K2FeO4资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。④KOH溶于醇,微溶于乙醚。
回答下列问题:
(1)装置A为氯气发生装置,KMnO4体现的性质是___________ ,玻璃管的作用是___________ 。
(2)装置B中盛放的试剂是___________ 。
(3)装置C中KOH溶液过量的目的是___________ 。搅拌操作,除了防止因局部溶液碱性减弱,使K2FeO4与水反应产生Fe(OH)3和O2,另外的作用是___________ 。
(4)装置C中生成K2FeO4的离子方程式为___________ 。该反应放热,不利于K2FeO4固体析出,写出一条实验改进措施___________ 。
(5)反应结束后过滤装置C中浊液,得到K2FeO4粗产品,用冷的3 mo·L-1KOH溶液洗涤粗产品后,再用___________ 除水。(填标号)
a.苯 b.浓硫酸 c.异丙醇
(6)装置D的作用是___________ 。

查阅K2FeO4资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。④KOH溶于醇,微溶于乙醚。
回答下列问题:
(1)装置A为氯气发生装置,KMnO4体现的性质是
(2)装置B中盛放的试剂是
(3)装置C中KOH溶液过量的目的是
(4)装置C中生成K2FeO4的离子方程式为
(5)反应结束后过滤装置C中浊液,得到K2FeO4粗产品,用冷的3 mo·L-1KOH溶液洗涤粗产品后,再用
a.苯 b.浓硫酸 c.异丙醇
(6)装置D的作用是
您最近一年使用:0次
2023-09-07更新
|
581次组卷
|
3卷引用:宁夏石嘴山市平罗中学2023-2024学年高三上学期期中考试化学试题
解题方法
8 . 高锰酸钾溶液常用于物质的定性检验与定量分析。实验宝里欲用KMnO4固体来配制200mL 0.1mol⋅L-1的KMnO4溶液。(已知KMnO4的摩尔质量:158g/mol)
(1)配制溶液时,必须用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、_______ 。
(2)计算所需KMnO4固体的质量为_______ g。
(3)写出配制的正确操作顺序(用字母表示,每个字母只能用一次):_______ 。
A.洗涤 B.称量、溶解 C.转移 D.摇匀 E.定容
(4)下列有关KMnO4溶液配制的操作,错误的有_______ 。
(5)配制过程中,下列操作导致溶液浓度偏小的是 _______(填序号)。
(6)为了增强高锰酸钾溶液的氧化性,需要加入2mol/L的稀硫酸溶液。已知用其测定某补血剂片中亚铁的含量的过程中发生的化学反应方程式为:10FeSO4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O。
测定步骤如下:
①称取含FeSO4·7H2O的补血剂片ag,充分研磨后溶于水,配成100mL溶液;
②取25.00mL的该溶液与0.1mol/L的酸性高锰酸钾溶液反应,消耗酸性高锰酸钾溶液25.00mL。
a.测定过程中共消耗_______ mol KMnO4,可计算出该补血剂中FeSO4·7H2O的质量分数为 _______ (用a表示,已知FeSO4•·7H2O的摩尔质量:278g/mol)。
b.请用双线桥表示该反应的电子转移情况:_______ 。
(1)配制溶液时,必须用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、
(2)计算所需KMnO4固体的质量为
(3)写出配制的正确操作顺序(用字母表示,每个字母只能用一次):
A.洗涤 B.称量、溶解 C.转移 D.摇匀 E.定容
(4)下列有关KMnO4溶液配制的操作,错误的有
| A.称量 | B.溶解 | C.转移时,玻璃棒插在刻度线以上 | D.定容 |
 |  |  | 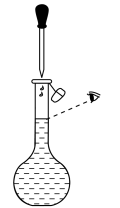 |
| A.加水定容时俯视刻度线 |
| B.容量瓶未干燥处理 |
| C.定容摇匀后,发现液面低于容量瓶刻度,又加水至刻度线 |
| D.称量KMnO4固体的质量时,托盘天平左侧放砝码 |
测定步骤如下:
①称取含FeSO4·7H2O的补血剂片ag,充分研磨后溶于水,配成100mL溶液;
②取25.00mL的该溶液与0.1mol/L的酸性高锰酸钾溶液反应,消耗酸性高锰酸钾溶液25.00mL。
a.测定过程中共消耗
b.请用双线桥表示该反应的电子转移情况:
您最近一年使用:0次
名校
解题方法
9 . 某同学在疫情期间通过KClO3+H2C2O4→CO2↑+ClO2↑+K2CO3+H2O(未配平)的方程自制高效消毒剂ClO2,下列说法正确的是
| A.该反应方程式配平后各物质前的系数分别为2,1,1,2,1,1 |
| B.若有18g H2C2O4参与反应,则会生成8.96L的ClO2气体 |
| C.氧化剂和还原剂的物质的量之比为1:2 |
| D.每生成1mol ClO2转移2NA电子 |
您最近一年使用:0次
2022-12-02更新
|
188次组卷
|
2卷引用:宁夏银川三沙源上游学校2022-2023学年高一上学期期中考试化学试题
10 . 根据下列氧化还原反应:
①2I-+Cl2=I2+2Cl-;
②2Fe3++2I-=2Fe2++I2;
③2Fe2++Cl2=2Fe3++2Cl-;
④2MnO +10Cl-+16H+=2Mn2++5Cl2+8H2O。
+10Cl-+16H+=2Mn2++5Cl2+8H2O。
下列结论中正确的是
①2I-+Cl2=I2+2Cl-;
②2Fe3++2I-=2Fe2++I2;
③2Fe2++Cl2=2Fe3++2Cl-;
④2MnO
 +10Cl-+16H+=2Mn2++5Cl2+8H2O。
+10Cl-+16H+=2Mn2++5Cl2+8H2O。下列结论中正确的是
A.Mn2+是MnO 的氧化产物,I2是I-的还原产物 的氧化产物,I2是I-的还原产物 |
B.氧化性强弱顺序为:MnO >Cl2>Fe3+>I2 >Cl2>Fe3+>I2 |
| C.反应②中Fe3+被氧化,I-被还原 |
D.在溶液中不可能发生反应:MnO +5Fe2++8H+=Mn2++5Fe3++4H2O +5Fe2++8H+=Mn2++5Fe3++4H2O |
您最近一年使用:0次



