名校
1 . 碘化钠可用于医学和摄影。实验室制备NaI的基本实验步骤为:①检查装置气密性;②关闭K,向B中滴入30%NaOH溶液3;③打开K,通入H2S至饱和制得NaI,同时有黄色沉淀产生;④关闭K,水浴加热,充分逸出H2S;⑤把B中的混合液倒入烧杯,加入足量碳酸钡除去稀硫酸
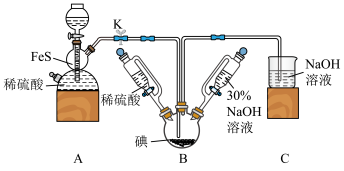
回答下列问题:
(1)A装置中的仪器名称为_______ ,利用此装置还可以制取 _______ (任写一种合理即可)。
(2)盛稀硫酸和30%NaOH溶液的仪器与分液漏斗相比,其优点是_______ 。
(3)A装置中发生反应的化学方程式为_______ 。
(4)通入H2S至饱和,与NaIO3反应制得NaI的离子方程式为_______ 。
(5)步骤⑤中的“一系列操作”包括过滤、洗涤、合并滤液和洗涤液、_______ 等操作。
(6)三颈烧瓶加入5.08g碘单质,若反应的产率为88%,则最终得到产品的质量为_______ 。

回答下列问题:
(1)A装置中的仪器名称为
(2)盛稀硫酸和30%NaOH溶液的仪器与分液漏斗相比,其优点是
(3)A装置中发生反应的化学方程式为
(4)通入H2S至饱和,与NaIO3反应制得NaI的离子方程式为
(5)步骤⑤中的“一系列操作”包括过滤、洗涤、合并滤液和洗涤液、
(6)三颈烧瓶加入5.08g碘单质,若反应的产率为88%,则最终得到产品的质量为
您最近一年使用:0次
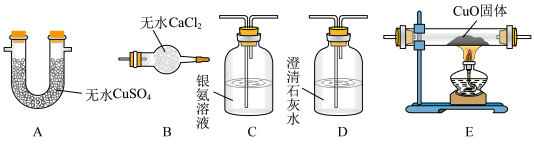
2 . 为探究甲醛与新制Cu(OH)2反应的产物,设计了如下实验。回答下列问题:
I.反应装置如下:
(1)仪器a的名称是___________ ,该反应需控制温度为65℃,宜采用的加热方式为___________ (填标号)。
A.酒精灯加热 B.砂浴 C.油浴 D.水浴
II.为探究气体产物、溶液中产物与固体产物的成分,小组同学经过讨论分析后,关于产物成分有如下猜想:
(2)为确定气体成分,下列实验装置的连接顺序是___________ ( 按气流方向填大写字母,个别装置可重复使用)。(已知:CO与银氨溶液能发生氧化还原反应)___________ 。
(3)为确定溶液中产物与固体产物,小组做了以下实验: (无色),Cu(NH3)
(无色),Cu(NH3) 易被氧化生成Cu(NH3)
易被氧化生成Cu(NH3)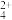 。
。
①由实验现象可知,液体产物中存在离子是___________ (填离子符号)。
②滤渣1中加入足量浓氨水时,主要反应的离子方程式为___________ 。
③滤液2在空气中放置一段时间后,显蓝色的离子是___________ (填离子符号)。
④通过定量测定发现,固体产物主要是铜。综合以上分析,若主要还原产物的物质的量相等,甲醛与新制氢氧化铜发生的主要反应的化学方程式是___________ 。
I.反应装置如下:
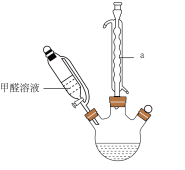
(1)仪器a的名称是
A.酒精灯加热 B.砂浴 C.油浴 D.水浴
II.为探究气体产物、溶液中产物与固体产物的成分,小组同学经过讨论分析后,关于产物成分有如下猜想:
| 气体产物 | H2、CO、CO2 |
| 溶液中产物 | HCOO-、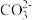 |
| 固体产物 | Cu、Cu2O |
(3)为确定溶液中产物与固体产物,小组做了以下实验:
 (无色),Cu(NH3)
(无色),Cu(NH3) 易被氧化生成Cu(NH3)
易被氧化生成Cu(NH3) 。
。①由实验现象可知,液体产物中存在离子是
②滤渣1中加入足量浓氨水时,主要反应的离子方程式为
③滤液2在空气中放置一段时间后,显蓝色的离子是
④通过定量测定发现,固体产物主要是铜。综合以上分析,若主要还原产物的物质的量相等,甲醛与新制氢氧化铜发生的主要反应的化学方程式是
您最近一年使用:0次
2023-06-19更新
|
100次组卷
|
4卷引用:2023届宁夏石嘴山第三中学高三下学期第四次模拟理科综合试题
3 . 工业上用红土镍矿(主要成分为NiO,含 CoO、FeO、Fe2O3、Al2O3、MgO、CaO和SiO2)制备 NiSO4·6H2O。工艺流程如下所示。

已知:溶液中金属离子开始沉淀和完全沉淀的pH:
(1)加入H2SO4在高压下进行酸浸。充分浸取后过滤出的酸浸渣的主要成分为_______ (填化学式)。
(2)氧化、沉铁沉铝时,加入 NaClO 和 Na2CO3溶液共同作用。其中与FeSO4发生氧化还原反应的离子方程式为_______ 。
(3)沉镁沉钙加入NaF溶液,生成MgF2和CaF2.若沉淀前溶液中c(Ca2+)=1.0×10-3 mol·L-1,当沉淀完全后滤液中c(Mg2+)=1.5×10-6mol·L-1时,除钙率为_______ (忽略沉淀前后溶液体积变化)。(已知:Ksp(CaF2)=1.5×10-10、Ksp(MgF2)=7.5×10-11)
(4)“萃取”可将金属离子进行富集与分离,原理如下:M2+(水相)+2RH (有机相) MR2(有机相)+2H+(水相)。工业上用25%P5O7+5%TBP+70%磺化煤油做萃取剂,萃取时, Co、Ni的浸出率和 Co/Ni分离因素随pH的关系如图所示:
MR2(有机相)+2H+(水相)。工业上用25%P5O7+5%TBP+70%磺化煤油做萃取剂,萃取时, Co、Ni的浸出率和 Co/Ni分离因素随pH的关系如图所示:

①萃取时,选择pH为_______ 左右。
②反萃取的试剂为_______ 。
(5)资料显示,硫酸镍结晶水合物的形态与温度有如下关系。
由 NiSO4溶液获得稳定的NiSO4·6H2O 晶体的操作依次是蒸发浓缩、_______ 、过滤、洗涤、干燥。

已知:溶液中金属离子开始沉淀和完全沉淀的pH:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ | Co2+ | Mg2+ |
| 开始沉淀时的pH | 6.8 | 4.1 | 2.2 | 7.5 | 7.2 | 9.4 |
| 沉淀完全时的pH | 9.2 | 5.4 | 3.2 | 9.0 | 9.0 | 12.4 |
(2)氧化、沉铁沉铝时,加入 NaClO 和 Na2CO3溶液共同作用。其中与FeSO4发生氧化还原反应的离子方程式为
(3)沉镁沉钙加入NaF溶液,生成MgF2和CaF2.若沉淀前溶液中c(Ca2+)=1.0×10-3 mol·L-1,当沉淀完全后滤液中c(Mg2+)=1.5×10-6mol·L-1时,除钙率为
(4)“萃取”可将金属离子进行富集与分离,原理如下:M2+(水相)+2RH (有机相)
 MR2(有机相)+2H+(水相)。工业上用25%P5O7+5%TBP+70%磺化煤油做萃取剂,萃取时, Co、Ni的浸出率和 Co/Ni分离因素随pH的关系如图所示:
MR2(有机相)+2H+(水相)。工业上用25%P5O7+5%TBP+70%磺化煤油做萃取剂,萃取时, Co、Ni的浸出率和 Co/Ni分离因素随pH的关系如图所示:
①萃取时,选择pH为
②反萃取的试剂为
(5)资料显示,硫酸镍结晶水合物的形态与温度有如下关系。
| 温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
| 晶体形态 | NiSO4·7H2O | NiSO4·6H2O | 多种结晶水合物 | NiSO4 |
您最近一年使用:0次
2022-12-17更新
|
646次组卷
|
2卷引用:2023届宁夏回族自治区石嘴山市第三中学高三下学期第三次模拟考试理综试题
解题方法
4 . 用软锰矿(主要成分为MnO2,所含杂质为质量分数约8%Fe3O4和约5%Al2O3)和BaS制备高纯MnCO3,同时制得Ba(OH)2,工艺流程如下:
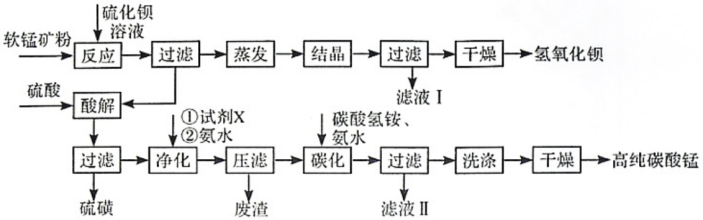
已知:25℃时相关物质的Ksp见下表
回答下列问题:
(1)MnO2与BaS溶液反应转化为MnO的化学方程式为___________ ,能否通过加热的方式加快该反应的速率,___________ (填“能”或“否”)
(2)已知MnO2为两性氧化物,保持BaS投料量不变,随软锰矿粉与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是___________ 。
(3)在实验室进行过滤操作时,除了使用铁架台和烧杯以外,还需要的玻璃仪器为___________ 。
(4)净化时需先加入的试剂X为___________ (填化学式) 。再使用氨水调溶液的pH,则pH的理论最小值为___________ (当溶液中某离子浓度小于1.0×10-5mol•L-1时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为___________ 。

已知:25℃时相关物质的Ksp见下表
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 |
(1)MnO2与BaS溶液反应转化为MnO的化学方程式为
(2)已知MnO2为两性氧化物,保持BaS投料量不变,随软锰矿粉与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是
(3)在实验室进行过滤操作时,除了使用铁架台和烧杯以外,还需要的玻璃仪器为
(4)净化时需先加入的试剂X为
(5)碳化过程中发生反应的离子方程式为
您最近一年使用:0次
2021-03-14更新
|
445次组卷
|
3卷引用:宁夏石嘴山市2021届高三下学期3月高考质量监测(一模) 化学试题
名校
解题方法
5 . 一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜的工艺流程如图所示:
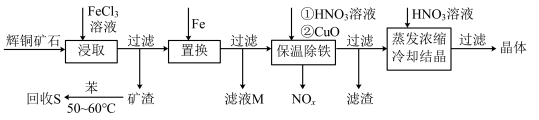
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:___ 。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S +2CuCl2=4CuCl+S;②___ 。
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是___ 。
(4)向滤液M中加入(或通入)___ (填字母),可得到一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是__ ;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由_ 。
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2mol电子,生成Cu2S___ mol。


(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S +2CuCl2=4CuCl+S;②
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是
(4)向滤液M中加入(或通入)
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2mol电子,生成Cu2S

您最近一年使用:0次
2019-12-19更新
|
1284次组卷
|
10卷引用:宁夏六盘山高级中学2020届高三下学期第二次模拟考试理综化学试题
宁夏六盘山高级中学2020届高三下学期第二次模拟考试理综化学试题宁夏石嘴山市第三中学2020届高三第五次模拟考试理综化学试题2022届陕西省宝鸡市陈仓区高考模拟检测(二)理综化学试题广东省六校联盟(深圳实验,广州二中,珠海一中,惠州一中,东莞中学,中山纪中)2020届高三第二次联考理综化学试题2020届高三《新题速递·化学》1月第01期(考点11-13)江西省南昌市第二中学2020届高三5月模拟理综化学试题江西省南昌市第二中学2021届高三上学期第四次考试理综化学试题江西省新余市第四中学2021届高三化学上学期第四次考试试题天津市河东区2022-2023学年高三上学期期中检测化学试题(已下线)第三章 金属及其化合物 第15练 金属材料 金属冶炼
6 . 【化学选修-化学与技术】铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作______________ 剂。
(2)自然界中Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。写出过程中的离子方程式:___________________________ 。
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是_________________________________________________ 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:
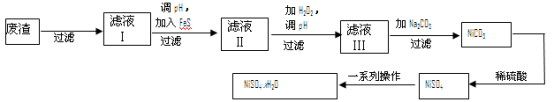
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为______________ 。
②对滤液Ⅱ先加H2O2再调pH,加H2O2的目的是______________ ,调pH的目的是________________ 。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是_______________________________________________________ 。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作
(2)自然界中Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。写出过程中的离子方程式:
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:

①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为
②对滤液Ⅱ先加H2O2再调pH,加H2O2的目的是
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是
您最近一年使用:0次
2019-01-30更新
|
542次组卷
|
2卷引用:2015届宁夏银川市第九中学高三下学期第一次模考理综化学试卷
名校
解题方法
7 . 草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
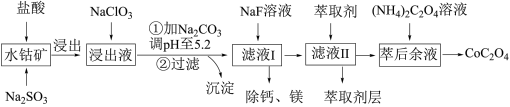
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是将_____________ 还原(填离子符号)以便固体溶解。该步反应的离子方程式为____________________ (写一个)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为____________________ 。
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是____________________ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是________ ;使用萃取剂适宜的pH=____ (填序号)左右:

A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=__________ 。

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是

A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=
您最近一年使用:0次
2016-12-09更新
|
197次组卷
|
5卷引用:2017届宁夏石嘴山市第三中学高三4月适应性(第二次模拟)考试理综化学试卷
名校
解题方法
8 . 硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取,其工艺流程如下图所示。
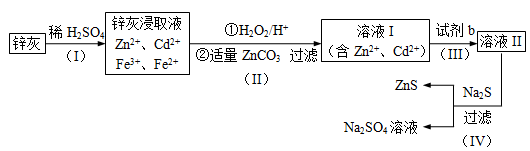
(1)为提高锌灰的浸取率,可采用的方法是______________ (填序号)。
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是_______________ 写化学式)。
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为____________ 。
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S。
①检验ZnS固体是否洗涤干净的方法是______________ ;
②Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取。化学反应方程式为_______________________________ ;
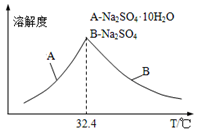
③已知Na2SO4·10H2O及Na2SO4的溶解度随温度变化曲线如图。从滤液中得到Na2SO4·10H2O的操作方法是_______________________________ 。
(5)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL、物质的量浓度为c mol/L的Na2SO4溶液。则理论上所用锌灰中含有锌元素的质量为____________ 。

(1)为提高锌灰的浸取率,可采用的方法是
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S。
①检验ZnS固体是否洗涤干净的方法是
②Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取。化学反应方程式为
③已知Na2SO4·10H2O及Na2SO4的溶解度随温度变化曲线如图。从滤液中得到Na2SO4·10H2O的操作方法是

(5)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL、物质的量浓度为c mol/L的Na2SO4溶液。则理论上所用锌灰中含有锌元素的质量为
您最近一年使用:0次
2016-12-09更新
|
403次组卷
|
7卷引用:2016届宁夏六盘山高中高三第四次模拟理综化学试卷1
真题
解题方法
9 . 由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:

(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000°C左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物,该过程中两个主要反应的化学方程式分别是_______ ,
_______ 反射炉内生成炉渣的主要成分是________ ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200°C左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是________ 、________ ;
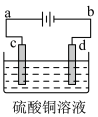
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板应是图中电极 (填图中的字母);在电极d上发生的电极反应式为_______ ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为______ 。

(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000°C左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物,该过程中两个主要反应的化学方程式分别是
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200°C左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板应是图中电极 (填图中的字母);在电极d上发生的电极反应式为

您最近一年使用:0次
2016-12-09更新
|
1088次组卷
|
11卷引用:2016届宁夏六盘山高中高三三模理综化学试卷
2016届宁夏六盘山高中高三三模理综化学试卷2015届江西省上饶市高三第二次高考模拟化学试卷2016届宁夏回族自治区银川一中高三上第四次月考理化学试卷(已下线)2014届河南省许昌平顶山新乡三市高三第一次调研理综化学试卷(已下线)2014届江西省赣州市四所重点中学高三上学期期末联考理综化学试卷2012年普通高等学校招生全国统一考试化学(新课标)(已下线)2014高考名师推荐化学--预测102016届重庆市巴蜀中学高三上学期期中考试理综化学试卷2016届黑龙江省牡丹江高级中学高三上期末热身理综化学试卷2016届福建省福安市高级中学高三3月月考化学试卷2016届福建省龙岩市高中毕业班3月质量检查理综化学试卷
2014·宁夏银川·二模
10 . 第五主族的磷单质及其化合物在工业上有广泛应用.
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)═3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)═6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)═P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)═CaSiO3(s)△H3
用△H1、△H2和△H3表示△H,则△H=______ ;
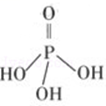
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子产物,其结构式为______ ,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为______ ;
(3)次磷酸钠(NaH2PO2)可用于工业上的化学镀镍.
①化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性等条件下发生下述反应:
(a) Ni2++ H2PO2﹣+ → Ni++ H2PO3﹣+
(b)6H2PO﹣2+2H+═2P+4H2PO3+3H2↑
请在答题卡上写出并配平反应式(a)___________________________ ;
②利用①中反应可在塑料镀件表面沉积镍﹣磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀.请从以下方面比较化学镀与电镀.
方法上的不同点:______ ;
原理上的不同点:______ ;
化学镀的优点:______ .
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)═3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)═6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)═P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)═CaSiO3(s)△H3
用△H1、△H2和△H3表示△H,则△H=
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子产物,其结构式为

(3)次磷酸钠(NaH2PO2)可用于工业上的化学镀镍.
①化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性等条件下发生下述反应:
(a) Ni2++ H2PO2﹣+ → Ni++ H2PO3﹣+
(b)6H2PO﹣2+2H+═2P+4H2PO3+3H2↑
请在答题卡上写出并配平反应式(a)
②利用①中反应可在塑料镀件表面沉积镍﹣磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀.请从以下方面比较化学镀与电镀.
方法上的不同点:
原理上的不同点:
化学镀的优点:
您最近一年使用:0次
2014-06-17更新
|
1050次组卷
|
4卷引用:2013-2014宁夏银川市第一中学高三第二次模拟考试理综化学试卷
(已下线)2013-2014宁夏银川市第一中学高三第二次模拟考试理综化学试卷2015届北京市怀柔区高三4月模拟练习化学试卷贵州省织金县一中2019届高三上学期12月份考试化学试题山东省泰安市2020届高三化学一轮复习《化学与技术》专题测试



