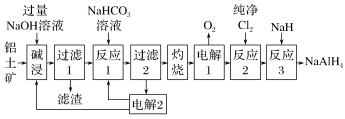
第五主族的磷单质及其化合物在工业上有广泛应用.
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)═3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)═6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)═P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)═CaSiO3(s)△H3
用△H1、△H2和△H3表示△H,则△H=______ ;
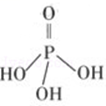
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子产物,其结构式为______ ,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为______ ;
(3)次磷酸钠(NaH2PO2)可用于工业上的化学镀镍.
①化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性等条件下发生下述反应:
(a) Ni2++ H2PO2﹣+ → Ni++ H2PO3﹣+
(b)6H2PO﹣2+2H+═2P+4H2PO3+3H2↑
请在答题卡上写出并配平反应式(a)___________________________ ;
②利用①中反应可在塑料镀件表面沉积镍﹣磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀.请从以下方面比较化学镀与电镀.
方法上的不同点:______ ;
原理上的不同点:______ ;
化学镀的优点:______ .
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)═3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)═6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)═P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)═CaSiO3(s)△H3
用△H1、△H2和△H3表示△H,则△H=
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子产物,其结构式为

(3)次磷酸钠(NaH2PO2)可用于工业上的化学镀镍.
①化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性等条件下发生下述反应:
(a) Ni2++ H2PO2﹣+ → Ni++ H2PO3﹣+
(b)6H2PO﹣2+2H+═2P+4H2PO3+3H2↑
请在答题卡上写出并配平反应式(a)
②利用①中反应可在塑料镀件表面沉积镍﹣磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀.请从以下方面比较化学镀与电镀.
方法上的不同点:
原理上的不同点:
化学镀的优点:
2014·宁夏银川·二模 查看更多[4]
山东省泰安市2020届高三化学一轮复习《化学与技术》专题测试贵州省织金县一中2019届高三上学期12月份考试化学试题2015届北京市怀柔区高三4月模拟练习化学试卷(已下线)2013-2014宁夏银川市第一中学高三第二次模拟考试理综化学试卷
更新时间:2014-06-17 15:50:10
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题:
(1)若将50mL4mol·L-1稀硝酸和200mL0.5mol·L-1稀硫酸混合后,加入19.2g铜粉,微热,充分反应。若忽略溶液体积变化,溶液中铜离子物质的量浓度为____ mol·L-1。
(2)处理某废水时,反应过程中部分离子浓度与反应进程关系如图,反应过程中主要存在N2、HCO 、ClO-、CNO-(C为+4价)、Cl-等微粒。写出处理该废水时发生反应的离子方程式
、ClO-、CNO-(C为+4价)、Cl-等微粒。写出处理该废水时发生反应的离子方程式____ 。

(3)Na2Sx(X=2,4,6,8等)在碱性溶液中可被NaClO氧化为Na2SO4。
Na2Sx中含有的化学键类型有___ 。
(4)足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与11.2LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是____ mL。
(5)次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
①H3PO2与足量NaOH溶液反应生成NaH2PO2。已知:NaH2PO2的水溶液呈碱性,则H3PO2是____ 酸(填“强”或“弱”):写出H3PO2的电离方程式:____ 。
②H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质,从而可用于化学镀银,利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,写出化学镀银反应的离子方程式____ 。
(1)若将50mL4mol·L-1稀硝酸和200mL0.5mol·L-1稀硫酸混合后,加入19.2g铜粉,微热,充分反应。若忽略溶液体积变化,溶液中铜离子物质的量浓度为
(2)处理某废水时,反应过程中部分离子浓度与反应进程关系如图,反应过程中主要存在N2、HCO
 、ClO-、CNO-(C为+4价)、Cl-等微粒。写出处理该废水时发生反应的离子方程式
、ClO-、CNO-(C为+4价)、Cl-等微粒。写出处理该废水时发生反应的离子方程式
(3)Na2Sx(X=2,4,6,8等)在碱性溶液中可被NaClO氧化为Na2SO4。
Na2Sx中含有的化学键类型有
(4)足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与11.2LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
(5)次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
①H3PO2与足量NaOH溶液反应生成NaH2PO2。已知:NaH2PO2的水溶液呈碱性,则H3PO2是
②H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质,从而可用于化学镀银,利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,写出化学镀银反应的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】硫酸镍 在强碱溶液中用
在强碱溶液中用 氧化,可沉淀出能用作镍镉电池正极材料的
氧化,可沉淀出能用作镍镉电池正极材料的 。写出该反应的离子方程式
。写出该反应的离子方程式_______ 。
 在强碱溶液中用
在强碱溶液中用 氧化,可沉淀出能用作镍镉电池正极材料的
氧化,可沉淀出能用作镍镉电池正极材料的 。写出该反应的离子方程式
。写出该反应的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
Ⅰ.(1)所含铁元素既有氧化性又有还原性的物质是________ (填字母)。
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是( )
A. NaNO2被氧化 B. 药品美蓝是还原剂
C. NaNO2是还原剂 D. 药品美蓝被还原
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:________________________________ 。
Ⅱ. 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中Na2O2是________ (填“氧化剂”或“还原剂”)。
(5)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。
、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3∶2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:__________________________________________ 。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为________ mol。
Ⅰ.(1)所含铁元素既有氧化性又有还原性的物质是
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是
A. NaNO2被氧化 B. 药品美蓝是还原剂
C. NaNO2是还原剂 D. 药品美蓝被还原
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:
Ⅱ. 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中Na2O2是
(5)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。
、Cl-、H2O。①碱性条件下,氧化剂和还原剂的物质的量的比为3∶2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】2030年前实现碳达峰的承诺,体现了中国的大国风范。甲烷和二氧化碳重整制合成气的研究是实现碳达峰的手段之一、甲烧和二氧化碳重整制合成气的反应为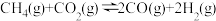
 。
。
已知:i.部分化学键键能数据如下表。
ii.副反应Ⅰ:
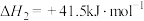
副反应Ⅱ:

(1)①
___________  ,
,
___________  。
。
②副反应Ⅱ属于___________ (选填“熵增”或“熵减”)反应。
(2)已知甲烷和二氧化碳重整制合成气反应的正反应速率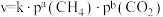 ,k为速率常数。900℃时,其他反应条件不变,只改变
,k为速率常数。900℃时,其他反应条件不变,只改变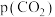 或
或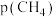 时,正反应速率v的变化如图1所示。
时,正反应速率v的变化如图1所示。
①若 和
和 的分压均为p1时,a=
的分压均为p1时,a=___________ ,b=___________ 。
②若 和
和 的分压相等,分别为p2和p3两种情况下的正反应速率之比为
的分压相等,分别为p2和p3两种情况下的正反应速率之比为___________ 。
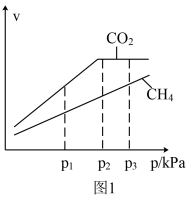
(3)在一定条件下,向某密闭容器中充入一定量的甲烷和二氧化碳,同时发生上述三个反应。反应过程中的 平衡转化率(α)与温度和压强的关系如图2所示。
平衡转化率(α)与温度和压强的关系如图2所示。
 值随压强升高而减小的原因为
值随压强升高而减小的原因为___________ ;图2中的温度由大到小为___________ ,其判断理由为___________ 。
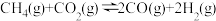
 。
。已知:i.部分化学键键能数据如下表。
| 化学键 | C-H | C=O | H-H |  |
| 键能/(kJ/mol) | 413 | 745 | 436 | 1011 |

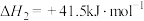
副反应Ⅱ:


(1)①

 ,
,
 。
。②副反应Ⅱ属于
(2)已知甲烷和二氧化碳重整制合成气反应的正反应速率
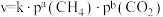 ,k为速率常数。900℃时,其他反应条件不变,只改变
,k为速率常数。900℃时,其他反应条件不变,只改变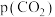 或
或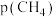 时,正反应速率v的变化如图1所示。
时,正反应速率v的变化如图1所示。
①若
 和
和 的分压均为p1时,a=
的分压均为p1时,a=②若
 和
和 的分压相等,分别为p2和p3两种情况下的正反应速率之比为
的分压相等,分别为p2和p3两种情况下的正反应速率之比为(3)在一定条件下,向某密闭容器中充入一定量的甲烷和二氧化碳,同时发生上述三个反应。反应过程中的
 平衡转化率(α)与温度和压强的关系如图2所示。
平衡转化率(α)与温度和压强的关系如图2所示。
 值随压强升高而减小的原因为
值随压强升高而减小的原因为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol液态水消耗的能量是____________ kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_______________ ;
(3)在以甲醇为燃料、电解质为稀硫酸的燃料电池中,甲醇发生________ 反应(填“氧化”或“还原”),正极反应式为_________________________ ;
(4)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下反应:
甲醇合成反应:①CO(g)+ 2H2(g)=CH3OH(g) ΔH1=-90.1kJ·mol‒1
水煤气变换反应:②CO(g) + H2O (g)=CO2(g)+H2(g) ΔH2=-41.1kJ·mol‒1
二甲醚合成反应:③2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH3=-24.5 kJ·mol‒1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为___________ ,二甲醚直接燃料电池具有启动快,效率高等优点,其能量密度高于甲醇直接燃料电池,若电解质为碱性,二甲醚燃料电池的负极反应式为______________________________ 。
(1)用太阳能分解10mol液态水消耗的能量是
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为
(3)在以甲醇为燃料、电解质为稀硫酸的燃料电池中,甲醇发生
(4)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下反应:
甲醇合成反应:①CO(g)+ 2H2(g)=CH3OH(g) ΔH1=-90.1kJ·mol‒1
水煤气变换反应:②CO(g) + H2O (g)=CO2(g)+H2(g) ΔH2=-41.1kJ·mol‒1
二甲醚合成反应:③2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH3=-24.5 kJ·mol‒1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为
您最近一年使用:0次
【推荐3】化学反应往往伴随着能量的变化,请完成以下问题
Ⅰ.已知:2H2(g)+O2(g)=2H2O(g) ΔΗ=-483.6kJ·mol-1
N2(g)+2O2(g)=2NO2(g) ΔΗ=+67.7kJ·mol-1
则反应4H2(g)+2NO2(g)=N2(g)+4H2O(g)的反应热ΔΗ=_____ 。
Ⅱ.断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子,所吸收的能量称为A—B键的键能。下表列出了一些化学键的键能E:
请回答下列问题:
(1)如图表示某反应的能量变化关系,则此反应为__________ (填“吸热”或“放热”)反应。
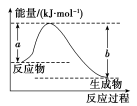
(2)若图示表示反应H2(g)+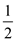 O2(g)=H2O(g) ΔH=-242 kJ·mol-1,x=
O2(g)=H2O(g) ΔH=-242 kJ·mol-1,x=___________ 。
(3)由非金属性,可用CuCl2作催化剂,在450 ℃利用空气中的氧气跟氯化氢反应制氯气,反应的化学方程式为_________________________ 。
若忽略温度和压强对反应热的影响,根据上题中的有关数据,计算当反应中有1 mol 电子转移时,反应的能量变化为______ 。
Ⅰ.已知:2H2(g)+O2(g)=2H2O(g) ΔΗ=-483.6kJ·mol-1
N2(g)+2O2(g)=2NO2(g) ΔΗ=+67.7kJ·mol-1
则反应4H2(g)+2NO2(g)=N2(g)+4H2O(g)的反应热ΔΗ=
Ⅱ.断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子,所吸收的能量称为A—B键的键能。下表列出了一些化学键的键能E:
| 化学键 | H—H | Cl—Cl | O=O | C—Cl | C—H | O—H | H—Cl |
| E/(kJ·mol-1) | 436 | 247 | x | 330 | 413 | 463 | 431 |
请回答下列问题:
(1)如图表示某反应的能量变化关系,则此反应为

(2)若图示表示反应H2(g)+
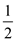 O2(g)=H2O(g) ΔH=-242 kJ·mol-1,x=
O2(g)=H2O(g) ΔH=-242 kJ·mol-1,x=(3)由非金属性,可用CuCl2作催化剂,在450 ℃利用空气中的氧气跟氯化氢反应制氯气,反应的化学方程式为
若忽略温度和压强对反应热的影响,根据上题中的有关数据,计算当反应中有1 mol 电子转移时,反应的能量变化为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】实验室可用如图装置制备无水FeCl3。已知FeCl3易升华,易吸收水分而潮解。请回答下列问题:

(1)连接好仪器后首先应进行的操作是___________ 。
(2)A装置中发生反应的离子方程式为___________ ,当加入一定量的浓盐酸与足量MnO2反应,实际生成的Cl2体积小于理论值的原因是___________ 。
(3)装置B的作用是___________ , D中发生反应的化学方程式为___________ 。
(4)D中盛放铁粉的硬质玻璃管与E中收集器之间选用较粗导管的原因是___________ 。
(5)F中所装试剂为___________ ,目的是___________ 。

(1)连接好仪器后首先应进行的操作是
(2)A装置中发生反应的离子方程式为
(3)装置B的作用是
(4)D中盛放铁粉的硬质玻璃管与E中收集器之间选用较粗导管的原因是
(5)F中所装试剂为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】氮元素形成的化合物种类十分丰富。请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:

(1)下列有关NH3的说法中,不正确的是___________。
(2)NH3易溶于水,标准状况下,用充满NH3的烧瓶做喷泉实验(如图),引发喷泉的方法是________________________ ,水充满整个烧瓶后所形成溶液的物质的量浓度为___________ mol·L-1。

(3)氨气在氧化炉中发生反应的化学方程式为_____________________ 。
(4)HNO3是一种重要的化工原料,工厂生产出的浓硝酸可用铝槽车或铁槽车来运输。在常温下能使铝、铁钝化,说明浓硝酸具有很强的___________ 性。
(5)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下两种方法处理:
①纯碱溶液吸收法。纯碱溶液与NO2的反应原理为Na2CO3+NO2=NaNO3+___________ +CO2(不需配平,请填写缺少物质的化学式)。
②氨转化法。已知7 mol氨恰好能将含NO和NO2共6 mol 的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为___________ 。

(1)下列有关NH3的说法中,不正确的是___________。
| A.工业合成NH3需要在高温高压催化剂下进行 |
| B.NH3可用来生产碳铵和尿素等化肥 |
| C.NH3可用浓硫酸或无水氯化钙干燥 |
| D.NH3受热易分解,须置于冷暗处保存 |

(3)氨气在氧化炉中发生反应的化学方程式为
(4)HNO3是一种重要的化工原料,工厂生产出的浓硝酸可用铝槽车或铁槽车来运输。在常温下能使铝、铁钝化,说明浓硝酸具有很强的
(5)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下两种方法处理:
①纯碱溶液吸收法。纯碱溶液与NO2的反应原理为Na2CO3+NO2=NaNO3+
②氨转化法。已知7 mol氨恰好能将含NO和NO2共6 mol 的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
您最近一年使用:0次