名校
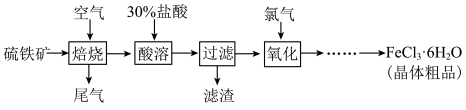
1 . 以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:___________ ,检验氧化生成的阳离子的试剂是___________ 。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气VL测定SO2含量:
方案一:让尾气缓慢通过以下装置。___________ ,该装置的作用是___________ 。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理___________ (填“是”或“否”)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为mg。
①加入过量氯化钡溶液的目的是___________ 。
②进行沉淀洗涤的方法是___________ 。
③SO2含量的表达式是___________ (用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3·6H2O晶体的操作包括___________ 、冷却结晶、过滤,该过程需保持盐酸过量,抑制Fe3+水解。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气VL测定SO2含量:
方案一:让尾气缓慢通过以下装置。
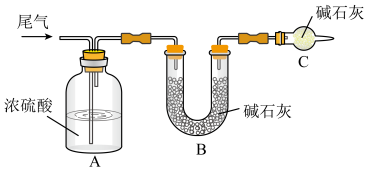
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为mg。
①加入过量氯化钡溶液的目的是
②进行沉淀洗涤的方法是
③SO2含量的表达式是
(3)从FeCl3溶液中得到FeCl3·6H2O晶体的操作包括
您最近一年使用:0次
名校
2 . 回答下列问题
(1)现有以下物质:a.NaOH溶液,b.液氨,c.Ba(OH)2固体,d.NaHSO4,e.Fe(OH)3胶体,f.铜,g.CO2,h.CH3COOH。
①以上物质中属于电解质的是___________ (填字母)。
②写出d在熔融时的电离方程式:___________ 。
③在d的水溶液中加入过量c的水溶液,发生反应的离子方程式为___________ 。
(2)高锰酸钾(硫酸酸化)溶液和草酸溶液的反应可用于测定血钙的含量。方法是取2mL血液用蒸馏水稀释后,向其中加入足量草酸铵晶体[化学式为(NH4)2C2O4],反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解后得到H2C2O4,再用KMnO4溶液滴定。
①高锰酸钾(硫酸酸化)溶液和草酸溶液的反应的化学方程式为:___________ ;
②用KMnO4溶液滴定H2C2O4时,判断滴定终点的方法是___________ 。
(3)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为___________ 。
(4)①钢铁在自然界中发生电化学腐蚀时的负极反应式为___________ ;
②碱性条件下,甲醇空气燃料电池的负极反应式为___________ 。
(1)现有以下物质:a.NaOH溶液,b.液氨,c.Ba(OH)2固体,d.NaHSO4,e.Fe(OH)3胶体,f.铜,g.CO2,h.CH3COOH。
①以上物质中属于电解质的是
②写出d在熔融时的电离方程式:
③在d的水溶液中加入过量c的水溶液,发生反应的离子方程式为
(2)高锰酸钾(硫酸酸化)溶液和草酸溶液的反应可用于测定血钙的含量。方法是取2mL血液用蒸馏水稀释后,向其中加入足量草酸铵晶体[化学式为(NH4)2C2O4],反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解后得到H2C2O4,再用KMnO4溶液滴定。
①高锰酸钾(硫酸酸化)溶液和草酸溶液的反应的化学方程式为:
②用KMnO4溶液滴定H2C2O4时,判断滴定终点的方法是
(3)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为
(4)①钢铁在自然界中发生电化学腐蚀时的负极反应式为
②碱性条件下,甲醇空气燃料电池的负极反应式为
您最近一年使用:0次
名校
3 . 某铜镉渣的主要成分为单质Zn、ZnSO4以及铜、镉(Cd)、铁、钴(Co)等金属单质或它们的氧化物。某同学以其为原料设计如图工艺流程回收铜、镉、铁、钴。
(1)“浸出”过程生成大量气体是___________ (填化学式),写出一种提高“浸出”效率和浸出率的措施:___________ 。
(2)“氧化除铁”原理是空气中的氧气将浸出液中的Fe2+氧化为α-FeOOH,写出该反应的离子方程式:___________ 。
(3)“除锰”时,参加反应的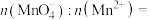
___________ 。
(4)若在实验室进行萃取“除铜”,所必须用到的仪器是___________ ,萃取前对仪器进行的操作是___________ ,放液时,上层液体由___________ (填“上口”或“下口”)倒(放)出。
(5)水相中主要含Co2+,经检测c(Co2+)=0.01mol·L-1。向水相通入氨气调节pH=___________ 时,水相中Co2+沉淀完全(已知常温下,Ksp[Co(OH)2]=1.0×10-15;溶液中c(Co2+)=1×10-5mol·L-1视为沉淀完全)。
(6)控制一定条件,用惰性电极电解ZnSO4溶液可制备单质锌,电解时阳极反应式为___________ 。
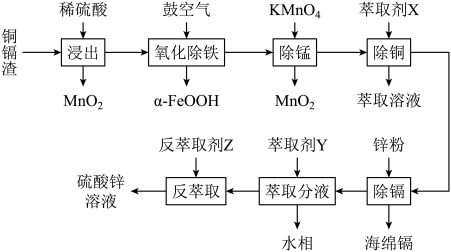
(1)“浸出”过程生成大量气体是
(2)“氧化除铁”原理是空气中的氧气将浸出液中的Fe2+氧化为α-FeOOH,写出该反应的离子方程式:
(3)“除锰”时,参加反应的
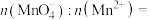
(4)若在实验室进行萃取“除铜”,所必须用到的仪器是
(5)水相中主要含Co2+,经检测c(Co2+)=0.01mol·L-1。向水相通入氨气调节pH=
(6)控制一定条件,用惰性电极电解ZnSO4溶液可制备单质锌,电解时阳极反应式为
您最近一年使用:0次
名校
解题方法
4 . 立德粉(主要成分为BaSO4 ZnS)常用作颜料。以粗氧化锌(主要成分为ZnO,还含少量CuO、Fe3O4等杂质)和BaS为原料制备立德粉的流程如图所示:
ZnS)常用作颜料。以粗氧化锌(主要成分为ZnO,还含少量CuO、Fe3O4等杂质)和BaS为原料制备立德粉的流程如图所示:___________ 。
(2)加入H2O2发生反应的离子方程式为___________ 。
(3)分离出Fe(OH)3的实验操作名称为___________ 。
(4)“除杂Ⅱ”中加入过量的锌粉主要除去___________ (填离子符号),该反应的反应类型为___________ 。
(5)“滤渣”的成分是___________ 。
(6)8.34 g绿矾(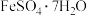 )晶体样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示:
)晶体样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示: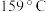 时固体N的化学式为
时固体N的化学式为___________ ,取适量  时所得的样品P,隔绝空气加热至
时所得的样品P,隔绝空气加热至 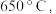 得到一种红棕色固体物质Q ,同时有两种无色气体生成,请写出该反应的化学方程式
得到一种红棕色固体物质Q ,同时有两种无色气体生成,请写出该反应的化学方程式___________ 。
 ZnS)常用作颜料。以粗氧化锌(主要成分为ZnO,还含少量CuO、Fe3O4等杂质)和BaS为原料制备立德粉的流程如图所示:
ZnS)常用作颜料。以粗氧化锌(主要成分为ZnO,还含少量CuO、Fe3O4等杂质)和BaS为原料制备立德粉的流程如图所示: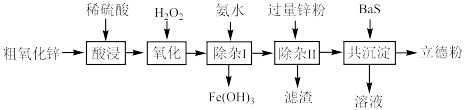
(2)加入H2O2发生反应的离子方程式为
(3)分离出Fe(OH)3的实验操作名称为
(4)“除杂Ⅱ”中加入过量的锌粉主要除去
(5)“滤渣”的成分是
(6)8.34 g绿矾(
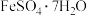 )晶体样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示:
)晶体样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示: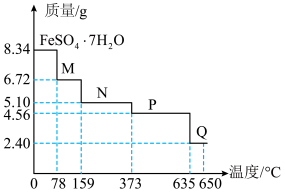
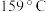 时固体N的化学式为
时固体N的化学式为 时所得的样品P,隔绝空气加热至
时所得的样品P,隔绝空气加热至 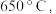 得到一种红棕色固体物质Q ,同时有两种无色气体生成,请写出该反应的化学方程式
得到一种红棕色固体物质Q ,同时有两种无色气体生成,请写出该反应的化学方程式
您最近一年使用:0次
2024-05-22更新
|
385次组卷
|
2卷引用:2024届重庆市乌江新高考协作体高三下学期模拟预测化学试题
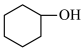
5 . 环己酮是无色油状液体, 时在水中的溶解度为
时在水中的溶解度为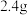 。实验室由环己醇制备环己酮。
。实验室由环己醇制备环己酮。
【实验原理】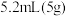 环已醇和
环已醇和 冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。
冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。
Ⅱ.在室温下继续搅拌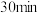 ,然后加入饱和亚硫酸氢钠溶液。
,然后加入饱和亚硫酸氢钠溶液。
Ⅲ.在反应混合物中加入 水、
水、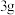 氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。
氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。
Ⅳ.在搅拌情况下向馏出液中加入无水碳酸钠至中性,然后再加入精制食盐使之饱和,将此液体倒入分液漏斗,分出有机层。
Ⅴ.向有机层中加入无水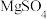 ,静置,过滤,对滤液进行蒸馏,得到产品
,静置,过滤,对滤液进行蒸馏,得到产品 。
。
回答下列问题。
(1)仪器X的名称为_______ 。
(2)步骤Ⅰ中,加入冰醋酸除作为溶剂外,还有的作用是_______ 。用淀粉碘化钾试纸可检验反应后的液体,如果试纸变_______ 色,说明次氯酸钠过量。
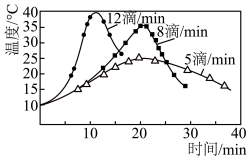
(3)步骤Ⅰ中,次氯酸钠溶液要在冰水浴冷却下逐滴加入,勿使氧化反应进行得过于猛烈而升温过高,否则产物环己酮将进一步被氧化而发生碳链断裂。在次氯酸钠的不同滴加速度下,在冰水浴存在的情况下,溶液温度随滴加时间变化曲线如图,为了控制好反应温度,应选择的滴速为_______ 滴/ 。
。_______ 。
(5)在步骤Ⅳ中,加入精制食盐的目的是_______ 。
(6)在步骤Ⅴ中,加入无水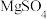 的作用为
的作用为_______ 。
(7)产品的产率为_______ (精确至0.1%)。
 时在水中的溶解度为
时在水中的溶解度为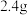 。实验室由环己醇制备环己酮。
。实验室由环己醇制备环己酮。【实验原理】
 +NaClO
+NaClO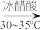
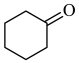 +NaCl+H2O
+NaCl+H2O 
【装置示意图】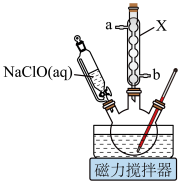
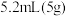 环已醇和
环已醇和 冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。
冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。Ⅱ.在室温下继续搅拌
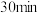 ,然后加入饱和亚硫酸氢钠溶液。
,然后加入饱和亚硫酸氢钠溶液。Ⅲ.在反应混合物中加入
 水、
水、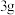 氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。
氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。Ⅳ.在搅拌情况下向馏出液中加入无水碳酸钠至中性,然后再加入精制食盐使之饱和,将此液体倒入分液漏斗,分出有机层。
Ⅴ.向有机层中加入无水
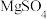 ,静置,过滤,对滤液进行蒸馏,得到产品
,静置,过滤,对滤液进行蒸馏,得到产品 。
。回答下列问题。
(1)仪器X的名称为
(2)步骤Ⅰ中,加入冰醋酸除作为溶剂外,还有的作用是
(3)步骤Ⅰ中,次氯酸钠溶液要在冰水浴冷却下逐滴加入,勿使氧化反应进行得过于猛烈而升温过高,否则产物环己酮将进一步被氧化而发生碳链断裂。在次氯酸钠的不同滴加速度下,在冰水浴存在的情况下,溶液温度随滴加时间变化曲线如图,为了控制好反应温度,应选择的滴速为
 。
。
(5)在步骤Ⅳ中,加入精制食盐的目的是
(6)在步骤Ⅴ中,加入无水
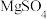 的作用为
的作用为(7)产品的产率为
您最近一年使用:0次
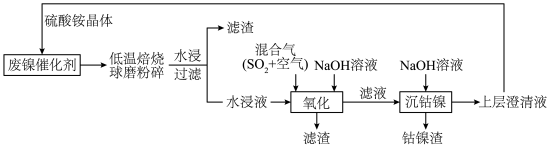
6 . 一种废镍催化剂回收镍、钴元素的工艺流程图如下,流程图中水浸液中含有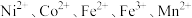 。
。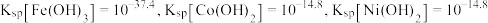 。
。
回答下列问题。
(1)球磨粉碎的作用是_______ 。
(2)“氧化”中,混合气在金属离子的催化作用下,生成具有强氧化性的过一硫酸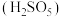 ,其反应的化学方程式为
,其反应的化学方程式为_______ 。
(3)“氧化”中, 被过一硫酸氧化为
被过一硫酸氧化为 沉淀,过一硫酸被还原为硫酸根离子,写出该反应的离子方程式:
沉淀,过一硫酸被还原为硫酸根离子,写出该反应的离子方程式:_______ (已知 的电离第一步完全,第二步微弱);用
的电离第一步完全,第二步微弱);用 溶液调节
溶液调节 ,还有
,还有_______ (写离子符号)也会形成沉淀而除去。
(4)“氧化”中保持空气通入速率不变,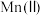 的氧化率与
的氧化率与 的体积分数的关系如图所示。
的体积分数的关系如图所示。 的体积分数为9.0%时,
的体积分数为9.0%时,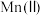 的氧化率最大;当
的氧化率最大;当 的体积分数大于9.0%时,继续增大
的体积分数大于9.0%时,继续增大 的体积分数,
的体积分数,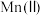 的氧化率减小的原因可能是
的氧化率减小的原因可能是_______ 。 沉淀完全,需控制溶液的
沉淀完全,需控制溶液的 不低于
不低于_______ (说明:当溶液中的 浓度均小于
浓度均小于 时,认为已沉淀完全)。
时,认为已沉淀完全)。
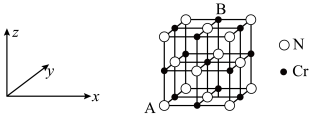
(6)铬、钴、镍都属于副族金属元素,其中铬与氮气在一定条件下可以合成氨化铬,且氮化铬的晶体结构及类型与氯化钠的相似,其晶胞结构如图所示。A点的分数坐标为 ,则B点的分数坐标为
,则B点的分数坐标为_______ 。已知氮化铬的晶胞参数为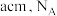 为阿伏加德罗常数,则该晶胞的密度为
为阿伏加德罗常数,则该晶胞的密度为_______  。
。
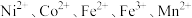 。
。
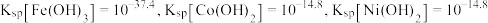 。
。回答下列问题。
(1)球磨粉碎的作用是
(2)“氧化”中,混合气在金属离子的催化作用下,生成具有强氧化性的过一硫酸
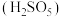 ,其反应的化学方程式为
,其反应的化学方程式为(3)“氧化”中,
 被过一硫酸氧化为
被过一硫酸氧化为 沉淀,过一硫酸被还原为硫酸根离子,写出该反应的离子方程式:
沉淀,过一硫酸被还原为硫酸根离子,写出该反应的离子方程式: 的电离第一步完全,第二步微弱);用
的电离第一步完全,第二步微弱);用 溶液调节
溶液调节 ,还有
,还有(4)“氧化”中保持空气通入速率不变,
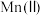 的氧化率与
的氧化率与 的体积分数的关系如图所示。
的体积分数的关系如图所示。 的体积分数为9.0%时,
的体积分数为9.0%时,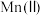 的氧化率最大;当
的氧化率最大;当 的体积分数大于9.0%时,继续增大
的体积分数大于9.0%时,继续增大 的体积分数,
的体积分数,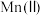 的氧化率减小的原因可能是
的氧化率减小的原因可能是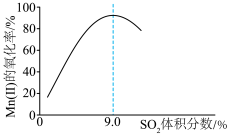
 沉淀完全,需控制溶液的
沉淀完全,需控制溶液的 不低于
不低于 浓度均小于
浓度均小于 时,认为已沉淀完全)。
时,认为已沉淀完全)。(6)铬、钴、镍都属于副族金属元素,其中铬与氮气在一定条件下可以合成氨化铬,且氮化铬的晶体结构及类型与氯化钠的相似,其晶胞结构如图所示。A点的分数坐标为
 ,则B点的分数坐标为
,则B点的分数坐标为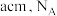 为阿伏加德罗常数,则该晶胞的密度为
为阿伏加德罗常数,则该晶胞的密度为 。
。
您最近一年使用:0次
7 .  是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某
是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某 催化剂(用
催化剂(用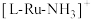 表示)能高效电催化氧化
表示)能高效电催化氧化 合成
合成 ,其反应机理如图所示。下列说法正确的是
,其反应机理如图所示。下列说法正确的是
 是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某
是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某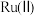 催化剂(用
催化剂(用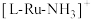 表示)能高效电催化氧化
表示)能高效电催化氧化 合成
合成 ,其反应机理如图所示。下列说法正确的是
,其反应机理如图所示。下列说法正确的是
A.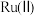 催化剂降低该反应的活化能,大大缩短达到化学平衡所需的时间 催化剂降低该反应的活化能,大大缩短达到化学平衡所需的时间 |
B.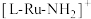 中氮原子上有孤电子对 中氮原子上有孤电子对 |
C.该过程的总反应式为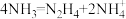 |
D.由于 中存在非极性共价键,所以 中存在非极性共价键,所以 易溶于水 易溶于水 |
您最近一年使用:0次
8 . 利用含钴废料(主要成分为 、
、 、
、 、
、 以及
以及 、
、 等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示:
等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示: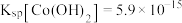 ;
;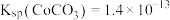 。
。
请回答下列问题:
(1)“碱浸”时所得滤液中溶质的主要成分为 和
和___________ 。“酸浸”时 发生反应的总离子方程式为
发生反应的总离子方程式为___________ 。
(2)“萃取”时 萃取的反应原理如下:
萃取的反应原理如下: (有机层)
(有机层)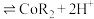 ,若萃取剂的量一定时,
,若萃取剂的量一定时,___________ (填“一次萃取”或“少量多次萃取”)的萃取效率更高。若“酸浸”后浸出液的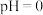 ,
, ,萃取完成后水相中
,萃取完成后水相中 为
为 ,则钴的萃取率为
,则钴的萃取率为___________ (结果保留一位小数,溶液体积变化忽略不计)。
(3)“沉锰”时, 转化为
转化为 ,则“沉锰”时发生反应的离子方程式为
,则“沉锰”时发生反应的离子方程式为___________ 。
(4)可以通过电解 溶液获得单质
溶液获得单质 和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是
和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是___________ 。若Ⅱ室溶液中溶质的质量增加了 ,则理论上获得的单质
,则理论上获得的单质 的质量为
的质量为___________ 。
 、
、 、
、 、
、 以及
以及 、
、 等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示:
等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示: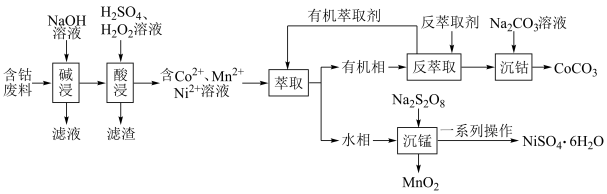
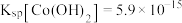 ;
;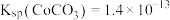 。
。请回答下列问题:
(1)“碱浸”时所得滤液中溶质的主要成分为
 和
和 发生反应的总离子方程式为
发生反应的总离子方程式为(2)“萃取”时
 萃取的反应原理如下:
萃取的反应原理如下: (有机层)
(有机层)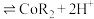 ,若萃取剂的量一定时,
,若萃取剂的量一定时,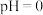 ,
, ,萃取完成后水相中
,萃取完成后水相中 为
为 ,则钴的萃取率为
,则钴的萃取率为(3)“沉锰”时,
 转化为
转化为 ,则“沉锰”时发生反应的离子方程式为
,则“沉锰”时发生反应的离子方程式为(4)可以通过电解
 溶液获得单质
溶液获得单质 和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是
和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是 ,则理论上获得的单质
,则理论上获得的单质 的质量为
的质量为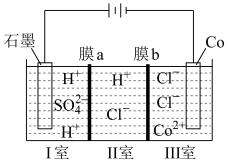
您最近一年使用:0次
解题方法
9 . 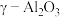 具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为
具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为 、
、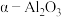 ,含少量
,含少量 、
、 、
、 和其他不溶于酸、碱的杂质)为原料制备纳米
和其他不溶于酸、碱的杂质)为原料制备纳米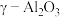 的流程如下。已知:
的流程如下。已知: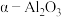 熔点高,硬度大,不溶于酸、碱;常温下,
熔点高,硬度大,不溶于酸、碱;常温下,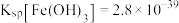 、
、 、
、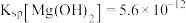 ;溶液中离子的浓度小于
;溶液中离子的浓度小于 时可视为该离子沉淀完全。请回答下列问题:
时可视为该离子沉淀完全。请回答下列问题:___________ ;加入 的目的是
的目的是___________ 。
(2)滤渣1的主要成分为___________ 、___________ 及不溶于酸、碱的杂质;加入 调节溶液的
调节溶液的 为13后,溶液中的
为13后,溶液中的
___________ 。
(3)若通入过量 ,发生的主要反应的离子方程式为
,发生的主要反应的离子方程式为___________ 。
(4)写出洗去固体A表面杂质的简要操作:___________ 。
(5)“煅烧”固体A反应的化学方程式为___________ 。
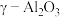 具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为
具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为 、
、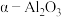 ,含少量
,含少量 、
、 、
、 和其他不溶于酸、碱的杂质)为原料制备纳米
和其他不溶于酸、碱的杂质)为原料制备纳米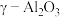 的流程如下。已知:
的流程如下。已知: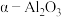 熔点高,硬度大,不溶于酸、碱;常温下,
熔点高,硬度大,不溶于酸、碱;常温下,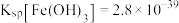 、
、 、
、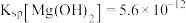 ;溶液中离子的浓度小于
;溶液中离子的浓度小于 时可视为该离子沉淀完全。请回答下列问题:
时可视为该离子沉淀完全。请回答下列问题:
 的目的是
的目的是(2)滤渣1的主要成分为
 调节溶液的
调节溶液的 为13后,溶液中的
为13后,溶液中的
(3)若通入过量
 ,发生的主要反应的离子方程式为
,发生的主要反应的离子方程式为(4)写出洗去固体A表面杂质的简要操作:
(5)“煅烧”固体A反应的化学方程式为
您最近一年使用:0次
2024-04-25更新
|
194次组卷
|
3卷引用:2024届陕西省榆林市高三上学期第一次模拟检测理综试题-高中化学
解题方法
10 . 为回收利用废钒催化剂(含有V2O5、VOSO4、SiO2、Fe3O4以及钾和铝的硅酸盐),科研人员研制了一种回收V2O5的新工艺,主要流程如下图。
ii.VOSO4可溶、(VO2)2SO4易溶、V2O5和NH4VO3难溶; +2OH-=
+2OH-= +H2O
+H2O
(1)“酸浸氧化”时,VO2+转化成 反应的离子方程式为
反应的离子方程式为______ ,同时V2O5转化为 。滤渣①主要成分是
。滤渣①主要成分是______ 。
(2)“中和沉淀”中,钒水解并沉淀为V2O5·2H2O,随滤液②可除去金属离子K+以及部分的金属离子有______ 。
(3)“沉淀转溶”中,V2O5·2H2O转化为KVO3溶解,写出V2O5·2H2O与KOH反应的化学方程式______ 。
(4)“调pH”中滤渣④的主要成分是______ 。
(5)全钒液流储能电池可实现化学能和电能的相互转化,其原理如图所示。______ 。
②放电过程中,右槽溶液颜色变化的情况是______ 。
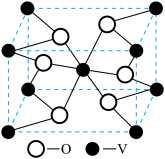
(6)钒的某种氧化物的立方晶胞结构如图所示,钒原子的配位数为______ 。若该晶胞的密度为ρg/cm3,且用NA表示阿伏加德罗常数,则该晶胞的边长为______ nm。
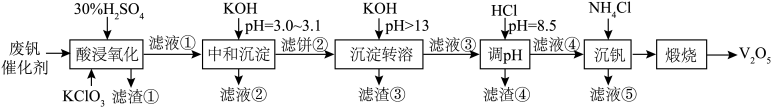
| 金属离子 | Fe3+ | Fe2+ | Al3+ |
| 开始沉淀pH | 1.9 | 7.0 | 3.0 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 |
 +2OH-=
+2OH-= +H2O
+H2O(1)“酸浸氧化”时,VO2+转化成
 反应的离子方程式为
反应的离子方程式为 。滤渣①主要成分是
。滤渣①主要成分是(2)“中和沉淀”中,钒水解并沉淀为V2O5·2H2O,随滤液②可除去金属离子K+以及部分的金属离子有
(3)“沉淀转溶”中,V2O5·2H2O转化为KVO3溶解,写出V2O5·2H2O与KOH反应的化学方程式
(4)“调pH”中滤渣④的主要成分是
(5)全钒液流储能电池可实现化学能和电能的相互转化,其原理如图所示。
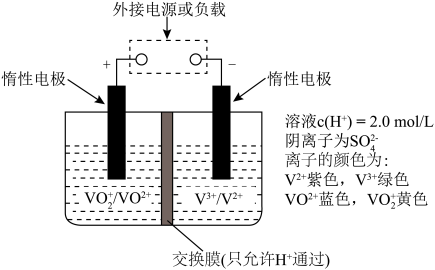
②放电过程中,右槽溶液颜色变化的情况是
(6)钒的某种氧化物的立方晶胞结构如图所示,钒原子的配位数为
您最近一年使用:0次



