解题方法
1 . 根据所学知识,回答下列问题:
(1)K2FeO4是常见的水处理剂,净水原理如图所示。请回答下列问题:___________ 。
②过程a中K2FeO4体现___________ (填“氧化”或“还原”)性,反应过程中转移5.418×1022个电子,需要___________ mol K2FeO4。
(2)碱性条件下用Fe(OH)3和KClO反应制备K2FeO4。配平其反应的化学方程式:___________ 。
___________Fe(OH)3+___________KOH+___________KClO=___________K2FeO4+___________KCl+___________H2O
(3)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中的还原剂是___________ ,生产1mol的高铁酸钠,需要转移电子的物质的量是___________ mol。
(4)将铝箔放入NaOH稀溶液中,开始时无气体生成,写出反应的离子方程式:___________ ;反应片刻后,可观察到有气体产生。
(1)K2FeO4是常见的水处理剂,净水原理如图所示。请回答下列问题:
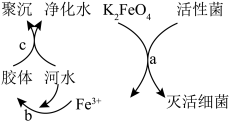
②过程a中K2FeO4体现
(2)碱性条件下用Fe(OH)3和KClO反应制备K2FeO4。配平其反应的化学方程式:
___________Fe(OH)3+___________KOH+___________KClO=___________K2FeO4+___________KCl+___________H2O
(3)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中的还原剂是
(4)将铝箔放入NaOH稀溶液中,开始时无气体生成,写出反应的离子方程式:
您最近一年使用:0次
名校
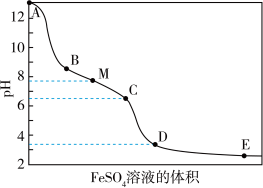
2 .  溶液具有漂白能力,已知
溶液具有漂白能力,已知 时,
时,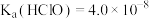 ,向含有
,向含有 的
的 溶液中逐滴滴入
溶液中逐滴滴入 溶液,滴加过程中溶液的
溶液,滴加过程中溶液的 随
随 溶液的体积的变化曲线及实验现象见下表。下列叙述不正确的是
溶液的体积的变化曲线及实验现象见下表。下列叙述不正确的是
 溶液具有漂白能力,已知
溶液具有漂白能力,已知 时,
时,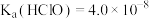 ,向含有
,向含有 的
的 溶液中逐滴滴入
溶液中逐滴滴入 溶液,滴加过程中溶液的
溶液,滴加过程中溶液的 随
随 溶液的体积的变化曲线及实验现象见下表。下列叙述不正确的是
溶液的体积的变化曲线及实验现象见下表。下列叙述不正确的是| 变化曲线 | 实验现象 |
| ⅰ. 产生红褐色沉淀 产生红褐色沉淀ⅱ.  红褐色沉淀的量增多 红褐色沉淀的量增多ⅲ.  红褐色沉淀的量增多 红褐色沉淀的量增多ⅳ.  点附近产生有刺激性气味的气体 点附近产生有刺激性气味的气体ⅴ.  红褐色沉淀的量略有增多 红褐色沉淀的量略有增多 |
A.NaClO的电子式是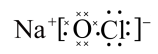 |
B.NaClO溶液中离子浓度大小顺序是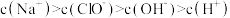 |
C.25℃,pH=7.0的NaClO和HClO的混合溶液中, |
D.C点附近生成红褐色沉淀的主要反应的离子方程式为 |
您最近一年使用:0次
解题方法
3 . 废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备 和
和 的部分实验步骤如下:
的部分实验步骤如下: ”步骤中,为加快溶解速率,可采取的措施是
”步骤中,为加快溶解速率,可采取的措施是___________ 。(任写一种方法)。
(2)从“滤液 ”中提取
”中提取 的实验步骤依次为
的实验步骤依次为___________ 、过滤、冰水洗涤、低温干燥,其中冰水洗涤晶体的目的是___________ 。
(3)在“溶解 ”步骤中,发生反应的化学方程式为
”步骤中,发生反应的化学方程式为___________ 。
(4)为测定产品中 的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
 溶液至刚好完全反应,消耗
溶液至刚好完全反应,消耗 溶液25.00mL。
溶液25.00mL。
已知: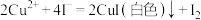 ,
, 。请依据实验数据计算样品中
。请依据实验数据计算样品中 的质量分数
的质量分数___________ (写出计算过程,结果保留2位小数)。
 和
和 的部分实验步骤如下:
的部分实验步骤如下: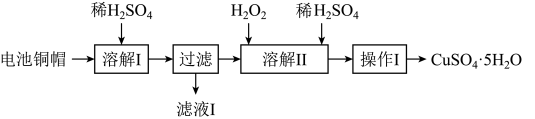
 ”步骤中,为加快溶解速率,可采取的措施是
”步骤中,为加快溶解速率,可采取的措施是(2)从“滤液
 ”中提取
”中提取 的实验步骤依次为
的实验步骤依次为(3)在“溶解
 ”步骤中,发生反应的化学方程式为
”步骤中,发生反应的化学方程式为(4)为测定产品中
 的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
 溶液至刚好完全反应,消耗
溶液至刚好完全反应,消耗 溶液25.00mL。
溶液25.00mL。已知:
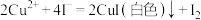 ,
, 。请依据实验数据计算样品中
。请依据实验数据计算样品中 的质量分数
的质量分数
您最近一年使用:0次
名校
4 . “纳米零价铁-H2O2”体系可将烟气中难溶的NO氧化为可溶的 。
。
(1)制备纳米零价铁:将FeSO4溶液与NaOH、Na2S2O4的混合溶液混合后可生成纳米零价铁和Na2SO3等,Na2S2O4中S元素的化合价为___________ ,该反应的还原产物是___________ (写化学式)。
(2)NO的氧化:在一定温度下,将H2O2溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化为HNO3,总反应的离子方程式为3H2O2 + NO +___________ + Fe = Fe3+ +  + 4H2O
+ 4H2O
①补充完整以上的离子方程式,若反应生成36g水,则反应的氧化剂的质量是___________ 。
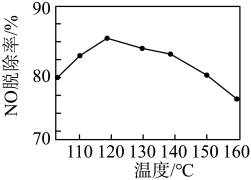
②NO脱除率随温度的变化如图所示。当温度高于120℃时,NO脱除率随温度升高呈现下降趋势,其主要原因是___________ 。___________ (填化学式),写出该物质的一种用途___________ 。
 。
。(1)制备纳米零价铁:将FeSO4溶液与NaOH、Na2S2O4的混合溶液混合后可生成纳米零价铁和Na2SO3等,Na2S2O4中S元素的化合价为
(2)NO的氧化:在一定温度下,将H2O2溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化为HNO3,总反应的离子方程式为3H2O2 + NO +
 + 4H2O
+ 4H2O①补充完整以上的离子方程式,若反应生成36g水,则反应的氧化剂的质量是
②NO脱除率随温度的变化如图所示。当温度高于120℃时,NO脱除率随温度升高呈现下降趋势,其主要原因是
您最近一年使用:0次
名校
5 . I.神舟十七号载人航天飞船于2023年10月26日成功发射,飞船搭载的是中国研制的长征二号F遥十七运载火箭,采用四氧化二氮(N2O4)和偏二甲肼(C2H8N2)作为推进剂,二者反应生成二氧化碳、水蒸气和氮气。
(1)偏二甲肼的摩尔质量为___________ 。
(2)四氧化二氮能与水反应生成亚硝酸和___________ (写化学式)。
(3)四氧化二氮和偏二甲肼反应的化学方程式为:2N2O4+C2H8N2 2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是
2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是___________ 。
(4)已知N2、CO2混合气体的质量共10.0g,在标准状况下的体积为6.72L,则混合气体中CO2的质量为___________ 。
II.二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。已知:工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应。二氧化氯能与许多化学物质发生爆炸性反应,遇水则生成次氯酸、氯气和氧气。
(5)将二氧化氯通入紫色石蕊试液中,溶液褪色的理由是___________ 。
(6)设NA为阿伏加德罗常数的值,现有10g质量分数为64%的甲醇(CH3OH)水溶液,则该溶液所含氢原子数目为___________ 。
(7)假设CO2和ClO2在标准状况下均为气体,则反应CH3OH+NaClO3+H2SO4 → CO2↑+ClO2↑+Na2SO4 +H2O(未配平)中转移的电子数目为0.6NA时,该反应产生标准状况下气体的体积为___________ 。
(1)偏二甲肼的摩尔质量为
(2)四氧化二氮能与水反应生成亚硝酸和
(3)四氧化二氮和偏二甲肼反应的化学方程式为:2N2O4+C2H8N2
 2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是
2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是(4)已知N2、CO2混合气体的质量共10.0g,在标准状况下的体积为6.72L,则混合气体中CO2的质量为
II.二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。已知:工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应。二氧化氯能与许多化学物质发生爆炸性反应,遇水则生成次氯酸、氯气和氧气。
(5)将二氧化氯通入紫色石蕊试液中,溶液褪色的理由是
(6)设NA为阿伏加德罗常数的值,现有10g质量分数为64%的甲醇(CH3OH)水溶液,则该溶液所含氢原子数目为
(7)假设CO2和ClO2在标准状况下均为气体,则反应CH3OH+NaClO3+H2SO4 → CO2↑+ClO2↑+Na2SO4 +H2O(未配平)中转移的电子数目为0.6NA时,该反应产生标准状况下气体的体积为
您最近一年使用:0次
名校
解题方法
6 . 下列指定反应的离子方程式正确的是
A.磁性氧化铁溶于足量稀硝酸: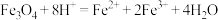 |
B.NaClO溶液与HI溶液反应: |
C. 溶液和过量 溶液和过量 溶液混合: 溶液混合: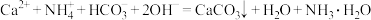 |
D.明矾溶液中滴入 溶液使 溶液使 恰好完全沉淀: 恰好完全沉淀: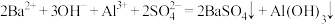 |
您最近一年使用:0次
名校
7 . 钛白粉(纳米级)广泛应用于功能陶瓷、催化剂、化妆品和光敏材料等白色无机颜料。具有优良的遮盖力和着色牢度,适用于不透明的白色制品。其制备原料钛铁矿( )中往往含有
)中往往含有 、MgO、CaO、
、MgO、CaO、 、
、 等杂质。一种硫酸法制取白色颜料钛白粉(
等杂质。一种硫酸法制取白色颜料钛白粉( )的生产工艺如图:
)的生产工艺如图: 形式存在;
形式存在;
②强电解质 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子;
和一种阳离子;
③ 不溶于水和稀酸。
不溶于水和稀酸。
(1)要提高酸浸速率,可采取的措施是________ (写出一条即可)。
(2)滤渣①中除铁粉外,还可能含有的成分是________ 。
(3)酸浸过程中, 发生反应的离子方程式为
发生反应的离子方程式为________ 。
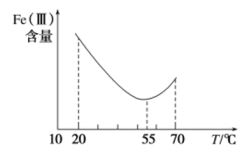
(4)加入铁粉的目的是还原体系中的 。为探究最佳反应条件,某实验室做了如下尝试。
。为探究最佳反应条件,某实验室做了如下尝试。
①在其他条件不变的情况下,体系中Fe(III)[指 和
和 等含正三价铁元素的微粒]含量随pH变化如图,试分析,在pH介于4~6之间时,Fe(III)主要以
等含正三价铁元素的微粒]含量随pH变化如图,试分析,在pH介于4~6之间时,Fe(III)主要以________ (填微粒化学式,已知pH>3时近似认为 沉淀完全)形式存在。
沉淀完全)形式存在。________ 。________ 。在实验室中,滤渣③一般在________ (填仪器名称)中灼烧。
 )中往往含有
)中往往含有 、MgO、CaO、
、MgO、CaO、 、
、 等杂质。一种硫酸法制取白色颜料钛白粉(
等杂质。一种硫酸法制取白色颜料钛白粉( )的生产工艺如图:
)的生产工艺如图: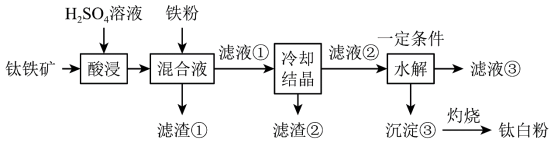
 形式存在;
形式存在;②强电解质
 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子;
和一种阳离子;③
 不溶于水和稀酸。
不溶于水和稀酸。(1)要提高酸浸速率,可采取的措施是
(2)滤渣①中除铁粉外,还可能含有的成分是
(3)酸浸过程中,
 发生反应的离子方程式为
发生反应的离子方程式为(4)加入铁粉的目的是还原体系中的
 。为探究最佳反应条件,某实验室做了如下尝试。
。为探究最佳反应条件,某实验室做了如下尝试。①在其他条件不变的情况下,体系中Fe(III)[指
 和
和 等含正三价铁元素的微粒]含量随pH变化如图,试分析,在pH介于4~6之间时,Fe(III)主要以
等含正三价铁元素的微粒]含量随pH变化如图,试分析,在pH介于4~6之间时,Fe(III)主要以 沉淀完全)形式存在。
沉淀完全)形式存在。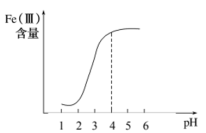
您最近一年使用:0次
8 . 氨是合成硝酸、铵盐和氮肥的基本原料,在科学技术和生产中有重要的应用。请回答下列问题:
(1)以N2和H2为原料,合成氨气的反应为N2(g)+3H2(g) 2NH3(g) ΔH<0,下列措施可以提高v(正)的是
2NH3(g) ΔH<0,下列措施可以提高v(正)的是___________ (填序号)。
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.降低温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充入一个体积可变的恒压密闭容器中,p = 5MPa,原气体体积为2L。5分钟后反应达到平衡时,n(N2)=1.0mol,n(H2)=3.0mol,n(NH3)=1.0mol,则反应速率v (N2)=___________ mol/min (用单位时间物质的量变量表示化学反应速率),平衡常数Kp =___________ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是
2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是___________ (填序号)。
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时的值最大
(4)氨和联氨(N2H4)是氨的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式:___________ 。标况下,每消耗1.12L氨气,转移___________ mol电子。
(1)以N2和H2为原料,合成氨气的反应为N2(g)+3H2(g)
 2NH3(g) ΔH<0,下列措施可以提高v(正)的是
2NH3(g) ΔH<0,下列措施可以提高v(正)的是a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.降低温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充入一个体积可变的恒压密闭容器中,p = 5MPa,原气体体积为2L。5分钟后反应达到平衡时,n(N2)=1.0mol,n(H2)=3.0mol,n(NH3)=1.0mol,则反应速率v (N2)=
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g)
 2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是
2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是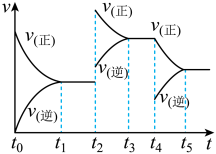
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时的值最大
(4)氨和联氨(N2H4)是氨的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式:
您最近一年使用:0次
解题方法
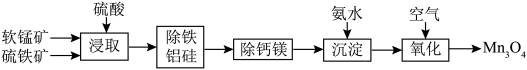
9 . 以软锰矿(主要成分为 ,还含少量Fe、Si、Al、Ca、Mg等的氧化物)和硫铁矿(主要成分
,还含少量Fe、Si、Al、Ca、Mg等的氧化物)和硫铁矿(主要成分 )为原料,两矿联合浸取可制备大颗粒的电池用
)为原料,两矿联合浸取可制备大颗粒的电池用 。
。 和
和 颗粒构成两个原电池反应,其原理如图1所示(部分产物未标出)。
颗粒构成两个原电池反应,其原理如图1所示(部分产物未标出)。 的电子排布式为:
的电子排布式为:___________ 。
②若 原电池中生成单质S,其电池总反应的离子方程式为
原电池中生成单质S,其电池总反应的离子方程式为___________ 。
③随硫铁矿的增加,锰的浸出率降低,可能的原因是___________ 。
(2)除钙镁:向已除去Fe、Al、Si元素的 溶液中(pH约为5)加入
溶液中(pH约为5)加入 溶液,将
溶液,将 、
、 转化为氟化物沉淀。则
转化为氟化物沉淀。则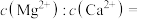
___________ 。
[已知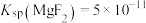 ,
,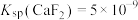 ]
]
(3)氧化:将“沉淀”步骤所得含少量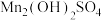 的
的 固体滤出,洗净,加水打成浆,浆液边加热边持续通空气,制得
固体滤出,洗净,加水打成浆,浆液边加热边持续通空气,制得 。
。
①写出由 反应得到
反应得到 的化学方程式
的化学方程式___________ 。
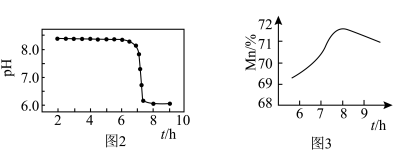
②沉淀加热通空气过程中溶液pH随时间变化如图2所示,其中pH先基本不变后迅速下降的原因是___________ 。___________ 。
 ,还含少量Fe、Si、Al、Ca、Mg等的氧化物)和硫铁矿(主要成分
,还含少量Fe、Si、Al、Ca、Mg等的氧化物)和硫铁矿(主要成分 )为原料,两矿联合浸取可制备大颗粒的电池用
)为原料,两矿联合浸取可制备大颗粒的电池用 。
。
 和
和 颗粒构成两个原电池反应,其原理如图1所示(部分产物未标出)。
颗粒构成两个原电池反应,其原理如图1所示(部分产物未标出)。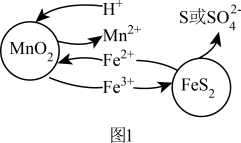
 的电子排布式为:
的电子排布式为:②若
 原电池中生成单质S,其电池总反应的离子方程式为
原电池中生成单质S,其电池总反应的离子方程式为③随硫铁矿的增加,锰的浸出率降低,可能的原因是
(2)除钙镁:向已除去Fe、Al、Si元素的
 溶液中(pH约为5)加入
溶液中(pH约为5)加入 溶液,将
溶液,将 、
、 转化为氟化物沉淀。则
转化为氟化物沉淀。则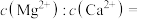
[已知
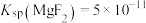 ,
,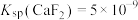 ]
](3)氧化:将“沉淀”步骤所得含少量
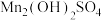 的
的 固体滤出,洗净,加水打成浆,浆液边加热边持续通空气,制得
固体滤出,洗净,加水打成浆,浆液边加热边持续通空气,制得 。
。①写出由
 反应得到
反应得到 的化学方程式
的化学方程式②沉淀加热通空气过程中溶液pH随时间变化如图2所示,其中pH先基本不变后迅速下降的原因是
您最近一年使用:0次
10 . 氯的化合物在生活中有着广泛的用途。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生Cl-和少量的 ,可利用酸性FeSO4溶液将
,可利用酸性FeSO4溶液将 转化为Cl-除去。
转化为Cl-除去。
①关于二氧化氯的说法不正确的是_______ 。
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去 的离子方程式为
的离子方程式为_______ 。
(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为:ClO2+H2O2+NaOH=NaClO2+O2+H2O(未配平)。
①ClO2的氧化性_______ H2O2的氧化性(填“大于”或“小于”)。
②为测定产品中NaClO2的纯度,进行如下实验:准确称取1.000g上述产品,溶于水配成100.00mL溶液,取10.00mL待测液,加入过量KI溶液,酸性条件下发生反应: +4I-+4H+=2H2O+2I2+Cl-,杂质不与I-反应。以淀粉作指示剂,再加入0.2000mol/LNa2S2O3溶液,恰好完全反应时消耗的Na2S2O3溶液的体积为20.00mL。(已知:I2+2
+4I-+4H+=2H2O+2I2+Cl-,杂质不与I-反应。以淀粉作指示剂,再加入0.2000mol/LNa2S2O3溶液,恰好完全反应时消耗的Na2S2O3溶液的体积为20.00mL。(已知:I2+2 =2I-+
=2I-+ )。计算该样品的纯度为
)。计算该样品的纯度为_______ 。(写出计算过程)
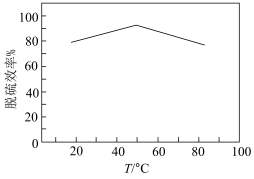
③工业上常用NaClO2溶液对燃煤烟气进行脱硫。已知NaClO2溶液具有强氧化性,酸性条件下NaClO2发生歧化反应生成ClO2,ClO2易溶于水,具有强氧化性,可氧化SO2.在实验室模拟脱硫过程:先加稀硫酸调节NaClO2吸收液的pH为5,再向其中通入含SO2的模拟烟气。测得脱硫反应后,溶液中的阴离子为Cl-,则SO2的氧化产物是_______ 。测得脱硫效率(即SO2的吸收率)随温度变化的曲线如下图所示。_______ 。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生Cl-和少量的
 ,可利用酸性FeSO4溶液将
,可利用酸性FeSO4溶液将 转化为Cl-除去。
转化为Cl-除去。①关于二氧化氯的说法不正确的是
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去
 的离子方程式为
的离子方程式为(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为:ClO2+H2O2+NaOH=NaClO2+O2+H2O(未配平)。
①ClO2的氧化性
②为测定产品中NaClO2的纯度,进行如下实验:准确称取1.000g上述产品,溶于水配成100.00mL溶液,取10.00mL待测液,加入过量KI溶液,酸性条件下发生反应:
 +4I-+4H+=2H2O+2I2+Cl-,杂质不与I-反应。以淀粉作指示剂,再加入0.2000mol/LNa2S2O3溶液,恰好完全反应时消耗的Na2S2O3溶液的体积为20.00mL。(已知:I2+2
+4I-+4H+=2H2O+2I2+Cl-,杂质不与I-反应。以淀粉作指示剂,再加入0.2000mol/LNa2S2O3溶液,恰好完全反应时消耗的Na2S2O3溶液的体积为20.00mL。(已知:I2+2 =2I-+
=2I-+ )。计算该样品的纯度为
)。计算该样品的纯度为③工业上常用NaClO2溶液对燃煤烟气进行脱硫。已知NaClO2溶液具有强氧化性,酸性条件下NaClO2发生歧化反应生成ClO2,ClO2易溶于水,具有强氧化性,可氧化SO2.在实验室模拟脱硫过程:先加稀硫酸调节NaClO2吸收液的pH为5,再向其中通入含SO2的模拟烟气。测得脱硫反应后,溶液中的阴离子为Cl-,则SO2的氧化产物是
您最近一年使用:0次