辽宁省凤城市第二中学2023-2024学年高三上学期第一次考试化学试卷
辽宁
高三
阶段练习
2024-05-23
87次
整体难度:
适中
考查范围:
有机化学基础、物质结构与性质、化学与STSE、认识化学科学、化学反应原理、常见无机物及其应用、化学实验基础
辽宁省凤城市第二中学2023-2024学年高三上学期第一次考试化学试卷
辽宁
高三
阶段练习
2024-05-23
87次
整体难度:
适中
考查范围:
有机化学基础、物质结构与性质、化学与STSE、认识化学科学、化学反应原理、常见无机物及其应用、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
解题方法
1. 化学与科技、社会、生活密不可分,针对下列热点事件,评价正确的是
| A.美国俄亥俄州火车脱轨,大量氯乙烯泄漏——氯乙烯无毒,是合成PVC的单体 |
B.日本排放福岛核废水中含有氚(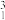 H)等放射性同位素 H)等放射性同位素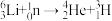 不属于化学变化 不属于化学变化 |
| C.最新国标禁止添加氢化油脂——汉堡、薯条、代可可脂巧克力不含反式脂肪 |
| D.商务部修订《中国禁止出口限制出口技术目录》——稀土金属共15种,属于锕系元素 |
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
2. 通常超市里的商品在摆放到货架前会先进行分类,因此我们在超市能迅速找到所需商品。下列关于物质的分类组合正确的是
| 选项 | 物质 | 类别 |
| A | 钠、液氯、铁、冰水混合物 | 纯净物 |
| B | 碘伏、生石灰、青铜、空气 | 混合物 |
| C |  、 、 、稀盐酸、NaCl溶液 、稀盐酸、NaCl溶液 | 电解质 |
| D | 纯碱、NaOH、 、KOH 、KOH | 碱 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-06-08更新
|
249次组卷
|
2卷引用:广东省清远市2022-2023学年高一上学期期末考试化学试题
3. 提纯粗硅时可通过反应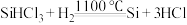 获取晶体硅。下列说法正确的是
获取晶体硅。下列说法正确的是
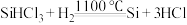 获取晶体硅。下列说法正确的是
获取晶体硅。下列说法正确的是A. 晶体中含有 晶体中含有 非极性键 非极性键 |
B.基态 原子的轨道表示式 原子的轨道表示式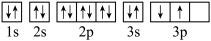 |
C. 的空间填充模型为 的空间填充模型为 |
D. 的电子式为 的电子式为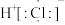 |
您最近一年使用:0次
2023-04-28更新
|
901次组卷
|
4卷引用:广东省潮州市2022-2023学年高三下学期第二次模拟考试化学试题
广东省潮州市2022-2023学年高三下学期第二次模拟考试化学试题(已下线)第10讲 硅及其化合物(已下线)考点13 硅及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)辽宁省凤城市第二中学2023-2024学年高三上学期第一次考试化学试卷
单选题
|
适中(0.65)
名校
4. 已知:① 固体的熔点为300℃;②无水
固体的熔点为300℃;②无水 晶体易升华;③熔融状态的
晶体易升华;③熔融状态的 不能导电,稀溶液具有弱的导电能力且可作为手术刀的消毒液,下列关于
不能导电,稀溶液具有弱的导电能力且可作为手术刀的消毒液,下列关于 、
、 和
和 的说法正确的是
的说法正确的是
 固体的熔点为300℃;②无水
固体的熔点为300℃;②无水 晶体易升华;③熔融状态的
晶体易升华;③熔融状态的 不能导电,稀溶液具有弱的导电能力且可作为手术刀的消毒液,下列关于
不能导电,稀溶液具有弱的导电能力且可作为手术刀的消毒液,下列关于 、
、 和
和 的说法正确的是
的说法正确的是| A.均为弱电解质 |
| B.均为离子化合物 |
C. 的水溶液导电能力很弱,说明其难溶于水 的水溶液导电能力很弱,说明其难溶于水 |
D. 在水中的电离方程式可能是 在水中的电离方程式可能是 |
【知识点】 强电解质和弱电解质的判断
您最近一年使用:0次
2023-06-08更新
|
135次组卷
|
4卷引用:广东省广州市真光中学、深圳二高等两校2023届高三上学期联考化学试题
单选题
|
适中(0.65)
名校
解题方法
5. 下列离子方程式正确的是
A.澄清石灰水与过量 反应: 反应: |
B. 与 与 在酸性溶液中的反应: 在酸性溶液中的反应: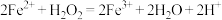 |
C.向沸水中滴加饱和的 溶液制备 溶液制备 胶体: 胶体: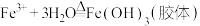 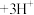 |
D.向碳酸氢铵溶液中加入足量石灰水: |
【知识点】 离子方程式的正误判断解读
您最近一年使用:0次
2023-01-10更新
|
140次组卷
|
4卷引用:【全国百强校】宁夏回族自治区银川一中2018-2019学年高一上学期期中考试化学试题
单选题
|
适中(0.65)
名校
6. NA为阿伏加德罗常数的值,下列说法不正确 的是
| A.常温常压下,22.4LCO2气体中含有的氧原子数小于2NA |
| B.6gSiO2中含有的Si-O键的数目为0.4NA |
| C.78gNa2O2中含有的离子总数为3NA |
| D.50mL12mol·L−1盐酸与足量MnO2共热,转移的电子数为0.3NA |
您最近一年使用:0次
2022-12-15更新
|
365次组卷
|
5卷引用: 浙江省丽水、湖州、衢州 2022 年 11 月三地市高三教学质量检测(一模)化学试题
浙江省丽水、湖州、衢州 2022 年 11 月三地市高三教学质量检测(一模)化学试题(已下线)专题03 突破阿伏加德罗常数正误判断(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)浙江省湖州市2023届高三上学期11月教学质量检测 化学试题宁夏石嘴山市第三中学2023-2024学年高三上学期第二次月考 化学试题辽宁省凤城市第二中学2023-2024学年高三上学期第一次考试化学试卷
单选题
|
适中(0.65)
名校
7. 如图所示是配制一定物质的量浓度溶液的过程。下列说法中不正确的是
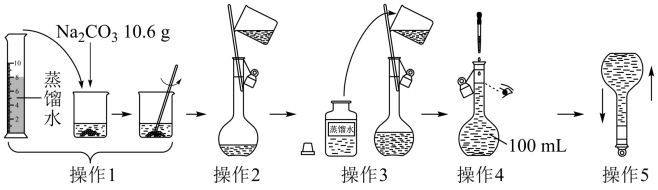
| A.所配制的Na2CO3溶液中Na+的物质的量浓度为2.0mol·L-1 |
| B.操作2中玻璃棒的下端应该抵在容量瓶的刻度线下方 |
| C.操作4如果仰视,所配得溶液浓度偏高 |
| D.操作5中,定容摇匀后发现液面低于刻度线,不再需要加水 |
您最近一年使用:0次
2022-10-10更新
|
442次组卷
|
8卷引用:山东省泰安市新泰第一中学东校2022-2023学年高一上学期第一次质量检测化学试题
单选题
|
适中(0.65)
名校
8. 某化学兴趣小组模拟侯氏制碱法进行实验,流程如下图。下列说法正确的是
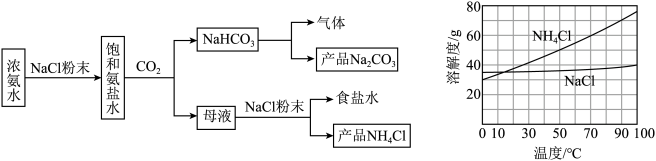
A.该流程中可循环的物质只有 |
B.生成 的离子方程式为: 的离子方程式为: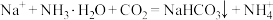 |
C.获得纯净 晶体的操作为蒸发结晶、过滤、洗涤、干燥 晶体的操作为蒸发结晶、过滤、洗涤、干燥 |
D.用澄清石灰水可以鉴别 和 和 |
【知识点】 离子方程式的正误判断解读 碳酸氢钠 物质分离、提纯综合应用解读
您最近一年使用:0次
2023-06-08更新
|
346次组卷
|
2卷引用:广东省广州市真光中学、深圳二高等两校2023届高三上学期联考化学试题
单选题
|
适中(0.65)
名校
解题方法
9. 反应①②分别是从海藻灰和某种矿石中提取碘的主要反应:①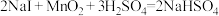
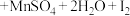 ;②
;② 。下列说法正确的是( )
。下列说法正确的是( )
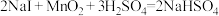
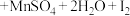 ;②
;② 。下列说法正确的是( )
。下列说法正确的是( )| A.两个反应中硫元素均被氧化 |
| B.碘元素在反应①中被还原,在反应②中被氧化 |
C.氧化性: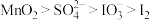 |
D.反应①②中生成等量的 时,转移电子数之比为1:5 时,转移电子数之比为1:5 |
【知识点】 氧化还原反应的应用 氧化还原反应有关计算 氧化还原反应的规律解读
您最近一年使用:0次
2020-09-14更新
|
3459次组卷
|
54卷引用:2013届山东省滨州市高三第一次(3月)模拟考试理综化学试卷
(已下线)2013届山东省滨州市高三第一次(3月)模拟考试理综化学试卷(已下线)2013届河南省商丘市高三第二次模拟考试理综化学试卷(已下线)2014高考名师推荐化学氧化还原规律(已下线)2015届山东省潍坊市重点中学高三上学期期中考试化学试卷2014-2015江西省新余市第一中学高一4月月考化学试卷2014-2015学年山东省菏泽市单县五中高一上学期实验班考试化学试卷2016届湖南省衡阳县第四中学高三9月月考试化学试卷山东省淄博市淄川中学2018届高三上学期第一次月考化学试题山东省济南市第一中学2018届高三上学期期中考试化学试题(已下线)二轮复习测试专项 专题05 氧化还原反应(已下线)【艺体生文化课百题突围系列-基础练测】专题2.4 氧化还原反应(已下线)2019年1月6日 《每日一题》 高考二轮复习-每周一测【全国百强校】广西壮族自治区南宁市第三中学2018-2019学年高一上学期期末考试化学试题甘肃省兰州市第一中学2020届高三9月月考化学试题辽宁省阜新市海州高级中学2019-2020学年高一10月月考化学试题四川省成都市成都外国语学校2019-2020学年高一上学期期中考试化学试题四川省内江市威远中学2019-2020学年高一上学期第一次月考化学试题福建省泉州市泉港区第一中学2019-2020学年高一上学期第二次月考化学试题四川省成都三中2019-2020学年高一11月月考化学试题天津市2019-2020学年高一年级下学期第一次月考化学试题辽宁省大连市普兰店区第一中学2019-2020学年高一上学期期末考试化学试题(已下线)第4单元 氧化还原反应(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷山西省忻州市第一中学2019-2020学年高一上学期第二次月考化学试题人教版(2019)高一必修第一册第一章 物质及其变化 高考挑战区鲁科版(2019)高一必修第一册第二章C 高考挑战区 过模拟 2年模拟精编精练(已下线)期末模拟卷(二)-2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)吉林省白城市洮南市第一中学2020-2021学年高一上学期第一次月考化学试题(已下线)【浙江新东方】14四川省南充市西充中学2020-2021学年高一上学期9月月考化学试题湖南省平江县第一中学2020-2021学年高一上学期第一次月考化学试题(已下线)【浙江新东方】双师107天津市耀华中学2020-2021学年高一上学期期末化学试题湖南省平江县第一中学2020-2021学年高一上学期期末考试化学试题黑龙江省哈尔滨市第六中学2020-2021学年高一下学期线下开学考试化学试题浙江省瑞安中学2020-2021学年高一上学期10月月考化学试题黑龙江省鹤岗市第一中学2020-2021学年高二下学期期末考试化学试题河南省洛阳市豫西名校2021-2022学年高一上学期第一次联考化学试题黑龙江省尚志市尚志中学2021-2022学年高一上学期第一次月考化学试题辽宁省辽河油田第一高级中学2020-2021学年高一上学期期末考试化学试题(A部)湖北省襄阳市第一中学2021-2022学年高一上学期10月测试二化学试题江苏省南京市第一中学2022-2023学年高一上学期9月阶段检测卷化学试题江苏省南京市第一中学2022-2023学年高一上学期10月阶段检测化学试题辽宁省北镇市满族高级中学2022-2023学年高三上学期第一次质量检测化学试题湖北省武汉中学2022-2023学年高一上学期期中阶段性考试化学试题江苏省苏州市常熟中学2022-2023学年高一上学期末测试卷一化学试题云南省曲靖市第一中学2022-2023学年高一上学期第一次检测化学试题安徽亳州市利辛县启明中学2022-2023学年高一上学期期末考试化学试题广东省广州市真光中学2022-2023学年高一上学期期中考试化学试题云南省昆明市第八中学2023-2024学年高一上学期9月月考化学试卷题广东省广州市第一一三中学2023-2024学年高一上学期10月月考化学试题(已下线)题型04 氧化还原反应方程式的配平及其计算-学易金卷:备战2023-2024学年高一化学期末真题分类汇编(江苏专用)安徽省桐城中学2023-2024学年高一上学期第二次教学质量检测化学试题四川省宜宾市叙州区第二中学校2023-2024学年高一上学期1月期末化学试题辽宁省凤城市第二中学2023-2024学年高三上学期第一次考试化学试卷
单选题
|
适中(0.65)
名校
10. 常温下,下列各组离子一定能在指定溶液中大量共存的是
A.在中性溶液中:Na+、Ba2+、SO 、Cl- 、Cl- |
B.与Al反应能放出H2的溶液中:Fe2+、K+、NO 、SO 、SO |
C.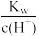 =1×10-13mol·L-1的溶液中:NH =1×10-13mol·L-1的溶液中:NH 、Na+、Cl-、NO 、Na+、Cl-、NO |
D.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO 、CO 、CO |
您最近一年使用:0次
2023-07-25更新
|
302次组卷
|
3卷引用:广东省韶关市2022-2023学年高二下学期期末考试化学试题
单选题
|
适中(0.65)
名校
11. 镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如图所示。下列判断不合理的是

| A.Al、Ga的价层电子数相同 |
| B.向GaCl3溶液中逐滴加入足量氨水,先生成沉淀,后沉淀溶解 |
| C.金属镓可与NaOH溶液反应生成NaGaO2和氢气 |
| D.酸性:Al(OH)3<Ga(OH)3 |
【知识点】 同主族元素性质递变规律理解及应用解读
您最近一年使用:0次
2021-11-03更新
|
231次组卷
|
3卷引用:天津市南开中学2021-2022学年高三上学期第一次月考化学试题
单选题
|
适中(0.65)
12. 室温下,探究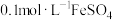 溶液的性质,下列实验方案能达到探究目的的是
溶液的性质,下列实验方案能达到探究目的的是
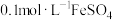 溶液的性质,下列实验方案能达到探究目的的是
溶液的性质,下列实验方案能达到探究目的的是| 选项 | 探究目的 | 实验方案 |
| A | 溶液中是否含有 | 向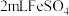 溶液中滴加几滴新制氯水,再滴加KSCN溶液,观察溶液颜色变化 溶液中滴加几滴新制氯水,再滴加KSCN溶液,观察溶液颜色变化 |
| B |  是否有还原性 是否有还原性 | 向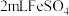 溶液中滴加几滴酸性 溶液中滴加几滴酸性 溶液,观察溶液颜色变化 溶液,观察溶液颜色变化 |
| C |  是否水解 是否水解 | 向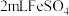 溶液中滴加2~3滴酚酞试液,观察溶液颜色变化 溶液中滴加2~3滴酚酞试液,观察溶液颜色变化 |
| D |  能否催化 能否催化 分解 分解 | 向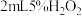 溶液中滴加几滴 溶液中滴加几滴 溶液,观察气泡产生情况 溶液,观察气泡产生情况 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-08-07更新
|
8118次组卷
|
14卷引用:2023年高考江苏卷化学真题
2023年高考江苏卷化学真题(已下线)选择题11-13(已下线)实验05 盐类水解的应用-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)江苏省苏州市2023-2024学年高三上学期11月期中考试化学试题(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)江苏省南师大灌云附中、灌南二中2023-2024学年高三上学期10月阶段性联考化学试题(已下线)题型07 化学实验基础(选择题)-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题05 盐类的水解-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)2024届河南省郑州市宇华实验学校高三一模化学试题江苏省南通市海安市实验中学2023-2024学年高二上学期12月月考化学试题(已下线)FHgkyldyjhx14(已下线)江苏省南京师范大学附属中学2024届高三下学期三模考试化学试题辽宁省凤城市第二中学2023-2024学年高三上学期第一次考试化学试卷四川省达州外国语学校2023-2024学年高二下学期3月月考化学试题
单选题
|
适中(0.65)
名校
13. 由前四周期元素组成的化合物(ZX4)3Q(Y6X5W7)2,可添加到食盐中作抗结剂,阴离子结构如下图所示。其中元素X、Y、Z、W的原子序数依次增大,X与W形成的10电子分子常温下为液态;该化合物中基态Q离子3d能级半充满。下列说法不正确的是

| A.YW2、ZX3、X2W分子中的键角依次减小 |
| B.W与Na形成的化合物可能含离子键和共价键 |
| C.Y、Z、W形成的氢化物沸点高低顺序为:Y<Z<W |
| D.Y、Z、W第一电离能的大小顺序为:Y<W<Z |
【知识点】 电离能变化规律解读 键能、键长、键角及应用解读
您最近一年使用:0次
2023-05-11更新
|
339次组卷
|
4卷引用:安徽省蚌埠市2023届高三下学期第四次质量检查理科综合化学试题
单选题
|
适中(0.65)
解题方法
14. 我国限制稀有金属对外出口,此举对我国战略安全具有重要意义。稀土元素钕(14060Nd)是制造导弹合金材料的重要元素。下列说法中正确的是
| A.14060Nd和14260Nd是同一核素 |
B.一个14060Nd原子的质量约为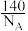 g(NA表示阿伏加 德罗常数的值) g(NA表示阿伏加 德罗常数的值) |
| C.14060Nd原子的中子数与质子数之差为80 |
| D.14 g钕元素含有6 mol电子 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
15. 实验室用如图所示装置研究不同价态硫元素之间的转化,下列说法正确的是
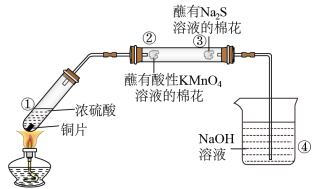
A.将①中生成的气体通入 溶液中会出现白色沉淀 溶液中会出现白色沉淀 |
B.②中棉花紫色褪去,体现 的还原性 的还原性 |
| C.③中有黄色固体生成,氧化剂与还原剂物质的量之比为1∶2 |
| D.向④的小烧杯中加入少量苯可起到防倒吸作用 |
您最近一年使用:0次
2023-02-27更新
|
967次组卷
|
6卷引用:广东省广州市等3地东莞市东华松山湖高级中学有限公司等2校2023届高三下学期一模化学试题
广东省广州市等3地东莞市东华松山湖高级中学有限公司等2校2023届高三下学期一模化学试题(已下线)广东省广州市天河区2023届高三二模化学试题变式题(选择题1-5)陕西省西安市第八十五中学2022~2023学年高一下学期第一次月考化学试题(已下线)选择题11-14湖南省常德市汉寿县第一中学2023-2024学年高三上学期10月月考化学试题辽宁省凤城市第二中学2023-2024学年高三上学期第一次考试化学试卷
二、解答题 添加题型下试题
解答题-实验探究题
|
较易(0.85)
解题方法
16. 150mL某无色溶液中可能含有 中的若干种,现将此溶液分成三等份,进行如下实验:
中的若干种,现将此溶液分成三等份,进行如下实验:
①向第一份中加入足量的 稀盐酸,生成0.448L气体(已换算成标准状况下);
稀盐酸,生成0.448L气体(已换算成标准状况下);
②向第二份中加入足量NaOH溶液并加热,收集到0.04mol气体;
③向第三份中加入足量BaCl2溶液,得到沉淀6.27g,加入足量 稀盐酸充分反应后,剩余沉淀2.33g。
稀盐酸充分反应后,剩余沉淀2.33g。
根据上述实验,回答下列问题:
(1)用12mol·L-1的浓盐酸配制240mL0.5mol·L-1稀盐酸,需要用量筒量取___________ mL浓盐酸,若在量取浓盐酸时俯视刻度线,则会导致配制的稀盐酸的浓度___________ (填“偏高”、“偏低”或“不变”)。
(2)实验②中生成气体的离子方程式为___________ 。
(3)实验③中沉淀部分溶解的化学方程式为___________ ,剩余沉淀的化学式为___________ 。
(4)原溶液中
___________ 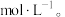
(5)经分析,溶液中一定存在Na+,理由是___________ 。
 中的若干种,现将此溶液分成三等份,进行如下实验:
中的若干种,现将此溶液分成三等份,进行如下实验:①向第一份中加入足量的
 稀盐酸,生成0.448L气体(已换算成标准状况下);
稀盐酸,生成0.448L气体(已换算成标准状况下);②向第二份中加入足量NaOH溶液并加热,收集到0.04mol气体;
③向第三份中加入足量BaCl2溶液,得到沉淀6.27g,加入足量
 稀盐酸充分反应后,剩余沉淀2.33g。
稀盐酸充分反应后,剩余沉淀2.33g。根据上述实验,回答下列问题:
(1)用12mol·L-1的浓盐酸配制240mL0.5mol·L-1稀盐酸,需要用量筒量取
(2)实验②中生成气体的离子方程式为
(3)实验③中沉淀部分溶解的化学方程式为
(4)原溶液中

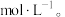
(5)经分析,溶液中一定存在Na+,理由是
您最近一年使用:0次
三、填空题 添加题型下试题
填空题
|
较易(0.85)
解题方法
17. 根据所学知识,回答下列问题:
(1)K2FeO4是常见的水处理剂,净水原理如图所示。请回答下列问题:___________ 。
②过程a中K2FeO4体现___________ (填“氧化”或“还原”)性,反应过程中转移5.418×1022个电子,需要___________ mol K2FeO4。
(2)碱性条件下用Fe(OH)3和KClO反应制备K2FeO4。配平其反应的化学方程式:___________ 。
___________Fe(OH)3+___________KOH+___________KClO=___________K2FeO4+___________KCl+___________H2O
(3)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中的还原剂是___________ ,生产1mol的高铁酸钠,需要转移电子的物质的量是___________ mol。
(4)将铝箔放入NaOH稀溶液中,开始时无气体生成,写出反应的离子方程式:___________ ;反应片刻后,可观察到有气体产生。
(1)K2FeO4是常见的水处理剂,净水原理如图所示。请回答下列问题:
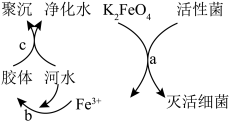
②过程a中K2FeO4体现
(2)碱性条件下用Fe(OH)3和KClO反应制备K2FeO4。配平其反应的化学方程式:
___________Fe(OH)3+___________KOH+___________KClO=___________K2FeO4+___________KCl+___________H2O
(3)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中的还原剂是
(4)将铝箔放入NaOH稀溶液中,开始时无气体生成,写出反应的离子方程式:
您最近一年使用:0次
四、解答题 添加题型下试题
解答题-实验探究题
|
较难(0.4)
名校
18. 铋酸钠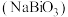 浅黄色、不溶于冷水、与热水或酸溶液要反应。它常用作分析试剂、氧化剂,如在钢铁分析中测定锰等。某同学在实验室用氯气将
浅黄色、不溶于冷水、与热水或酸溶液要反应。它常用作分析试剂、氧化剂,如在钢铁分析中测定锰等。某同学在实验室用氯气将 (白色,难溶于水)氧化制取
(白色,难溶于水)氧化制取 ,并探究其性质。各实验装置如下图所示:
,并探究其性质。各实验装置如下图所示:
(1)装置的连接顺序是:______→______→______→______(填装置下面的字母)_______ 。
(2)仪器a的名称是_______ ;D中装有的试剂是_______ 。
(3)装置C的作用是_______ ;装置A中盛NaOH溶液的恒压滴液漏斗的作用是_______ 。
(4)当B中出现白色固体消失的现象时,应进行的操作是_______ 。
(5)装置B中发生反应的离子方程式为_______ 。
(6)该同学将铋酸钠固体加到足量的浓盐酸中,发现浅黄色固体溶解,并有黄绿色气体产生,于是该同学很矛盾,矛盾的原因是:该实验现象说明 的氧化性比
的氧化性比 强,可是从装置B中的反应来看,
强,可是从装置B中的反应来看, 的氧化性比
的氧化性比 强。请你向该同学解释其原因
强。请你向该同学解释其原因_______ 。
(7)为测定产品的纯度。取上述 产品3.20g,用足量硫酸和
产品3.20g,用足量硫酸和 稀溶液使其还原为
稀溶液使其还原为 ,再将其准确配制成100mL溶液,取出25mL,用
,再将其准确配制成100mL溶液,取出25mL,用 的
的 标准溶液滴定生成的
标准溶液滴定生成的 ,滴定终点时消耗
,滴定终点时消耗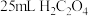 标准溶液,则该产品的纯度为
标准溶液,则该产品的纯度为_______ 。
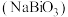 浅黄色、不溶于冷水、与热水或酸溶液要反应。它常用作分析试剂、氧化剂,如在钢铁分析中测定锰等。某同学在实验室用氯气将
浅黄色、不溶于冷水、与热水或酸溶液要反应。它常用作分析试剂、氧化剂,如在钢铁分析中测定锰等。某同学在实验室用氯气将 (白色,难溶于水)氧化制取
(白色,难溶于水)氧化制取 ,并探究其性质。各实验装置如下图所示:
,并探究其性质。各实验装置如下图所示:
(1)装置的连接顺序是:______→______→______→______(填装置下面的字母)
(2)仪器a的名称是
(3)装置C的作用是
(4)当B中出现白色固体消失的现象时,应进行的操作是
(5)装置B中发生反应的离子方程式为
(6)该同学将铋酸钠固体加到足量的浓盐酸中,发现浅黄色固体溶解,并有黄绿色气体产生,于是该同学很矛盾,矛盾的原因是:该实验现象说明
 的氧化性比
的氧化性比 强,可是从装置B中的反应来看,
强,可是从装置B中的反应来看, 的氧化性比
的氧化性比 强。请你向该同学解释其原因
强。请你向该同学解释其原因(7)为测定产品的纯度。取上述
 产品3.20g,用足量硫酸和
产品3.20g,用足量硫酸和 稀溶液使其还原为
稀溶液使其还原为 ,再将其准确配制成100mL溶液,取出25mL,用
,再将其准确配制成100mL溶液,取出25mL,用 的
的 标准溶液滴定生成的
标准溶液滴定生成的 ,滴定终点时消耗
,滴定终点时消耗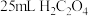 标准溶液,则该产品的纯度为
标准溶液,则该产品的纯度为
您最近一年使用:0次
2023-02-03更新
|
893次组卷
|
4卷引用:广东省茂名市第一中学2022-2023学年高三上学期期末化学诊断检测题
广东省茂名市第一中学2022-2023学年高三上学期期末化学诊断检测题(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(实验探究题)重庆市2023届高三第一次联合诊断检测(一模)(康德卷)化学试题辽宁省凤城市第二中学2023-2024学年高三上学期第一次考试化学试卷
解答题-工业流程题
|
适中(0.65)
19. 从铜阳极泥分铜渣碱浸液中回收碲的工艺流程如图所示。 的形式存在;
的形式存在;
②Na2SO3可将Te(IV)还原为0价Te;
③TeO2与氧化铝的性质具有一定的相似性。
(1) 中Te的化合价为
中Te的化合价为_______ 价,“还原”中发生反应的离子方程式(该工艺条件下,Pb2+不沉淀)为_______ 。
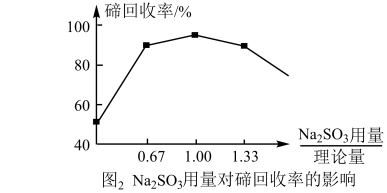
(2)“还原”过程中,反应温度、反应时间对碲回收率的影响如图1所示,工业上一般采取的条件为控制温度为75 °C ,反应时间为120 min,其原因是_______ 。_______ 。_______ 。
(5)加酸调pH时发生反应的化学方程式为_______ ,加入硫酸的量不宜过多,其原因是_______ 。

 的形式存在;
的形式存在;②Na2SO3可将Te(IV)还原为0价Te;
③TeO2与氧化铝的性质具有一定的相似性。
(1)
 中Te的化合价为
中Te的化合价为(2)“还原”过程中,反应温度、反应时间对碲回收率的影响如图1所示,工业上一般采取的条件为控制温度为75 °C ,反应时间为120 min,其原因是

(5)加酸调pH时发生反应的化学方程式为
您最近一年使用:0次
2023-04-03更新
|
414次组卷
|
2卷引用:河南省新乡市2023届高三下学期第二次模拟考试(二模)理科综合化学试题
试卷分析
整体难度:适中
考查范围:有机化学基础、物质结构与性质、化学与STSE、认识化学科学、化学反应原理、常见无机物及其应用、化学实验基础
试卷题型(共 19题)
题型
数量
单选题
15
解答题
3
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 加聚物的单体、链节及聚合度的确定 原子的基本构成 化学科学对人类文明发展的意义 | |
| 2 | 0.85 | 无机物质的分类 电解质与非电解质 | |
| 3 | 0.85 | 有机物的结构式、结构简式、比例模型、球棍模型、最简式 共价化合物的结构及形成过程 洪特规则 常见共价晶体的结构 | |
| 4 | 0.65 | 强电解质和弱电解质的判断 | |
| 5 | 0.65 | 离子方程式的正误判断 | |
| 6 | 0.65 | 阿伏加德罗常数的应用 氯气的实验室制法 二氧化硅的组成、结构 过氧化钠的物理性质、组成、结构及用途 | |
| 7 | 0.65 | 物质的量浓度的基础计算 一定物质的量浓度的溶液的配制 配制一定物质的量浓度的溶液的步骤、操作 配制一定物质的量浓度的溶液实验的误差分析 | |
| 8 | 0.65 | 离子方程式的正误判断 碳酸氢钠 物质分离、提纯综合应用 | |
| 9 | 0.65 | 氧化还原反应的应用 氧化还原反应有关计算 氧化还原反应的规律 | |
| 10 | 0.65 | 限定条件下的离子共存 铝与酸溶液反应 铝与强碱溶液反应 影响水电离的因素 | |
| 11 | 0.65 | 同主族元素性质递变规律理解及应用 | |
| 12 | 0.65 | Fe2+的还原性 盐类水解规律理解及应用 化学实验方案的设计与评价 | |
| 13 | 0.65 | 电离能变化规律 键能、键长、键角及应用 | |
| 14 | 0.65 | 原子中相关数值及其之间的相互关系 元素、核素、同位素 几种“相对原子质量”的计算 | |
| 15 | 0.65 | 氧化还原反应的应用 二氧化硫的化学性质 物质性质的探究 | |
| 二、解答题 | |||
| 16 | 0.85 | 离子方程式的书写 离子反应在化合物组成的分析、鉴定的应用 配制一定物质的量浓度溶液的综合考查 | 实验探究题 |
| 18 | 0.4 | 离子方程式的书写 氯气的实验室制法 综合实验设计与评价 氧化还原原理滴定 | 实验探究题 |
| 19 | 0.65 | 离子方程式的书写 氧化还原反应在生活、生产中的应用 含硫化合物之间的转化 电解法制取铝 | 工业流程题 |
| 三、填空题 | |||
| 17 | 0.85 | 离子方程式的书写 氧化还原反应方程式的书写与配平 氧化铝与碱溶液反应 电子转移计算 | |



