解题方法
1 . 高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含Fe2+、Mn2+、Cu2+、Ni2+、Cd2+等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
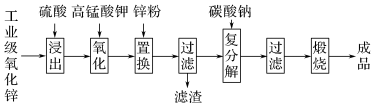
已知Ksp[Fe(OH)3]=8.0×10-38,回答下列问题:
(1)浸出时,为了提高浸出效率可采用的措施有(写一种既可)
(2)浸出步骤中发生主要反应的离子方程式为
(3)氧化时,加入KMnO4溶液是为了除去浸出液中的Fe2+和Mn2+(溶液中Mn全部转化为MnO2),请配平下列除去Fe2+的离子方程式:
□ +□Fe2++□___________=□MnO2↓+□Fe(OH)3↓+□H+
+□Fe2++□___________=□MnO2↓+□Fe(OH)3↓+□H+
(4)加入锌粉的目的是调节溶液pH除去Fe3+,和还原除去溶液中的
(5)已知H2SO4浸出液中,c(Fe2+)=50.4mg·L-1、c(Mn2+)=16.5mg·L-1,若要除尽1m3上述浸出液中的Fe2+和Mn2+,需加入
(6)若用酸性KMnO4标准溶液测定未知溶液中所含Fe2+的物质的量浓度(不含其他还原性粒子,MnO
 转化为Mn2+),不需要选取其他的指示剂,则滴定终点判断依据是
转化为Mn2+),不需要选取其他的指示剂,则滴定终点判断依据是
您最近一年使用:0次
2 . 水体中过量氨氮(以 表示)含量过高会导致水体富营养化。用次氯酸钠除去氨氮的一种原理如图所示。下列说法正确的是
表示)含量过高会导致水体富营养化。用次氯酸钠除去氨氮的一种原理如图所示。下列说法正确的是
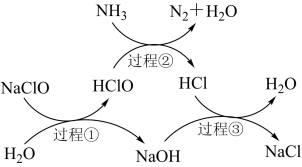
| A.上述三个过程对应的化学反应中氧化还原反应有两个 |
| B.温度越高越有利于去除氨氮 |
C.过程②生成标况下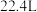 的 的 ,转移电子数目为6 ,转移电子数目为6 |
D.上述去除氨氮的总反应可以表示为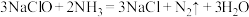 |
您最近一年使用:0次
3 . 下图中有5种物质 、
、 、
、 、
、 、
、 ,图中相交部分“A、B、C、D”代表两种物质相互反应的产物。
,图中相交部分“A、B、C、D”代表两种物质相互反应的产物。
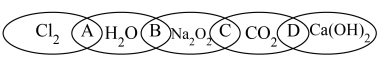
回答下列问题:
(1)5种物质中属于酸性氧化物的是___________ (填化学式,下同),属于电解质的是___________ 。
(2)产物中含有难溶电解质的是___________ (填“A”、“B”、“C”或“D”)。
(3)过去工业曾采用 与
与 溶液反应制备NaOH,写出相应的离子方程式
溶液反应制备NaOH,写出相应的离子方程式___________ ;现代工业利用电解饱和食盐水制备NaOH,同时生成两种单质 和X,写出相应的化学方程式
和X,写出相应的化学方程式___________ 。
(4)阴阳离子数目比:
___________  (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
 、
、 、
、 、
、 、
、 ,图中相交部分“A、B、C、D”代表两种物质相互反应的产物。
,图中相交部分“A、B、C、D”代表两种物质相互反应的产物。
回答下列问题:
(1)5种物质中属于酸性氧化物的是
(2)产物中含有难溶电解质的是
(3)过去工业曾采用
 与
与 溶液反应制备NaOH,写出相应的离子方程式
溶液反应制备NaOH,写出相应的离子方程式 和X,写出相应的化学方程式
和X,写出相应的化学方程式(4)阴阳离子数目比:

 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
您最近一年使用:0次
解题方法
4 . 用盐酸洗钢材会产生“酸洗废液”(主要成分为FeCl2)。工业上用“酸洗废液”经高温氧化制取高纯氧化铁,同时产生的氯化氢气体可回收使用,发生的反应为aFeCl2 +bO2 + cH2O dFe2O3+8HCl(未配平)。下列说法正确的是
dFe2O3+8HCl(未配平)。下列说法正确的是
 dFe2O3+8HCl(未配平)。下列说法正确的是
dFe2O3+8HCl(未配平)。下列说法正确的是| A.a+b+d=7 |
| B.该反应中,每消耗3.2gO2,同时生成32 g Fe2O3 |
| C.该反应中,HCl既是氧化产物也是还原产物 |
| D.将生成的气体通入碳酸氢钙溶液中,会有碳酸钙沉淀生成 |
您最近一年使用:0次
解题方法
5 . 一种锂离子电池的正极材料中含钴酸锂( )。某离子反应涉及
)。某离子反应涉及 、
、 、
、 、
、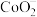 、
、 、
、 等微粒,溶液中
等微粒,溶液中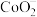 、
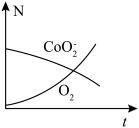
、 的粒子数目随时间变化的曲线如图所示。下列说法错误的是
的粒子数目随时间变化的曲线如图所示。下列说法错误的是
 )。某离子反应涉及
)。某离子反应涉及 、
、 、
、 、
、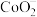 、
、 、
、 等微粒,溶液中
等微粒,溶液中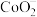 、
、 的粒子数目随时间变化的曲线如图所示。下列说法错误的是
的粒子数目随时间变化的曲线如图所示。下列说法错误的是
A.反应中的还原剂是 |
B.氧化性: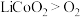 |
| C.反应配平后氧化剂与还原剂的化学计量数之比为2:1 |
D.每生成2分子 转移8个电子 转移8个电子 |
您最近一年使用:0次
6 . 碱式硫酸铁[Fe(OH)SO4]难溶于水,可做净水剂、媒染剂、颜料和药物。可由硫酸亚铁与稀硝酸共热制得。某实验小组欲用如图所示装置进行实验,回答下列问题:

(1) 的空间结构为
的空间结构为___________ ;锥形瓶中发生反应的化学方程式为___________ ;某同学认为用H2O2溶液代替稀硝酸更好,理由是___________ 。
(2)酸性高锰酸钾溶液可除去一氧化氮,反应的离子方程式为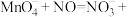
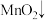 。该反应分两步进行。第一步是高锰酸钾把一氧化氮氧化为二氧化氮,反应的离子方程式为
。该反应分两步进行。第一步是高锰酸钾把一氧化氮氧化为二氧化氮,反应的离子方程式为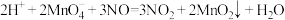 ,则第二步反应的离子方程式为
,则第二步反应的离子方程式为___________ 。
(3)某同学测定产物纯度的方法如下:称取2.5g产物溶于适量稀硫酸中,加入足量KI溶液,充分反应后,滴入几滴淀粉溶液,用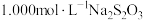 标准溶液滴定至终点,消耗标准液
标准溶液滴定至终点,消耗标准液 (涉及的反应方程式为
(涉及的反应方程式为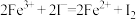 、
、 )。
)。
①盛装Na2S2O3标准溶液的滴定管应选用___________ (填“酸式”或“碱式”)滴定管。
②判断达到滴定终点的方法为___________ 。
③该产品的纯度为___________ %。滴定过程中,如果滴定速度过慢,可能导致所测结果___________ (填“偏高”“偏低”或“无影响”)。

(1)
 的空间结构为
的空间结构为(2)酸性高锰酸钾溶液可除去一氧化氮,反应的离子方程式为
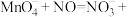
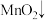 。该反应分两步进行。第一步是高锰酸钾把一氧化氮氧化为二氧化氮,反应的离子方程式为
。该反应分两步进行。第一步是高锰酸钾把一氧化氮氧化为二氧化氮,反应的离子方程式为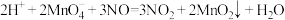 ,则第二步反应的离子方程式为
,则第二步反应的离子方程式为(3)某同学测定产物纯度的方法如下:称取2.5g产物溶于适量稀硫酸中,加入足量KI溶液,充分反应后,滴入几滴淀粉溶液,用
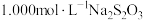 标准溶液滴定至终点,消耗标准液
标准溶液滴定至终点,消耗标准液 (涉及的反应方程式为
(涉及的反应方程式为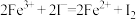 、
、 )。
)。①盛装Na2S2O3标准溶液的滴定管应选用
②判断达到滴定终点的方法为
③该产品的纯度为
您最近一年使用:0次
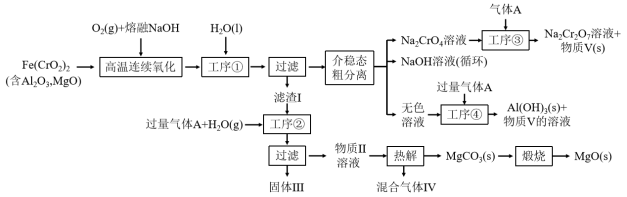
7 . 绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr—Fe—Al—Mg的深度利用和Na+内循环。工艺流程如图:
回答下列问题:
(1)高温连续氧化工序中被氧化的元素是_______ (填元素符号),Cr元素在元素周期表中的位置_______ ,
(2)滤渣I的主要成分是_______ (填化学式)。
(3)工序③中发生反应的离子方程式为_______ 。
(4)物质V可代替高温连续氧化工序中的NaOH,此时发生的主要反应的化学方程式为_____ 。钠在火焰上灼烧产生的黄光是一种_______ (填“吸收光谱” 或“发射光谱”)。
(5)工序④溶液中的铝元素恰好完全转化为沉淀的pH为_______ 。(通常认为溶液中离子浓度小于10-5mol•L-1为沉淀完全;A1(OH)3+OH-⇌Al(OH) :K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)
:K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)
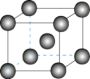
(6)基态Al原子的核外电子排布式为_______ 。Fe的晶胞结构如图所示,已知NA表示阿伏加德罗常数的值,若晶胞参数为a nm,则Fe晶胞的密度为_______ g•cm-3(用含NA和a的代数式表示)。

回答下列问题:
(1)高温连续氧化工序中被氧化的元素是
(2)滤渣I的主要成分是
(3)工序③中发生反应的离子方程式为
(4)物质V可代替高温连续氧化工序中的NaOH,此时发生的主要反应的化学方程式为
(5)工序④溶液中的铝元素恰好完全转化为沉淀的pH为
 :K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)
:K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)(6)基态Al原子的核外电子排布式为

您最近一年使用:0次
解题方法
8 . “声名大振”学习小组围绕新型绿色消毒剂——高铁酸钠( )展开探究。如图所示物质转化关系为高铁酸钠的一种制备方法及有关性质实验(部分反应产物已略去)。已知A为气态非金属单质,B为金属单质,E为生活中常见的调味品,F在标准状况下密度为
)展开探究。如图所示物质转化关系为高铁酸钠的一种制备方法及有关性质实验(部分反应产物已略去)。已知A为气态非金属单质,B为金属单质,E为生活中常见的调味品,F在标准状况下密度为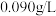 。
。

请回答:
(1)化合物D中的化学键类型是______ 。
(2) 的电子式是
的电子式是______ 。
(3)反应②的离子方程式是______ 。
(4)反应③,F在A中燃烧的反应现象是______ 。
(5)反应⑤的化学方程式是______ 。
(6)请在方框内填入相应物质的化学式,完成反应④的化学方程式,并标明电子转移的方向和数目:______ 。
2 +3
+3 +
+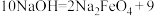
 +5
+5
 )展开探究。如图所示物质转化关系为高铁酸钠的一种制备方法及有关性质实验(部分反应产物已略去)。已知A为气态非金属单质,B为金属单质,E为生活中常见的调味品,F在标准状况下密度为
)展开探究。如图所示物质转化关系为高铁酸钠的一种制备方法及有关性质实验(部分反应产物已略去)。已知A为气态非金属单质,B为金属单质,E为生活中常见的调味品,F在标准状况下密度为 。
。
请回答:
(1)化合物D中的化学键类型是
(2)
 的电子式是
的电子式是(3)反应②的离子方程式是
(4)反应③,F在A中燃烧的反应现象是
(5)反应⑤的化学方程式是
(6)请在方框内填入相应物质的化学式,完成反应④的化学方程式,并标明电子转移的方向和数目:
2
 +3
+3 +
+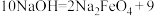
 +5
+5
您最近一年使用:0次
解题方法
9 . ClO2是新一代高效安全的杀菌剂,可用于自来水消毒。由于其浓度过高时易分解,常将其转化成NaClO2晶体以便储运。亚氯酸钠(NaClO2)是一种高效氧化剂和漂白剂,主要用于棉纺、纸张漂白、食品消毒、水处理等,消毒时本身被还原成Cl-。亚氯酸钠晶体的一种生产工艺如图:
②H2O受热易分解。
(1)向“反应器”中鼓入空气的作用是______ 。
(2)“吸收塔”的作用是将产生的ClO2转化为NaClO2,在此过程中加入的H2O2的作用是_____ (填“氧化剂”或“还原剂”),当有1molH2O2参与该反应时,反应转移的电子数为______ 。
(3)“吸收塔”中需要控制温度不超过20℃,其原因是______ 。
(4)写出“反应器”步骤中生成ClO2的离子方程式______ 。
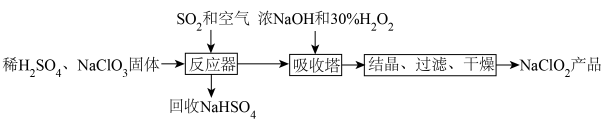
②H2O受热易分解。
(1)向“反应器”中鼓入空气的作用是
(2)“吸收塔”的作用是将产生的ClO2转化为NaClO2,在此过程中加入的H2O2的作用是
(3)“吸收塔”中需要控制温度不超过20℃,其原因是
(4)写出“反应器”步骤中生成ClO2的离子方程式
您最近一年使用:0次
解题方法
10 . 乙炔亚铜( )是一种对热和冲击敏感的高爆炸药,是鲜有的在引爆后不释放气体的爆炸物,查阅资料可知:
)是一种对热和冲击敏感的高爆炸药,是鲜有的在引爆后不释放气体的爆炸物,查阅资料可知:
①盐酸羟胺[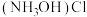 ]中的
]中的 还原
还原 可制备
可制备 ;
;
② 可与乙炔气体反应得到暗红色
可与乙炔气体反应得到暗红色 沉淀;
沉淀; 也可与
也可与 或
或 发生反应。
发生反应。
某兴趣小组设计如下实验:
步骤Ⅰ.向盛有 溶液的烧杯中缓慢滴加氨水直至过量。
溶液的烧杯中缓慢滴加氨水直至过量。
步骤Ⅱ.按上图组装仪器,检验气密性后,装入药品
步骤Ⅲ.打开旋塞b,加入盐酸羟胺至溶液变为无色,关闭旋塞b。
步骤Ⅳ.打开旋塞a,加入饱和食盐水制备乙炔,仪器Y中产生大量暗红色沉淀时停止实验
(1)仪器Y的名称为______ ;X的化学式为______ 。
(2)步骤Ⅰ过程中观察到的实验现象为______ 。
(3)步骤Ⅲ过程中盐酸羟胺中的 被
被 氧化为
氧化为 ,该反放的离子方程式为
,该反放的离子方程式为______ 。
(4)步骤Ⅳ中使用饱和食盐水代替蒸馏水的原因为______ 。
(5)乙炔的电子式为______ 。
(6)步骤Ⅳ中,在仪器Y中得到暗红色沉淀的离子方程式为______ 。
 )是一种对热和冲击敏感的高爆炸药,是鲜有的在引爆后不释放气体的爆炸物,查阅资料可知:
)是一种对热和冲击敏感的高爆炸药,是鲜有的在引爆后不释放气体的爆炸物,查阅资料可知:①盐酸羟胺[
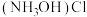 ]中的
]中的 还原
还原 可制备
可制备 ;
;②
 可与乙炔气体反应得到暗红色
可与乙炔气体反应得到暗红色 沉淀;
沉淀; 也可与
也可与 或
或 发生反应。
发生反应。某兴趣小组设计如下实验:
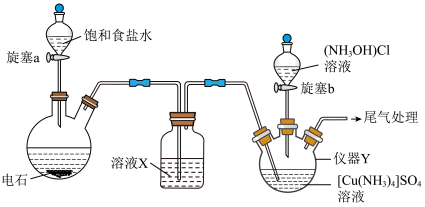
步骤Ⅰ.向盛有
 溶液的烧杯中缓慢滴加氨水直至过量。
溶液的烧杯中缓慢滴加氨水直至过量。步骤Ⅱ.按上图组装仪器,检验气密性后,装入药品
步骤Ⅲ.打开旋塞b,加入盐酸羟胺至溶液变为无色,关闭旋塞b。
步骤Ⅳ.打开旋塞a,加入饱和食盐水制备乙炔,仪器Y中产生大量暗红色沉淀时停止实验
(1)仪器Y的名称为
(2)步骤Ⅰ过程中观察到的实验现象为
(3)步骤Ⅲ过程中盐酸羟胺中的
 被
被 氧化为
氧化为 ,该反放的离子方程式为
,该反放的离子方程式为(4)步骤Ⅳ中使用饱和食盐水代替蒸馏水的原因为
(5)乙炔的电子式为
(6)步骤Ⅳ中,在仪器Y中得到暗红色沉淀的离子方程式为
您最近一年使用:0次



