1 . 按要求填空:
(1)高铁酸钠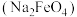 是一种新型的净水剂,可以通过下述反应制取:
是一种新型的净水剂,可以通过下述反应制取: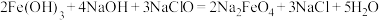 。
。
① 中
中 元素的化合价是
元素的化合价是___________ ,反应中被还原的元素是___________ (用元素符号表示)该反应中属于盐的电解质有___________ 种
②写出上述反应的离子反应方程式( 为可溶性盐):
为可溶性盐):___________ 。
(2)饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以用化学方法处理
的浓度,可以用化学方法处理 ,其化学方程式为
,其化学方程式为
①上述反应中,氧化剂是___________ (用化学式表示)
②在上述反应中,每生成 分子,转移电子数目为
分子,转移电子数目为___________ 个。
(1)高铁酸钠
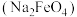 是一种新型的净水剂,可以通过下述反应制取:
是一种新型的净水剂,可以通过下述反应制取: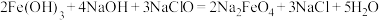 。
。①
 中
中 元素的化合价是
元素的化合价是②写出上述反应的离子反应方程式(
 为可溶性盐):
为可溶性盐):(2)饮用水中的
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以用化学方法处理
的浓度,可以用化学方法处理 ,其化学方程式为
,其化学方程式为
①上述反应中,氧化剂是
②在上述反应中,每生成
 分子,转移电子数目为
分子,转移电子数目为
您最近一年使用:0次
2 . 金属及其化合物在生产和生活中有广泛的应用。回答下列问题:
(1)一种管道疏通剂的主要成分有NaOH和铝粉,解释该疏通剂的疏通原理_______ 。
(2)汽车安全气囊内装有NaN3、Fe2O3和NaHCO3等物质。
①当汽车发生严重碰撞时,引发NaN3分解并放出大量的热:2NaN3 2Na+3N2↑。该反应中氧化产物和还原产物的物质的量之比为
2Na+3N2↑。该反应中氧化产物和还原产物的物质的量之比为_______ 。
②产生的Na立即与Fe2O3发生置换反应生成Na2O,反应的化学方程式为_______ 。
(3)在含有Fe3+、Cu2+、Cl-、H+的混合溶液中加入铁粉,充分反应后,溶液中剩余固体可被磁铁吸引。此时溶液中存在较多的阳离子是_______ (填离子符号)。
(1)一种管道疏通剂的主要成分有NaOH和铝粉,解释该疏通剂的疏通原理
(2)汽车安全气囊内装有NaN3、Fe2O3和NaHCO3等物质。
①当汽车发生严重碰撞时,引发NaN3分解并放出大量的热:2NaN3
 2Na+3N2↑。该反应中氧化产物和还原产物的物质的量之比为
2Na+3N2↑。该反应中氧化产物和还原产物的物质的量之比为②产生的Na立即与Fe2O3发生置换反应生成Na2O,反应的化学方程式为
(3)在含有Fe3+、Cu2+、Cl-、H+的混合溶液中加入铁粉,充分反应后,溶液中剩余固体可被磁铁吸引。此时溶液中存在较多的阳离子是
您最近一年使用:0次
3 . 宏观辨识与微观探析是化学学科核心素养之一。根据所学知识,回答下列问题:
(1)铁的化合物在实际中应用广泛,如氯化铁可用于五金蚀刻、污水处理及作催化剂、凝聚剂等。
①氯化铁常用作印刷电路板的蚀刻剂,写出Cu与 反应的离子方程式:
反应的离子方程式:_______ ;反应后再通入氯气,又可将氯化亚铁转化为氯化铁,则通入氯气后反应的离子方程式为_______ 。
②氯化铁常用于净水,是因为铁离子转化为 胶体,胶体使水中悬浮物聚沉。
胶体,胶体使水中悬浮物聚沉。 胶体分散质粒子直径的范围是
胶体分散质粒子直径的范围是_______ ,检验氢氧化铁胶体是否制备成功常用的方法是_______ 。
(2)用电弧法合成的纳米碳管中常含有大量的杂质碳纳米颗粒,可用氧化气化法提纯,反应的化学方程式为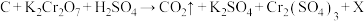 (X中的元素在反应前后未变价,反应未配平)。
(X中的元素在反应前后未变价,反应未配平)。
①该反应中,氧化剂是_______ (填化学式),被氧化的元素是_______ (填元素符号)。
②配平上述方程式:______ 。每生成4.4g  ,该反应转移的电子的物质的量为
,该反应转移的电子的物质的量为______ mol。
(1)铁的化合物在实际中应用广泛,如氯化铁可用于五金蚀刻、污水处理及作催化剂、凝聚剂等。
①氯化铁常用作印刷电路板的蚀刻剂,写出Cu与
 反应的离子方程式:
反应的离子方程式:②氯化铁常用于净水,是因为铁离子转化为
 胶体,胶体使水中悬浮物聚沉。
胶体,胶体使水中悬浮物聚沉。 胶体分散质粒子直径的范围是
胶体分散质粒子直径的范围是(2)用电弧法合成的纳米碳管中常含有大量的杂质碳纳米颗粒,可用氧化气化法提纯,反应的化学方程式为
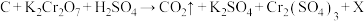 (X中的元素在反应前后未变价,反应未配平)。
(X中的元素在反应前后未变价,反应未配平)。①该反应中,氧化剂是
②配平上述方程式:
 ,该反应转移的电子的物质的量为
,该反应转移的电子的物质的量为
您最近一年使用:0次
解题方法
4 . 微颗粒的氧化锌作为一种纳米材料开始在相关领域发挥作用,利用锌焙砂 主要成分为
主要成分为 ,含
,含 及铅、铜、镉的氧化物
及铅、铜、镉的氧化物 生产高纯氧化锌的工业流程如图所示,回答下列问题:
生产高纯氧化锌的工业流程如图所示,回答下列问题:

已知: 微溶于水而生成亚砷酸
微溶于水而生成亚砷酸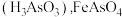 和
和 难溶于水。
难溶于水。
(1)基态 原子核外价层电子轨道表达式为
原子核外价层电子轨道表达式为______ , 中
中 的化合价为
的化合价为______ 。
(2)“浸出”过程中 足量,则生成的主要配离子的化学式为
足量,则生成的主要配离子的化学式为______ ;增大浸出率可采取的措施是______  写出两条
写出两条 。
。
(3)“除砷”过程中, 作氧化剂
作氧化剂 溶液呈酸性
溶液呈酸性 ,发生反应的离子方程式为
,发生反应的离子方程式为______ 。
(4)“除重金属”过程中加入 后
后 在溶液中的残留浓度为
在溶液中的残留浓度为 ,此时
,此时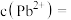
______ 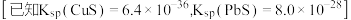 。
。
(5)“沉锌”前锌元素以 存在,写出“沉锌”的化学方程式
存在,写出“沉锌”的化学方程式______ 。
(6)流程中可循环利用的物质有 、
、______ 、______  填化学式
填化学式 。
。
 主要成分为
主要成分为 ,含
,含 及铅、铜、镉的氧化物
及铅、铜、镉的氧化物 生产高纯氧化锌的工业流程如图所示,回答下列问题:
生产高纯氧化锌的工业流程如图所示,回答下列问题:
已知:
 微溶于水而生成亚砷酸
微溶于水而生成亚砷酸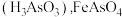 和
和 难溶于水。
难溶于水。(1)基态
 原子核外价层电子轨道表达式为
原子核外价层电子轨道表达式为 中
中 的化合价为
的化合价为(2)“浸出”过程中
 足量,则生成的主要配离子的化学式为
足量,则生成的主要配离子的化学式为 写出两条
写出两条 。
。(3)“除砷”过程中,
 作氧化剂
作氧化剂 溶液呈酸性
溶液呈酸性 ,发生反应的离子方程式为
,发生反应的离子方程式为(4)“除重金属”过程中加入
 后
后 在溶液中的残留浓度为
在溶液中的残留浓度为 ,此时
,此时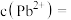
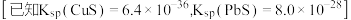 。
。(5)“沉锌”前锌元素以
 存在,写出“沉锌”的化学方程式
存在,写出“沉锌”的化学方程式(6)流程中可循环利用的物质有
 、
、 填化学式
填化学式 。
。
您最近一年使用:0次
5 . 某研究小组以TiCl4为原料制备新型耐热材料TiN。
步骤一:TiCl4水解制备TiO2(实验装置如图A,夹持装置省略):滴入TiCl4,边搅拌边加热,使混合液升温至80℃,保温3小时。离心分离白色沉淀TiO2·xH2O并洗涤,煅烧制得TiO2。
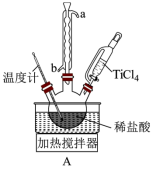
(1)装置A中冷凝水的入口为_______ (填“a”或“b”)。
(2)三颈烧瓶中预置的稀盐酸可抑制胶体形成、促进白色沉淀生成。 水解生成的胶体主要成分为
水解生成的胶体主要成分为_______ (填化学式)。
(3)判断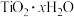 沉淀是否洗涤干净,可使用的检验试剂有
沉淀是否洗涤干净,可使用的检验试剂有_______ 。
步骤二:由 制备TiN并测定产率(实验装置如下图,夹持装置省略)。
制备TiN并测定产率(实验装置如下图,夹持装置省略)。

(4)装置C中试剂X为_______ 。
(5)装置D中反应生成TiN、N2和H2O,该反应的化学方程式为_______ 。
(6)装置E的作用是吸收水和_______ 。
(7)实验中部分操作如下:
a.反应前,称取0.800gTiO2样品; b.打开装置B中恒压滴液漏斗旋塞;
c.关闭装置B中恒压滴液漏斗旋塞; d.打开管式炉加热开关,加热至800℃左右;
e.关闭管式炉加热开关,待装置冷却; f.反应后,称得瓷舟中固体质量为0.496g。
①正确的操作顺序为:a→b→d→c→c→f。
②TiN的产率为_______ 。
步骤一:TiCl4水解制备TiO2(实验装置如图A,夹持装置省略):滴入TiCl4,边搅拌边加热,使混合液升温至80℃,保温3小时。离心分离白色沉淀TiO2·xH2O并洗涤,煅烧制得TiO2。

(1)装置A中冷凝水的入口为
(2)三颈烧瓶中预置的稀盐酸可抑制胶体形成、促进白色沉淀生成。
 水解生成的胶体主要成分为
水解生成的胶体主要成分为(3)判断
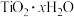 沉淀是否洗涤干净,可使用的检验试剂有
沉淀是否洗涤干净,可使用的检验试剂有步骤二:由
 制备TiN并测定产率(实验装置如下图,夹持装置省略)。
制备TiN并测定产率(实验装置如下图,夹持装置省略)。
(4)装置C中试剂X为
(5)装置D中反应生成TiN、N2和H2O,该反应的化学方程式为
(6)装置E的作用是吸收水和
(7)实验中部分操作如下:
a.反应前,称取0.800gTiO2样品; b.打开装置B中恒压滴液漏斗旋塞;
c.关闭装置B中恒压滴液漏斗旋塞; d.打开管式炉加热开关,加热至800℃左右;
e.关闭管式炉加热开关,待装置冷却; f.反应后,称得瓷舟中固体质量为0.496g。
①正确的操作顺序为:a→b→d→c→c→f。
②TiN的产率为
您最近一年使用:0次
名校
解题方法
6 . K2FeO4具有强氧化性,酸性条件下,其氧化性强于Cl2、KMnO4,其制备的流程如下: 生成。下列说法正确的是
生成。下列说法正确的是

 生成。下列说法正确的是
生成。下列说法正确的是| A.K2FeO4中铁元素的化合价是+8 |
B.“转化1”发生反应的离子方程式为:2Fe3++3ClO-+5H2O=2 +3Cl-+10H+ +3Cl-+10H+ |
| C.“转化2” 能进行的原因是该条件下K2FeO4的溶解度比Na2FeO4小 |
D.所得滤液含有大量的Na+、H+、 、Cl- 、Cl- |
您最近一年使用:0次
2024-04-03更新
|
102次组卷
|
14卷引用:江苏省连云港高级中学2021-2022学年高一下学期第二次阶段测试化学试题
江苏省连云港高级中学2021-2022学年高一下学期第二次阶段测试化学试题江苏省苏州市苏州高新区第一中学2022-2023学年高一下学期3月月考化学试题江苏省扬州中学2022-2023学年高一下学期5月月考化学试题江苏省常熟中学2022-2023学年高一下学期学业质量阳光指标调研化学试题13 2024年苏州吴江高级中学高一3月月考01 2024年苏州南航附中高一3月月考江苏省扬州市2020-2021学年高一下学期期末考试化学试题江苏省宿迁市泗阳县2021-2022学年高一下学期期中调研化学试题江苏省常熟市2021-2022学年高一下学期期中考试化学试题江苏省苏州市震泽中学2021-2022学年高一下学期期中测试化学试题福建省福清市高中联合体2022-2023学年高一下学期期末考试化学试题江苏省盐城市五校联盟2023-2024学年高一上学期1月期末化学试题(已下线)综合期末压轴85+18题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(江苏专用)江苏省盐城市响水中学2023-2024学年高一下学期期中考试化学选修班试题
解题方法
7 . 已知海水中溴元素主要以 形式存在,工业上从海水中提取溴的流程如下:
形式存在,工业上从海水中提取溴的流程如下:
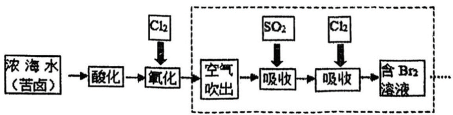
资料:溴单质容易挥发。
(1)写出“氧化”时的离子方程式____________ 。
(2)写出第1步“吸收”时的离子方程式____________________ ,该反应体现了 的
的____________ 性。
(3)得到的“含 溶液”通过以下不同操作,都可得到溴单质:
溶液”通过以下不同操作,都可得到溴单质:
①直接蒸馏得到溴单质,该操作利用的是溴的何种性质:________________ ;
②加入四氯化碳萃取,将得到的溴的四氯化碳溶液蒸馏得到溴单质。可以用四氯化碳对溴溶液进行萃取利用的是溴的何种性质:________________ 。
(4)工业可用 溶液代替二氧化硫的水溶液吸收
溶液代替二氧化硫的水溶液吸收 ,完成下列化学反应方程式:
,完成下列化学反应方程式:_____ 。
_________ _________
_________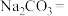 _________
_________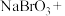 _________
_________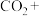 _________
_________
若有480g溴完全反应,转移电子的物质的量为_________  。
。
 形式存在,工业上从海水中提取溴的流程如下:
形式存在,工业上从海水中提取溴的流程如下:
资料:溴单质容易挥发。
(1)写出“氧化”时的离子方程式
(2)写出第1步“吸收”时的离子方程式
 的
的(3)得到的“含
 溶液”通过以下不同操作,都可得到溴单质:
溶液”通过以下不同操作,都可得到溴单质:①直接蒸馏得到溴单质,该操作利用的是溴的何种性质:
②加入四氯化碳萃取,将得到的溴的四氯化碳溶液蒸馏得到溴单质。可以用四氯化碳对溴溶液进行萃取利用的是溴的何种性质:
(4)工业可用
 溶液代替二氧化硫的水溶液吸收
溶液代替二氧化硫的水溶液吸收 ,完成下列化学反应方程式:
,完成下列化学反应方程式:_________
 _________
_________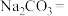 _________
_________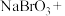 _________
_________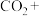 _________
_________若有480g溴完全反应,转移电子的物质的量为
 。
。
您最近一年使用:0次
名校
8 . 工业或机动车尾气中的 会造成环境问题,可用多种方法脱除。
会造成环境问题,可用多种方法脱除。
(1)碱液吸收:NaOH溶液可吸收硝酸工业尾气(含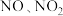 ),获得副产品。
),获得副产品。
①等物质的量NO与 被NaOH溶液吸收,产物只有一种盐,反应的离子方程式为
被NaOH溶液吸收,产物只有一种盐,反应的离子方程式为_______ 。
②若吸收时NO与 比例控制不当,则吸收液经浓缩结晶、过滤得到
比例控制不当,则吸收液经浓缩结晶、过滤得到 晶体中最有可能混有的杂质是
晶体中最有可能混有的杂质是_______ (填化学式)。排放的尾气中含量较高的氮氧化物是_______ (填化学式)。
(2)还原法:尿素水溶液热解产生的 可去除尾气中的
可去除尾气中的 ,流程如下:
,流程如下:
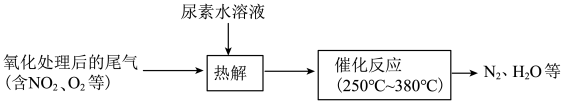
①尿素 中氮元素的化合价为
中氮元素的化合价为_______ 。
②写出“催化反应”过程中 还原
还原 的化学方程式
的化学方程式_______ 。
③若氧化处理后的尾气中混有 ,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低
,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低 的去除率。试分析硫酸盐的产生过程
的去除率。试分析硫酸盐的产生过程_______ 。
④“催化反应”过程中需控制温度在250℃~380℃之间,温度过高, 的去除率下降,其原因可能是温度过高催化剂的活性降低和
的去除率下降,其原因可能是温度过高催化剂的活性降低和_______ 。
 会造成环境问题,可用多种方法脱除。
会造成环境问题,可用多种方法脱除。(1)碱液吸收:NaOH溶液可吸收硝酸工业尾气(含
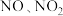 ),获得副产品。
),获得副产品。①等物质的量NO与
 被NaOH溶液吸收,产物只有一种盐,反应的离子方程式为
被NaOH溶液吸收,产物只有一种盐,反应的离子方程式为②若吸收时NO与
 比例控制不当,则吸收液经浓缩结晶、过滤得到
比例控制不当,则吸收液经浓缩结晶、过滤得到 晶体中最有可能混有的杂质是
晶体中最有可能混有的杂质是(2)还原法:尿素水溶液热解产生的
 可去除尾气中的
可去除尾气中的 ,流程如下:
,流程如下:
①尿素
 中氮元素的化合价为
中氮元素的化合价为②写出“催化反应”过程中
 还原
还原 的化学方程式
的化学方程式③若氧化处理后的尾气中混有
 ,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低
,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低 的去除率。试分析硫酸盐的产生过程
的去除率。试分析硫酸盐的产生过程④“催化反应”过程中需控制温度在250℃~380℃之间,温度过高,
 的去除率下降,其原因可能是温度过高催化剂的活性降低和
的去除率下降,其原因可能是温度过高催化剂的活性降低和
您最近一年使用:0次
2024-04-03更新
|
393次组卷
|
2卷引用:12 2024苏州太仓明德高级中学高一3月月考
9 . 碘微溶于水,若水中含I﹣,碘溶解度增大,因为存在平衡: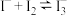 。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、
。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、 、
、 和淀粉)回收Ⅰ2。回答下列问题:
和淀粉)回收Ⅰ2。回答下列问题:
(1)反应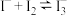 平衡常数测定,步骤如下:
平衡常数测定,步骤如下:
I.将一定质量的单质Ⅰ2完全溶于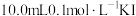 溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;
溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;
Ⅱ.实验测得上层溶液中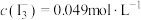 ;
;
Ⅲ.滴定下层溶液至终点时,消耗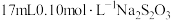 溶液
溶液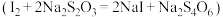 。
。
已知: 、
、 不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即
不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即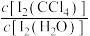 是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。
是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。
①分液时,使用的玻璃仪器有___________ 。
②该条件下反应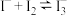 的平衡常数K=
的平衡常数K=___________ (保留三位有效数字)。
(2)某废碘液(含有Ⅰ2、 、
、 和淀粉)回收Ⅰ2的实验过程如下:
和淀粉)回收Ⅰ2的实验过程如下:
i.还原:取100mL废碘液,加入Na2S2O3将Ⅰ2、Ⅰ3还原为 ;
;
ii.浓缩:加热浓缩到原体积的50%;
iii.氧化:向浓缩液中加入稍过量的研细的FeCl3固体,充分搅拌,静置;
iv.过滤:得粗碘和碘水;
v.升华:粗碘中含有FeCl3等杂质,用升华法提纯得精碘。
①还原时判断Ⅰ2、 全部还原为
全部还原为 的实验现象是
的实验现象是___________ 。
②还原和浓缩的顺序不能交换,可能原因是___________ 。
③氧化时发生反应的离子方程式为___________ 。
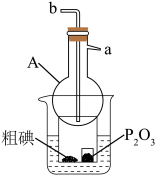
④升华法提纯粗碘的装置如图所示(加热装置已省略)。使用仪器A进行回流水冷却,仪器A的名称是___________ ,进水口为___________ (填“a”或“b”),小烧杯中放置P2O5的作用是___________ 。
⑤碘水可用乙醚一四氯化碳的混合溶剂萃取进一步回收碘,萃取剂总体积为10mL时四氯化碳与乙醚不同比例下的实验对比结果如下表:
由此得出的结论是___________ 。
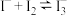 。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、
。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、 、
、 和淀粉)回收Ⅰ2。回答下列问题:
和淀粉)回收Ⅰ2。回答下列问题:(1)反应
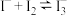 平衡常数测定,步骤如下:
平衡常数测定,步骤如下:I.将一定质量的单质Ⅰ2完全溶于
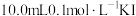 溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;
溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;Ⅱ.实验测得上层溶液中
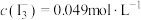 ;
;Ⅲ.滴定下层溶液至终点时,消耗
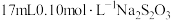 溶液
溶液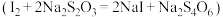 。
。已知:
 、
、 不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即
不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即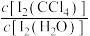 是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。
是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。①分液时,使用的玻璃仪器有
②该条件下反应
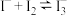 的平衡常数K=
的平衡常数K=(2)某废碘液(含有Ⅰ2、
 、
、 和淀粉)回收Ⅰ2的实验过程如下:
和淀粉)回收Ⅰ2的实验过程如下:i.还原:取100mL废碘液,加入Na2S2O3将Ⅰ2、Ⅰ3还原为
 ;
;ii.浓缩:加热浓缩到原体积的50%;
iii.氧化:向浓缩液中加入稍过量的研细的FeCl3固体,充分搅拌,静置;
iv.过滤:得粗碘和碘水;
v.升华:粗碘中含有FeCl3等杂质,用升华法提纯得精碘。
①还原时判断Ⅰ2、
 全部还原为
全部还原为 的实验现象是
的实验现象是②还原和浓缩的顺序不能交换,可能原因是
③氧化时发生反应的离子方程式为
④升华法提纯粗碘的装置如图所示(加热装置已省略)。使用仪器A进行回流水冷却,仪器A的名称是

⑤碘水可用乙醚一四氯化碳的混合溶剂萃取进一步回收碘,萃取剂总体积为10mL时四氯化碳与乙醚不同比例下的实验对比结果如下表:
| 比例 | 1:0 | 1:1 | 1:2 | 1:3 | 1:4 | 1:5 |
| 萃取后碘水 | 红 | 浅黄红 | 浅黄 | 浅黄红 | 较浅黄色 | 接近无色 |
您最近一年使用:0次
解题方法
10 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含 、
、 、
、 、
、 、
、 、
、 等元素的氧化物)制备,工艺如图所示。回答下列问题:
等元素的氧化物)制备,工艺如图所示。回答下列问题:

相关金属离子[起始浓度为 ]形成氢氧化物沉淀的
]形成氢氧化物沉淀的 范围如表:
范围如表:
(1)“滤渣1”含有 和
和___________ 。
(2)“氧化”中添加适量的 的作用是将
的作用是将 氧化为
氧化为 ,写出该反应的离子方程式为
,写出该反应的离子方程式为___________ 。
(3)调 范围为4.7~6,滤渣2成分的化学式为
范围为4.7~6,滤渣2成分的化学式为___________ 。
(4)“除杂1”的目的是除去 和
和 ,“滤渣3”的主要成分是
,“滤渣3”的主要成分是___________ 。
(5)“除杂2”的目的是生成 沉淀除去
沉淀除去 。若溶液酸度过高,
。若溶液酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是___________ (从沉淀溶解平衡角度解释)。
(6)写出“沉锰”的离子方程式___________ 。
 、
、 、
、 、
、 、
、 、
、 等元素的氧化物)制备,工艺如图所示。回答下列问题:
等元素的氧化物)制备,工艺如图所示。回答下列问题:
相关金属离子[起始浓度为
 ]形成氢氧化物沉淀的
]形成氢氧化物沉淀的 范围如表:
范围如表:| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有
 和
和(2)“氧化”中添加适量的
 的作用是将
的作用是将 氧化为
氧化为 ,写出该反应的离子方程式为
,写出该反应的离子方程式为(3)调
 范围为4.7~6,滤渣2成分的化学式为
范围为4.7~6,滤渣2成分的化学式为(4)“除杂1”的目的是除去
 和
和 ,“滤渣3”的主要成分是
,“滤渣3”的主要成分是(5)“除杂2”的目的是生成
 沉淀除去
沉淀除去 。若溶液酸度过高,
。若溶液酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是(6)写出“沉锰”的离子方程式
您最近一年使用:0次



