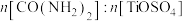解题方法
1 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含 、
、 、
、 、
、 、
、 、
、 等元素的氧化物)制备,工艺如图所示。回答下列问题:
等元素的氧化物)制备,工艺如图所示。回答下列问题:

相关金属离子[起始浓度为 ]形成氢氧化物沉淀的
]形成氢氧化物沉淀的 范围如表:
范围如表:
(1)“滤渣1”含有 和
和___________ 。
(2)“氧化”中添加适量的 的作用是将
的作用是将 氧化为
氧化为 ,写出该反应的离子方程式为
,写出该反应的离子方程式为___________ 。
(3)调 范围为4.7~6,滤渣2成分的化学式为
范围为4.7~6,滤渣2成分的化学式为___________ 。
(4)“除杂1”的目的是除去 和
和 ,“滤渣3”的主要成分是
,“滤渣3”的主要成分是___________ 。
(5)“除杂2”的目的是生成 沉淀除去
沉淀除去 。若溶液酸度过高,
。若溶液酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是___________ (从沉淀溶解平衡角度解释)。
(6)写出“沉锰”的离子方程式___________ 。
 、
、 、
、 、
、 、
、 、
、 等元素的氧化物)制备,工艺如图所示。回答下列问题:
等元素的氧化物)制备,工艺如图所示。回答下列问题:
相关金属离子[起始浓度为
 ]形成氢氧化物沉淀的
]形成氢氧化物沉淀的 范围如表:
范围如表:| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有
 和
和(2)“氧化”中添加适量的
 的作用是将
的作用是将 氧化为
氧化为 ,写出该反应的离子方程式为
,写出该反应的离子方程式为(3)调
 范围为4.7~6,滤渣2成分的化学式为
范围为4.7~6,滤渣2成分的化学式为(4)“除杂1”的目的是除去
 和
和 ,“滤渣3”的主要成分是
,“滤渣3”的主要成分是(5)“除杂2”的目的是生成
 沉淀除去
沉淀除去 。若溶液酸度过高,
。若溶液酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是(6)写出“沉锰”的离子方程式
您最近一年使用:0次
解题方法
2 . 胆矾和绿矾( )都是重要的化工试剂,某工厂废金属屑的主要成分为
)都是重要的化工试剂,某工厂废金属屑的主要成分为 、
、 和Al(含有少量
和Al(含有少量 和
和 )。某化学兴趣小组模拟工业生产设计如下实验流程,用该工厂的废金属屑制取氯化铝、绿矾晶体(
)。某化学兴趣小组模拟工业生产设计如下实验流程,用该工厂的废金属屑制取氯化铝、绿矾晶体( )和胆矾晶体,已知偏铝酸盐溶液能与
)和胆矾晶体,已知偏铝酸盐溶液能与 反应生成氢氧化铝沉淀。
反应生成氢氧化铝沉淀。

回答下列问题:
(1)胆矾的化学式为
(2)请写出试剂X和Y的化学式:X
(3)若向溶液C滴加盐酸有
 生成,则溶液C中溶质的主要成分
生成,则溶液C中溶质的主要成分(4)写出C中主要溶质滴加盐酸发生反应的离子方程式
(5)某酸性工业废水中含有的重铬酸根离子(
 )有毒,必须处理达标后才能排放。工业上常用绿矾做处理剂,还原产物为
)有毒,必须处理达标后才能排放。工业上常用绿矾做处理剂,还原产物为 ,该反应的离子方程式为
,该反应的离子方程式为 的酸性重铬酸钾溶液,消耗该溶液80
的酸性重铬酸钾溶液,消耗该溶液80 ,则所制绿矾中铁元素的质量分数为
,则所制绿矾中铁元素的质量分数为
您最近一年使用:0次
解题方法
3 . “海水提碘”的实验中,提取后;可用“反萃取法”萃取、富集碘单质,试剂常用 ,实验步骤,已知:
,实验步骤,已知: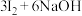 (浓)
(浓)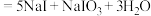 ;酸性条件下
;酸性条件下 和
和 发生归中反应。下面说法错误的是
发生归中反应。下面说法错误的是
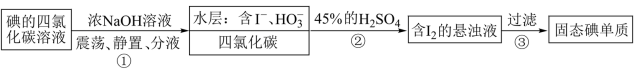
| A.步骤①不可以用酒精作萃取剂 |
| B.分液时有机层从分液漏斗下口放出 |
C.步骤②中发生反应的离子方程式为 |
| D.步骤⑤操作中需要的玻璃仪器为漏斗、烧杯和玻璃棒 |
您最近一年使用:0次
解题方法
4 . 以黄铁矿(主要成分FeS2)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如图所示。
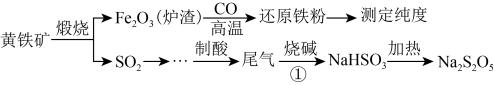
Na2S2O5:焦亚硫酸钠,白色粉末,水溶液显酸性,受潮易分解,遇强酸则放出一种刺激性气味的气体,是一种化工原料,常用作抗氧化剂。
(1)煅烧前,黄铁矿需要研磨,目的是_______ 。
(2)煅烧黄铁矿的化学方程式是_______ 。
(3)过程①中处理尾气SO2的离子反应方程式为_______ 。
(4)因为Na2S2O5具有_______ 性,导致商品Na2S2O5中不可避免地存在Na2SO4。检验其中含有SO 的方法是
的方法是______ 。
(5)一般用K2Cr2O7滴定分析法测定还原铁粉的纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K2Cr2O7溶液滴定其中的Fe2+。反应方程式为(方程式未配平):Cr2O +Fe2++H+→Cr3++Fe3++H2O。某次实验称取0.2800g样品,滴定时消耗浓度为0.0300mol/L的K2Cr2O7溶液25.00mL,则样品中铁的质量分数为
+Fe2++H+→Cr3++Fe3++H2O。某次实验称取0.2800g样品,滴定时消耗浓度为0.0300mol/L的K2Cr2O7溶液25.00mL,则样品中铁的质量分数为_______ 。

Na2S2O5:焦亚硫酸钠,白色粉末,水溶液显酸性,受潮易分解,遇强酸则放出一种刺激性气味的气体,是一种化工原料,常用作抗氧化剂。
(1)煅烧前,黄铁矿需要研磨,目的是
(2)煅烧黄铁矿的化学方程式是
(3)过程①中处理尾气SO2的离子反应方程式为
(4)因为Na2S2O5具有
 的方法是
的方法是(5)一般用K2Cr2O7滴定分析法测定还原铁粉的纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K2Cr2O7溶液滴定其中的Fe2+。反应方程式为(方程式未配平):Cr2O
 +Fe2++H+→Cr3++Fe3++H2O。某次实验称取0.2800g样品,滴定时消耗浓度为0.0300mol/L的K2Cr2O7溶液25.00mL,则样品中铁的质量分数为
+Fe2++H+→Cr3++Fe3++H2O。某次实验称取0.2800g样品,滴定时消耗浓度为0.0300mol/L的K2Cr2O7溶液25.00mL,则样品中铁的质量分数为
您最近一年使用:0次
解题方法
5 . 纳米磁性 在生物靶向材料、微波吸收材料及静电复印显影剂等方面都有极其广泛的用途。一种利用废旧镀锌铁皮制备纳米磁性
在生物靶向材料、微波吸收材料及静电复印显影剂等方面都有极其广泛的用途。一种利用废旧镀锌铁皮制备纳米磁性 的工艺流程如下(已知
的工艺流程如下(已知 ):
):

(1)将有油污的废旧镀锌铁皮“碱洗”的目的是去除废旧镀锌铁皮表面的油污和
(2)“酸溶”的离子方程式为
(3)“氧化”时发生的总反应的离子方程式为
(4)在酸性条件下,
 很容易发生如下反应:
很容易发生如下反应: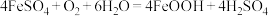 。为避免生成FeOOH影响产品纯度,则“氧化”时应选择的加料方式为
。为避免生成FeOOH影响产品纯度,则“氧化”时应选择的加料方式为a.将 溶液滴加到NaOH溶液中 b.将NaOH溶液滴加到
溶液滴加到NaOH溶液中 b.将NaOH溶液滴加到 溶液中
溶液中
(5)“氧化”时的温度不宜过低也不宜过高,原因是
(6)用激光笔照射“氧化”过程中所得分散系,可观察到的实验现象是
(7)证明分离出的
 纳米粒子是否洗涤干净的实验方法是
纳米粒子是否洗涤干净的实验方法是
您最近一年使用:0次
6 . 三氯化铬是有机金属化学中的重要原料,为紫色晶体,熔点为83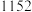 ℃,易潮解,高温下易被氧气氧化。实验室用
℃,易潮解,高温下易被氧气氧化。实验室用 和
和 加热到
加热到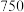 ℃时可制取
℃时可制取 ,同时还生成
,同时还生成 ,其装置图如下
,其装置图如下 加热及夹持装置略去
加热及夹持装置略去 ,请回答下列问题:
,请回答下列问题:
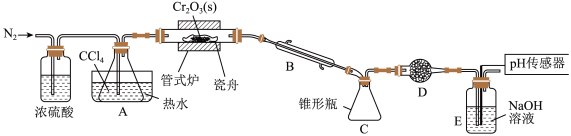
已知: 沸点
沸点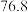 ℃;
℃; 有毒,沸点
有毒,沸点 ℃,遇水剧烈水解生成刺激性气味的气体。
℃,遇水剧烈水解生成刺激性气味的气体。
Ⅰ.制备 :
:
(1)仪器 的名称是
的名称是______ 。
(2)装置 、
、 的作用分别是
的作用分别是______ 、______ 。
(3)实验前先通入一段时间 的目的是
的目的是______ 。
(4)制备 的化学方程式为
的化学方程式为______ 。
(5)判断反应结束的依据是______ 。
Ⅱ.测定 纯度:
纯度:
称取 产品,在强碱性条件下,加入过量
产品,在强碱性条件下,加入过量 溶液,并小火加热,使
溶液,并小火加热,使 元素完全转化为
元素完全转化为 ;继续加热一段时间,冷却后配制成
;继续加热一段时间,冷却后配制成 溶液;取出
溶液;取出 ,滴加适量硫酸酸化后,用新配制的
,滴加适量硫酸酸化后,用新配制的 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液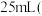 已知
已知 被
被 还原为
还原为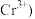 。
。
(6) 被
被 氧化成
氧化成 的离子方程式为
的离子方程式为______ 。
(7)产品中 的纯度为
的纯度为______  杂质不参与反应
杂质不参与反应 。
。
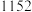 ℃,易潮解,高温下易被氧气氧化。实验室用
℃,易潮解,高温下易被氧气氧化。实验室用 和
和 加热到
加热到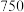 ℃时可制取
℃时可制取 ,同时还生成
,同时还生成 ,其装置图如下
,其装置图如下 加热及夹持装置略去
加热及夹持装置略去 ,请回答下列问题:
,请回答下列问题:
已知:
 沸点
沸点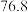 ℃;
℃; 有毒,沸点
有毒,沸点 ℃,遇水剧烈水解生成刺激性气味的气体。
℃,遇水剧烈水解生成刺激性气味的气体。Ⅰ.制备
 :
:(1)仪器
 的名称是
的名称是(2)装置
 、
、 的作用分别是
的作用分别是(3)实验前先通入一段时间
 的目的是
的目的是(4)制备
 的化学方程式为
的化学方程式为(5)判断反应结束的依据是
Ⅱ.测定
 纯度:
纯度:称取
 产品,在强碱性条件下,加入过量
产品,在强碱性条件下,加入过量 溶液,并小火加热,使
溶液,并小火加热,使 元素完全转化为
元素完全转化为 ;继续加热一段时间,冷却后配制成
;继续加热一段时间,冷却后配制成 溶液;取出
溶液;取出 ,滴加适量硫酸酸化后,用新配制的
,滴加适量硫酸酸化后,用新配制的 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液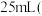 已知
已知 被
被 还原为
还原为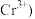 。
。(6)
 被
被 氧化成
氧化成 的离子方程式为
的离子方程式为(7)产品中
 的纯度为
的纯度为 杂质不参与反应
杂质不参与反应 。
。
您最近一年使用:0次
7 . 化学源于生活,她与我们生活息息相关。
Ⅰ.我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已略去)。
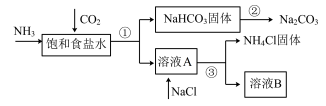
(1)①~③所涉及的操作方法中,包含过滤的是_______ (填序号)。
(2)根据上图,将化学方程式补充完整:
_______ 
_______ 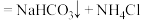
(3)煅烧 固体的化学方程式是
固体的化学方程式是_______ 。
(4)关于上述过程,下列说法中正确的是_______ (填字母)。
a. 不可循环使用
不可循环使用
b.副产物 可用作肥料
可用作肥料
c.反应过程中应先通入极易溶于水的 ,使溶液显碱性,然后再通入
,使溶液显碱性,然后再通入 气体
气体
Ⅱ.氧化还原反应是一类重要的化学反应,广泛应用于生产和生活中。
(5)氢化钠( )在野外被用作生氢剂,其原理是
)在野外被用作生氢剂,其原理是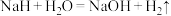 ,该反应中氧化剂是
,该反应中氧化剂是_______ ,还原剂是_______ ;被氧化与被还原元素的物质的量之比为:_______ 。
(6)某离子反应中涉及 、
、 、
、 、
、 、
、 、
、 六种微粒。其中
六种微粒。其中 、
、 的物质的量随时间变化的曲线如图所示。下列判断不正确的是
的物质的量随时间变化的曲线如图所示。下列判断不正确的是_______ 。
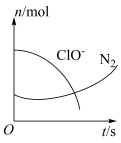
a.该反应的氧化剂是
b.消耗 还原剂,转移
还原剂,转移 电子
电子
c.氧化剂与还原剂的物质的量之比为
d.当生成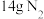 时,消耗的
时,消耗的 为
为
e.氧化性: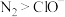
(7)高铁酸钠( ),易溶于水,是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。工业上制备高铁酸钠有多种方法。在次氯酸钠溶液中加入氢氧化钠和硫酸铁可制备高铁酸钠,此法被称为次氯酸盐氧化法。高铁酸钠(
),易溶于水,是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。工业上制备高铁酸钠有多种方法。在次氯酸钠溶液中加入氢氧化钠和硫酸铁可制备高铁酸钠,此法被称为次氯酸盐氧化法。高铁酸钠( )中铁元素的价态为
)中铁元素的价态为_______ ;写出制备高铁酸钠的离子方程式_______ 。
Ⅰ.我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已略去)。

(1)①~③所涉及的操作方法中,包含过滤的是
(2)根据上图,将化学方程式补充完整:


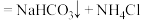
(3)煅烧
 固体的化学方程式是
固体的化学方程式是(4)关于上述过程,下列说法中正确的是
a.
 不可循环使用
不可循环使用b.副产物
 可用作肥料
可用作肥料c.反应过程中应先通入极易溶于水的
 ,使溶液显碱性,然后再通入
,使溶液显碱性,然后再通入 气体
气体Ⅱ.氧化还原反应是一类重要的化学反应,广泛应用于生产和生活中。
(5)氢化钠(
 )在野外被用作生氢剂,其原理是
)在野外被用作生氢剂,其原理是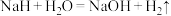 ,该反应中氧化剂是
,该反应中氧化剂是(6)某离子反应中涉及
 、
、 、
、 、
、 、
、 、
、 六种微粒。其中
六种微粒。其中 、
、 的物质的量随时间变化的曲线如图所示。下列判断不正确的是
的物质的量随时间变化的曲线如图所示。下列判断不正确的是
a.该反应的氧化剂是

b.消耗
 还原剂,转移
还原剂,转移 电子
电子c.氧化剂与还原剂的物质的量之比为

d.当生成
 时,消耗的
时,消耗的 为
为
e.氧化性:
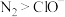
(7)高铁酸钠(
 ),易溶于水,是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。工业上制备高铁酸钠有多种方法。在次氯酸钠溶液中加入氢氧化钠和硫酸铁可制备高铁酸钠,此法被称为次氯酸盐氧化法。高铁酸钠(
),易溶于水,是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。工业上制备高铁酸钠有多种方法。在次氯酸钠溶液中加入氢氧化钠和硫酸铁可制备高铁酸钠,此法被称为次氯酸盐氧化法。高铁酸钠( )中铁元素的价态为
)中铁元素的价态为
您最近一年使用:0次
名校
解题方法
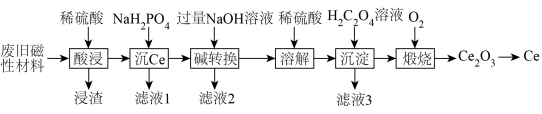
8 . 稀土金属(RE)属于战略性金属,我国的稀土提炼技术位于世界领先地位。一种从废旧磁性材料[主要成分为铈(Ce)、Al、Fe和少量不溶于酸的杂质]中回收稀土金属Ce的工艺流程如图所示。
(1)为提高酸浸的速率,可采取的措施为___________ (写一条即可)。
(2)常温下,“酸浸”后测得溶液中c(Fe2+)=1.0mol/L,c(Ce3+)=0.01mol/L,则“沉Ce”时,为了使Al3+完全沉淀,但不引人Fe(OH)2和Ce(OH)3,需要调节溶液的pH范围为___________ 。
(3)“碱转换”过程中Ce(H2PO4)所发生反应的离子方程式为___________ ,“滤液2”中铝元素的存在形式为___________ (填化学式)。
(4)“沉淀”后所得的固体为Ce2(C2O4)3·10H2O,将其煅烧可得Ce2O3和一种无毒的气体,发生反应的化学方程式为___________ 。
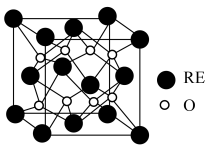
(5)某稀土金属氧化物的立方晶胞如图所示,则该氧化物的化学式为___________ ,距离RE原子最近的O原子有___________ 个。若M(晶胞)=Mg/mol,晶胞边长为anm,NA为阿伏加德罗常数的值,则晶胞的密度为___________ g/cm3(列出计算式)。
(1)为提高酸浸的速率,可采取的措施为
(2)常温下,“酸浸”后测得溶液中c(Fe2+)=1.0mol/L,c(Ce3+)=0.01mol/L,则“沉Ce”时,为了使Al3+完全沉淀,但不引人Fe(OH)2和Ce(OH)3,需要调节溶液的pH范围为
(3)“碱转换”过程中Ce(H2PO4)所发生反应的离子方程式为
(4)“沉淀”后所得的固体为Ce2(C2O4)3·10H2O,将其煅烧可得Ce2O3和一种无毒的气体,发生反应的化学方程式为
(5)某稀土金属氧化物的立方晶胞如图所示,则该氧化物的化学式为
您最近一年使用:0次
2024-03-31更新
|
1168次组卷
|
5卷引用:湖南省邵阳市邵东市创新高级中学2023-2024学年高三下学期第八次月考化学试题
湖南省邵阳市邵东市创新高级中学2023-2024学年高三下学期第八次月考化学试题2024届广东省肇庆市高三上学期二模化学试题(已下线)题型10 工艺流程题(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)化学(广东卷02)-2024年高考押题预测卷2024届广东省梅州市兴宁市第一中学高三下学期二模化学试题
9 . 硫酸是当今世界最重要的化工产品之一。
Ⅰ.硫酸的各种制法:
(1)早在1000多年前,我国就已采用加热胆矾( )或绿矾(
)或绿矾( )的方法制取硫酸。
)的方法制取硫酸。 受热分解的化学方程式:
受热分解的化学方程式: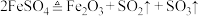 。
。
①将 受热产生的气体通入如图1装置中,以检验产生的气体中是否含有
受热产生的气体通入如图1装置中,以检验产生的气体中是否含有 和
和 。A装置盛装的试剂是
。A装置盛装的试剂是__________ 。


②有同学提出图1虚线框内盛装NaOH溶液的装置可以换成a装置,其中多孔玻璃球泡的作用是__________ 。
(2)目前工业上主要采用接触法制备硫酸。实验室模拟其中一步反应过程如图2装置,写出该过程反应的化学方程式__________ ,b装置中装有浓硫酸,其作用是__________ (填序号)。
a.干燥气体 b.使气体混合均匀 c.控制气流速度,调整气体比例

Ⅱ. 污染及治理
污染及治理
(3)模拟酸雨的形成原因。将 气体通入蒸馏水中,取出部分溶液并用pH计测定其pH,每隔10min读数一次,所得数据如下:
气体通入蒸馏水中,取出部分溶液并用pH计测定其pH,每隔10min读数一次,所得数据如下:
随着时间的推移,pH逐渐变小的原因是__________ (用化学方程式表示)。
(4)硫酸厂排放的废气中往往含有较多的 ,在400℃时,将一定比例
,在400℃时,将一定比例 和
和 的混合气体以一定流速通过装有
的混合气体以一定流速通过装有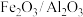 负载型催化剂(其中
负载型催化剂(其中 为催化剂,
为催化剂, 为载体)的反应器可消除
为载体)的反应器可消除 的污染,生成单质S。研究表明,该过程中实际起催化作用的是反应初期生成的
的污染,生成单质S。研究表明,该过程中实际起催化作用的是反应初期生成的 ,催化过程中检测到有
,催化过程中检测到有 。
。 催化的过程可描述如下:
催化的过程可描述如下:__________ ,最后S再与FeS反应转化为 。
。
(5)利用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫的过程如图所示:
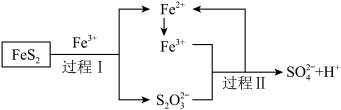
①已知催化脱硫过程的总反应为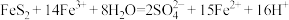 ,则过程Ⅱ反应的离子方程式为
,则过程Ⅱ反应的离子方程式为__________ 。
②从氧化还原角度分析,若要制备 应选择
应选择__________ (填字母)。
A. B.
B.
C. D.
D.
③工业上可用如下方法测定 的纯度:取40.0g样品溶于稀硫酸,加入足量KI溶液,再加入
的纯度:取40.0g样品溶于稀硫酸,加入足量KI溶液,再加入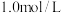 的
的 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液400mL。
溶液400mL。
相关反应: ;
; 。
。
该样品中 的质量分数为
的质量分数为__________ (假设杂质不参与反应)。
Ⅰ.硫酸的各种制法:
(1)早在1000多年前,我国就已采用加热胆矾(
 )或绿矾(
)或绿矾( )的方法制取硫酸。
)的方法制取硫酸。 受热分解的化学方程式:
受热分解的化学方程式: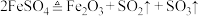 。
。①将
 受热产生的气体通入如图1装置中,以检验产生的气体中是否含有
受热产生的气体通入如图1装置中,以检验产生的气体中是否含有 和
和 。A装置盛装的试剂是
。A装置盛装的试剂是

②有同学提出图1虚线框内盛装NaOH溶液的装置可以换成a装置,其中多孔玻璃球泡的作用是
(2)目前工业上主要采用接触法制备硫酸。实验室模拟其中一步反应过程如图2装置,写出该过程反应的化学方程式
a.干燥气体 b.使气体混合均匀 c.控制气流速度,调整气体比例

Ⅱ.
 污染及治理
污染及治理(3)模拟酸雨的形成原因。将
 气体通入蒸馏水中,取出部分溶液并用pH计测定其pH,每隔10min读数一次,所得数据如下:
气体通入蒸馏水中,取出部分溶液并用pH计测定其pH,每隔10min读数一次,所得数据如下:时间(min) | 0 | 10 | 20 | 30 | 40 |
pH | 4.95 | 4.94 | 4.86 | 4.85 | 4.85 |
(4)硫酸厂排放的废气中往往含有较多的
 ,在400℃时,将一定比例
,在400℃时,将一定比例 和
和 的混合气体以一定流速通过装有
的混合气体以一定流速通过装有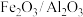 负载型催化剂(其中
负载型催化剂(其中 为催化剂,
为催化剂, 为载体)的反应器可消除
为载体)的反应器可消除 的污染,生成单质S。研究表明,该过程中实际起催化作用的是反应初期生成的
的污染,生成单质S。研究表明,该过程中实际起催化作用的是反应初期生成的 ,催化过程中检测到有
,催化过程中检测到有 。
。 催化的过程可描述如下:
催化的过程可描述如下: 。
。(5)利用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫的过程如图所示:

①已知催化脱硫过程的总反应为
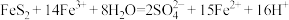 ,则过程Ⅱ反应的离子方程式为
,则过程Ⅱ反应的离子方程式为②从氧化还原角度分析,若要制备
 应选择
应选择A.
 B.
B.
C.
 D.
D.
③工业上可用如下方法测定
 的纯度:取40.0g样品溶于稀硫酸,加入足量KI溶液,再加入
的纯度:取40.0g样品溶于稀硫酸,加入足量KI溶液,再加入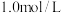 的
的 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液400mL。
溶液400mL。相关反应:
 ;
; 。
。该样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
10 . 纳米TiO2具有十分宝贵的光学性质,在汽车工业及诸多领域都显示出美好的发展前景。下图是以硫酸氧钛(TiOSO4)为原料制备纳米二氯化钛的工艺流程图:

已知:铵盐受热易分解。回答下列问题:
(1)反应1中发生两个反应,其一是尿素[ ]与
]与 反应生成
反应生成 和
和 ,则该反应的化学方程式为
,则该反应的化学方程式为__________ 。
(2)判断 沉淀是否洗净的实验操作和现象是
沉淀是否洗净的实验操作和现象是__________ 。
(3)为了减少制备过程中的“三废”排放,将上述流程中的“滤液”经过(填基本操作)__________ 、__________ 、过滤洗涤、干燥即可回收__________ (填化学式)。
(4)为研究反应温度、反应时间、反应物物质的量配比等因素对制备纳米 产率的影响,设计如下实验。
产率的影响,设计如下实验。
ⅰ.实验③中反应物物质的量配比为__________ 。
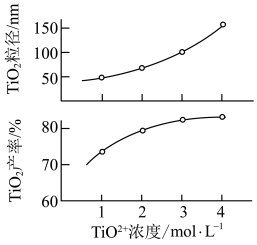
ⅱ.反应Ⅰ中 浓度对
浓度对 的产率和粒径的影响如图。结合图中信息,你认为为达到工艺目的,最合适的
的产率和粒径的影响如图。结合图中信息,你认为为达到工艺目的,最合适的 浓度为
浓度为__________ 。

已知:铵盐受热易分解。回答下列问题:
(1)反应1中发生两个反应,其一是尿素[
 ]与
]与 反应生成
反应生成 和
和 ,则该反应的化学方程式为
,则该反应的化学方程式为(2)判断
 沉淀是否洗净的实验操作和现象是
沉淀是否洗净的实验操作和现象是(3)为了减少制备过程中的“三废”排放,将上述流程中的“滤液”经过(填基本操作)
(4)为研究反应温度、反应时间、反应物物质的量配比等因素对制备纳米
 产率的影响,设计如下实验。
产率的影响,设计如下实验。实验编号 | 反应温度/℃ | 反应时间/h | 反应物物质的量配比 |
① | 90 | 1 | 2∶1 |
② | 90 | 2 | 3∶1 |
③ | 90 | 1 | |
④ | 110 | 2 | 3∶1 |
ⅱ.反应Ⅰ中
 浓度对
浓度对 的产率和粒径的影响如图。结合图中信息,你认为为达到工艺目的,最合适的
的产率和粒径的影响如图。结合图中信息,你认为为达到工艺目的,最合适的 浓度为
浓度为
您最近一年使用:0次