1 . (I)铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别 胶体和
胶体和 溶液的方法是
溶液的方法是__________ 。
(2)不仅溶液中 易被氧化成
易被氧化成 ,溶液中白色沉淀
,溶液中白色沉淀 更易被
更易被 氧化,请写出反应的化学方程式
氧化,请写出反应的化学方程式__________ ,现象为__________ 。
(3)绿矾( )是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。
)是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。
①为防止 溶液变质,应在溶液中加入少量
溶液变质,应在溶液中加入少量___________ 。
②甲同学取 稀硫酸酸化
稀硫酸酸化 溶液,加入几滴双氧水后,再加入1滴
溶液,加入几滴双氧水后,再加入1滴 溶液,溶液变红,说明
溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与双氧水反应的离子方程式为
溶液与双氧水反应的离子方程式为__________ 。乙同学认为甲同学的实验不够严谨,该组同学在 用稀
用稀 酸化的
酸化的 溶液中先加入
溶液中先加入 煤油,再于液面下依次加入几滴双氧水和1滴
煤油,再于液面下依次加入几滴双氧水和1滴 溶液,溶液变红,煤油的作用是
溶液,溶液变红,煤油的作用是__________ 。
(II)氯化铁溶液可用于腐蚀印刷电路板上的铜,某腐蚀后的废液中含有 和
和 ,且
,且 。
。
(4)从废液中可回收铜,并获得 溶液,设计如下方案:
溶液,设计如下方案:___________ (填物质名称)。
②物质X为___________ 。
A. B.酸性
B.酸性 溶液 C.
溶液 C.
(5)取该废液 并加入
并加入 铁粉,充分反应。
铁粉,充分反应。
①对反应后的溶液分析错误的是___________ 。
A.溶液中一定含有
B.若有固体剩余,则固体中一定含有铁
C.若溶液中有 ,则可能有固体析出
,则可能有固体析出
D.溶液若有 剩余,则一定没有固体析出
剩余,则一定没有固体析出
②若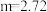 ,则充分反应后得到
,则充分反应后得到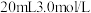 氯化亚铁溶液和
氯化亚铁溶液和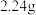 固体混合物。则原废液中
固体混合物。则原废液中 的物质的量浓度为
的物质的量浓度为___________ 。
(1)鉴别
 胶体和
胶体和 溶液的方法是
溶液的方法是(2)不仅溶液中
 易被氧化成
易被氧化成 ,溶液中白色沉淀
,溶液中白色沉淀 更易被
更易被 氧化,请写出反应的化学方程式
氧化,请写出反应的化学方程式(3)绿矾(
 )是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。
)是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。①为防止
 溶液变质,应在溶液中加入少量
溶液变质,应在溶液中加入少量②甲同学取
 稀硫酸酸化
稀硫酸酸化 溶液,加入几滴双氧水后,再加入1滴
溶液,加入几滴双氧水后,再加入1滴 溶液,溶液变红,说明
溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与双氧水反应的离子方程式为
溶液与双氧水反应的离子方程式为 用稀
用稀 酸化的
酸化的 溶液中先加入
溶液中先加入 煤油,再于液面下依次加入几滴双氧水和1滴
煤油,再于液面下依次加入几滴双氧水和1滴 溶液,溶液变红,煤油的作用是
溶液,溶液变红,煤油的作用是(II)氯化铁溶液可用于腐蚀印刷电路板上的铜,某腐蚀后的废液中含有
 和
和 ,且
,且 。
。(4)从废液中可回收铜,并获得
 溶液,设计如下方案:
溶液,设计如下方案: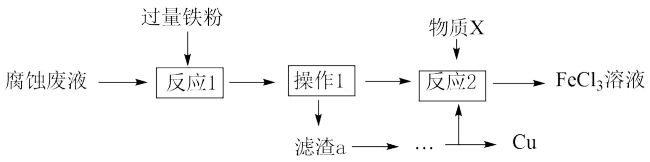
②物质X为
A.
 B.酸性
B.酸性 溶液 C.
溶液 C.
(5)取该废液
 并加入
并加入 铁粉,充分反应。
铁粉,充分反应。①对反应后的溶液分析错误的是
A.溶液中一定含有

B.若有固体剩余,则固体中一定含有铁
C.若溶液中有
 ,则可能有固体析出
,则可能有固体析出D.溶液若有
 剩余,则一定没有固体析出
剩余,则一定没有固体析出②若
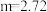 ,则充分反应后得到
,则充分反应后得到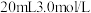 氯化亚铁溶液和
氯化亚铁溶液和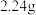 固体混合物。则原废液中
固体混合物。则原废液中 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
解题方法
2 . 某废水中主要含有Mn2+、Fe3+、Fe2+、Co2+、Ni2+以及 。某同学在实验室以该废水为原料制备金属M的工艺流程如下:
。某同学在实验室以该废水为原料制备金属M的工艺流程如下:
②Ksp[Fe(OH)3]=4.0×10-38,Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21。
回答下列问题:
(1)常温下,该废水的pH_____ (填“>”“=”或“<”)7。
(2)“氧化”时反应的离子方程式为_____ ,若用H2O2代替MnO2,则参加反应的n(H2O2)∶n(Fe2+)=_____ 。
(3)“调pH”时,若所得滤渣1为少量MnO2和另一种氢氧化物,应控制溶液pH的调节范围是_____ 。
(4)“除钴镍”时,发生的反应为 等。反应完全后的滤液中Mn2+与Ni2+的物质的量浓度之比是
等。反应完全后的滤液中Mn2+与Ni2+的物质的量浓度之比是_____ 。
(5)“电解”时,阳极电极反应式为_____ ;电解液可以返回“_____ ”(填工序名称)循环应用。
(6)25℃时pH=3的溶液中,Fe3+浓度的最大值为c(Fe3+)=_____ mol·L-1。
 。某同学在实验室以该废水为原料制备金属M的工艺流程如下:
。某同学在实验室以该废水为原料制备金属M的工艺流程如下:
| 氢氧化物 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 7.5 | 2.7 | 7.7 | 7.6 | 8.3 |
| 完全沉淀的pH | 7.5 | 3.7 | 8.4 | 8.2 | 9.8 |
回答下列问题:
(1)常温下,该废水的pH
(2)“氧化”时反应的离子方程式为
(3)“调pH”时,若所得滤渣1为少量MnO2和另一种氢氧化物,应控制溶液pH的调节范围是
(4)“除钴镍”时,发生的反应为
 等。反应完全后的滤液中Mn2+与Ni2+的物质的量浓度之比是
等。反应完全后的滤液中Mn2+与Ni2+的物质的量浓度之比是(5)“电解”时,阳极电极反应式为
(6)25℃时pH=3的溶液中,Fe3+浓度的最大值为c(Fe3+)=
您最近一年使用:0次
解题方法
3 . 现有部分元素的性质与原子或分子结构的相关信息如表所示:
(1)T、X、Y、Z形成的简单离子半径由大到小的顺序是______ 。(用离子符号表示)
(2)元素Y与元素Z相比,金属性较强的是_______ (用元素符号表示),下列表述中能证明这一事实的是_______ 填字母序号。
a.Y单质的熔点比Z单质的低
b.Y的化合价比Z的低
c.常温下Y单质与水反应的程度很剧烈,而Z单质在加热条件下才能与水反应
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中有两种元素能形成既含离子键又含非极性共价键的常见化合物,写出该化合物的化学式______ ,请指出元素T在周期表中的位置_______ 。
(4)元素X与氢元素以原子个数比1:2化合时,形成可用于火箭燃料的化合物W(W的相对分子质量为32),元素T和氢元素以原子个数比1:1化合形成化合物Q与W发生氧化还原反应生成X的单质和的T另一种氢化物,请写出Q与W反应的化学方程式______ 。
| 元素编号 | 元素性质与原子(或分子)结构的相关信息 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 其离子是第三周期金属元素的离子中半径最小的 |
(2)元素Y与元素Z相比,金属性较强的是
a.Y单质的熔点比Z单质的低
b.Y的化合价比Z的低
c.常温下Y单质与水反应的程度很剧烈,而Z单质在加热条件下才能与水反应
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中有两种元素能形成既含离子键又含非极性共价键的常见化合物,写出该化合物的化学式
(4)元素X与氢元素以原子个数比1:2化合时,形成可用于火箭燃料的化合物W(W的相对分子质量为32),元素T和氢元素以原子个数比1:1化合形成化合物Q与W发生氧化还原反应生成X的单质和的T另一种氢化物,请写出Q与W反应的化学方程式
您最近一年使用:0次
解题方法
4 . 二氯化二硫 用于橡胶的低温硫化剂和数接剂:冶金工业用作金、银等贵稀金属的萃取剂。以下是
用于橡胶的低温硫化剂和数接剂:冶金工业用作金、银等贵稀金属的萃取剂。以下是 的制备过程,请回答下列问题:
的制备过程,请回答下列问题:
已知:i. ,
, 。
。
ii.常温下, 是一种易挥发浅黄色的油状液体,在空气中可剧烈水解,产生白雾并伴有刺激性气味;2S2Cl2+2H2O=SO2↑+3S↓+4HCl。
是一种易挥发浅黄色的油状液体,在空气中可剧烈水解,产生白雾并伴有刺激性气味;2S2Cl2+2H2O=SO2↑+3S↓+4HCl。
iii.相关物质的熔沸点:
I. 的制备
的制备
如图所示:___________ ;A中反应的离子方程式为___________ ;装置B的试剂是___________ 。
(2)实验操作的先后顺序:
i.组装仪器并检验装置的气密性,加入药品。
ii.打开 ,通入氮气,通冷凝水,关闭
,通入氮气,通冷凝水,关闭___________ 。
iii.加热 中三颈烧瓶使硫黄熔化,滴加浓盐酸,继续加热装置C至
中三颈烧瓶使硫黄熔化,滴加浓盐酸,继续加热装置C至 。
。
iv.一段时间后停止滴加浓盐酸、关闭___________ ,打开K3,最后在D中收集到浅黄色液体。
(3)装置G的作用为___________ 。
(4)D装置中水浴温度应控制为___________ 。
II.侧定 产品的纯度。(杂质不参与反应)
产品的纯度。(杂质不参与反应)
(5)①向 样品中加入适量蒸馏水,加热蒸出全部气体,用足量的
样品中加入适量蒸馏水,加热蒸出全部气体,用足量的 溶液充分吸收、再用
溶液充分吸收、再用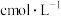 盐酸标准溶液以酚酞作指示剂(亚硫酸钠溶液
盐酸标准溶液以酚酞作指示剂(亚硫酸钠溶液 在指示剂变色范围内)滴定剩余的
在指示剂变色范围内)滴定剩余的 ,达到滴定终点时消耗盐酸溶液
,达到滴定终点时消耗盐酸溶液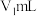 。
。
②做对照实验:不加样品,其余操作保持不变重复上述实验,达到滴定终点时消耗盐酸溶液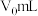 。样品纯度为
。样品纯度为___________ 。
 用于橡胶的低温硫化剂和数接剂:冶金工业用作金、银等贵稀金属的萃取剂。以下是
用于橡胶的低温硫化剂和数接剂:冶金工业用作金、银等贵稀金属的萃取剂。以下是 的制备过程,请回答下列问题:
的制备过程,请回答下列问题:已知:i.
 ,
, 。
。ii.常温下,
 是一种易挥发浅黄色的油状液体,在空气中可剧烈水解,产生白雾并伴有刺激性气味;2S2Cl2+2H2O=SO2↑+3S↓+4HCl。
是一种易挥发浅黄色的油状液体,在空气中可剧烈水解,产生白雾并伴有刺激性气味;2S2Cl2+2H2O=SO2↑+3S↓+4HCl。iii.相关物质的熔沸点:
| 物质 | S |  | 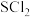 |
| 熔点/℃ | 112.8 | -77 | -121 |
| 沸点/℃ | 444.6 | 137 | 59 |
 的制备
的制备如图所示:

(2)实验操作的先后顺序:
i.组装仪器并检验装置的气密性,加入药品。
ii.打开
 ,通入氮气,通冷凝水,关闭
,通入氮气,通冷凝水,关闭iii.加热
 中三颈烧瓶使硫黄熔化,滴加浓盐酸,继续加热装置C至
中三颈烧瓶使硫黄熔化,滴加浓盐酸,继续加热装置C至 。
。iv.一段时间后停止滴加浓盐酸、关闭
(3)装置G的作用为
(4)D装置中水浴温度应控制为
II.侧定
 产品的纯度。(杂质不参与反应)
产品的纯度。(杂质不参与反应)(5)①向
 样品中加入适量蒸馏水,加热蒸出全部气体,用足量的
样品中加入适量蒸馏水,加热蒸出全部气体,用足量的 溶液充分吸收、再用
溶液充分吸收、再用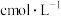 盐酸标准溶液以酚酞作指示剂(亚硫酸钠溶液
盐酸标准溶液以酚酞作指示剂(亚硫酸钠溶液 在指示剂变色范围内)滴定剩余的
在指示剂变色范围内)滴定剩余的 ,达到滴定终点时消耗盐酸溶液
,达到滴定终点时消耗盐酸溶液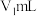 。
。②做对照实验:不加样品,其余操作保持不变重复上述实验,达到滴定终点时消耗盐酸溶液
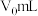 。样品纯度为
。样品纯度为
您最近一年使用:0次
名校
5 . 利用工业废气NO生产 的流程如图所示。已知装置Ⅰ和装置Ⅱ反应后溶液中
的流程如图所示。已知装置Ⅰ和装置Ⅱ反应后溶液中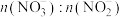 都为1∶1.下列说法错误的是
都为1∶1.下列说法错误的是
 的流程如图所示。已知装置Ⅰ和装置Ⅱ反应后溶液中
的流程如图所示。已知装置Ⅰ和装置Ⅱ反应后溶液中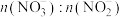 都为1∶1.下列说法错误的是
都为1∶1.下列说法错误的是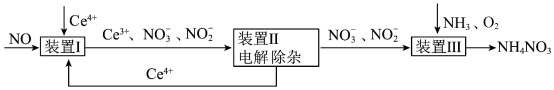
| A.装置江中若有5.6L(标准状况)NO参与反应,则转移1mol电子 |
B.装置Ⅰ中反应为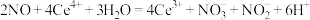 |
| C.装置Ⅲ中氧化剂和还原剂的物质的量之比为1∶2 |
D.装置Ⅲ中 和 和 的体积比3∶1时,可实现原子利用率最大化 的体积比3∶1时,可实现原子利用率最大化 |
您最近一年使用:0次
2024-04-10更新
|
105次组卷
|
2卷引用:山东省青岛第二中学2023-2024学年高一上学期第二次月考化学试卷
6 .  是一种高效、安全的消毒剂。实验室制备
是一种高效、安全的消毒剂。实验室制备 的原理是用亚氯酸钠固体与纯净、干燥的氯气反应:
的原理是用亚氯酸钠固体与纯净、干燥的氯气反应: 。如图1是实验室用于制备和收集一定量纯净的
。如图1是实验室用于制备和收集一定量纯净的 的装置(部分夹持装置已省略)。
的装置(部分夹持装置已省略)。
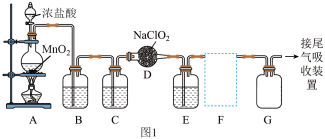
(1)圆底烧瓶中发生反应的化学方程式为___________ ,在该反应中浓盐酸表现的性质是___________ (填序号)。
a.只有还原性 b.还原性和酸性 c.只有氧化性 d.氧化性和酸性
(2)实验中相关气体在不同溶剂中的溶解性如表所示。
B、C、E装置中的试剂依次是___________ (填序号,下同)、___________ 、___________ 。
a.NaOH溶液 b.浓硫酸 c.饱和食盐水 d.CCl4 e.饱和石灰水
(3)如图2是一些常用的气体收集装置,F处应选用的收集装置是___________ (填序号),其中与E装置导管相连的导管口是___________ (填接口字母)。

(4) 泡腾片由
泡腾片由 、固体酸及辅助剂混合制得,是一种家用消毒用品。使用时只需将泡腾片放入水中,5~10分钟即可完全溶解并释放出
、固体酸及辅助剂混合制得,是一种家用消毒用品。使用时只需将泡腾片放入水中,5~10分钟即可完全溶解并释放出 。
。
① 泡腾片使用时需要加水,水的作用是
泡腾片使用时需要加水,水的作用是___________ 。
②补全泡腾片在水中发生反应的离子方程式:_______ ;
___________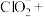 ___________
___________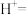 ___________
___________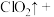 ___________+___________
___________+___________ 。
。
 是一种高效、安全的消毒剂。实验室制备
是一种高效、安全的消毒剂。实验室制备 的原理是用亚氯酸钠固体与纯净、干燥的氯气反应:
的原理是用亚氯酸钠固体与纯净、干燥的氯气反应: 。如图1是实验室用于制备和收集一定量纯净的
。如图1是实验室用于制备和收集一定量纯净的 的装置(部分夹持装置已省略)。
的装置(部分夹持装置已省略)。
(1)圆底烧瓶中发生反应的化学方程式为
a.只有还原性 b.还原性和酸性 c.只有氧化性 d.氧化性和酸性
(2)实验中相关气体在不同溶剂中的溶解性如表所示。
| ClO2 | Cl2 | HCl | |
| 水 | 极易溶 | 可溶 | 极易溶 |
| CCl4 | 难溶 | 易溶 | 难溶 |
a.NaOH溶液 b.浓硫酸 c.饱和食盐水 d.CCl4 e.饱和石灰水
(3)如图2是一些常用的气体收集装置,F处应选用的收集装置是

(4)
 泡腾片由
泡腾片由 、固体酸及辅助剂混合制得,是一种家用消毒用品。使用时只需将泡腾片放入水中,5~10分钟即可完全溶解并释放出
、固体酸及辅助剂混合制得,是一种家用消毒用品。使用时只需将泡腾片放入水中,5~10分钟即可完全溶解并释放出 。
。①
 泡腾片使用时需要加水,水的作用是
泡腾片使用时需要加水,水的作用是②补全泡腾片在水中发生反应的离子方程式:
___________
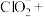 ___________
___________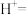 ___________
___________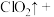 ___________+___________
___________+___________ 。
。
您最近一年使用:0次
7 . Cl2、SO2、CO2均是中学化学常见的气体,减少Cl2、SO2的排放可以防止污染空气,减少CO2的排放,有利于保护环境,实现碳中和。回答下列问题:
(1)化工厂可用浓氨水来检验Cl2是否泄漏,当有少量Cl2泄漏时,可以观察到的现象是________ 。
(2)用热烧碱溶液吸收Cl2反应后的混合溶液,若含NaCl、NaClO和NaClO3物质的量比值为n∶1∶2,则n=________ 。
(3)常温下,可用NaOH溶液作CO2的捕捉剂。若经测定某次捕捉所得溶液中,Na和C两种元素物质的量比值为3:1,则所得溶液中溶质成分为________ (填化学式)。
(4)①除品红外,鉴别SO2、CO2两种气体还可以采用________ (填试剂名称),SO2、Cl2均有漂白性,若将两者1∶1通入品红溶液中,不能使品红褪色,理由是________ (写离子方程式),除去SO2中的HCl可采用________ (填试剂名称)。
②用硫酸酸化的K2Cr2O7溶液处理SO2气体,会析出铬钾矾[KCr(SO4)2·12H2O]晶体。写出该反应的化学方程式:________ 。
(1)化工厂可用浓氨水来检验Cl2是否泄漏,当有少量Cl2泄漏时,可以观察到的现象是
(2)用热烧碱溶液吸收Cl2反应后的混合溶液,若含NaCl、NaClO和NaClO3物质的量比值为n∶1∶2,则n=
(3)常温下,可用NaOH溶液作CO2的捕捉剂。若经测定某次捕捉所得溶液中,Na和C两种元素物质的量比值为3:1,则所得溶液中溶质成分为
(4)①除品红外,鉴别SO2、CO2两种气体还可以采用
②用硫酸酸化的K2Cr2O7溶液处理SO2气体,会析出铬钾矾[KCr(SO4)2·12H2O]晶体。写出该反应的化学方程式:
您最近一年使用:0次
解题方法
8 . 某同学利用如图实验装置制备少量的漂白粉。回答下列问题:
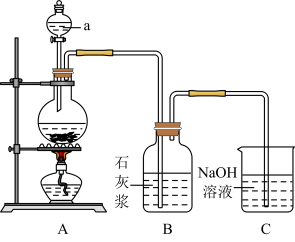
(1)漂白粉的有效成分是__________ (填名称);
(2)仪器a的名称是__________ 。装置A为实验室制取氯气的装置,其发生的化学方式为_______________ ;
(3)装置B中反应放热会使体系温度升高,导致氯气和石灰浆发生副反应产生Ca(ClO3)2,该副反应的化学方程式为______________ ;
(4)装置C的作用_________ ,装置C中发生反应的离子方程式为________ 。

(1)漂白粉的有效成分是
(2)仪器a的名称是
(3)装置B中反应放热会使体系温度升高,导致氯气和石灰浆发生副反应产生Ca(ClO3)2,该副反应的化学方程式为
(4)装置C的作用
您最近一年使用:0次
解题方法
9 . 利用硫酸烧渣(主要含Fe2O3、FeO,还含有SiO2和CuO等)来制取FeSO4溶液。
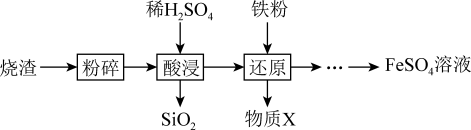
(1)“酸浸”时,Fe2O3发生反应的离子方程式是_______ 。
(2)“还原”时,铁粉将Fe3+、Cu2+还原为Fe2+和Cu。检验Fe3+是否已全部被还原,所选用试剂的化学式是______ 。
(3)实验室测定FeSO4溶液的浓度,常用K2Cr2O7标准溶液进行滴定。现称量2.940gK2Cr2O7(M=294g•mol-1)固体,配制成0.0100mol•L-1K2Cr2O7标准溶液。
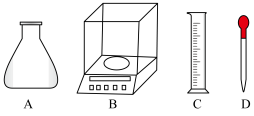
①称量时,需用到的仪器有_______ 。
②根据计算,选用的容量瓶规格应为______ 。
A.100mL B.250mL C.500mL D.1000mL
(4)将(2)得到的FeSO4溶液进行下列操作,测定其物质的量浓度:
步骤一:取10.00mLFeSO4溶液,将其稀释成100.00mL溶液。
步骤二:取25.00mL稀释后的溶液,向其中加入0.100mol•L-1酸性KMnO4溶液。恰好反应时,记下消耗KMnO4溶液的体积。
步骤三:重复上述实验3次,平均消耗KMnO4溶液20.00mL。
已知:MnO +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O
①“步骤一”中稀释时所用的水需先进行加热煮沸,其目的是_______ 。
②试通过计算,求原FeSO4溶液的物质的量浓度是多少_______ ?(写出计算过程)

(1)“酸浸”时,Fe2O3发生反应的离子方程式是
(2)“还原”时,铁粉将Fe3+、Cu2+还原为Fe2+和Cu。检验Fe3+是否已全部被还原,所选用试剂的化学式是
(3)实验室测定FeSO4溶液的浓度,常用K2Cr2O7标准溶液进行滴定。现称量2.940gK2Cr2O7(M=294g•mol-1)固体,配制成0.0100mol•L-1K2Cr2O7标准溶液。
①称量时,需用到的仪器有

②根据计算,选用的容量瓶规格应为
A.100mL B.250mL C.500mL D.1000mL
(4)将(2)得到的FeSO4溶液进行下列操作,测定其物质的量浓度:
步骤一:取10.00mLFeSO4溶液,将其稀释成100.00mL溶液。
步骤二:取25.00mL稀释后的溶液,向其中加入0.100mol•L-1酸性KMnO4溶液。恰好反应时,记下消耗KMnO4溶液的体积。
步骤三:重复上述实验3次,平均消耗KMnO4溶液20.00mL。
已知:MnO
 +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O①“步骤一”中稀释时所用的水需先进行加热煮沸,其目的是
②试通过计算,求原FeSO4溶液的物质的量浓度是多少
您最近一年使用:0次
解题方法
10 . I.物质间的转化在生产生活中有着广泛的应用。
A、B、C是中学化学常见的三种物质,它们的相互转化关系如图所示(部分反应条件及产物略去)。
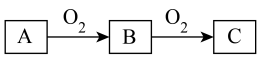
(1)若 是一种活泼金属,
是一种活泼金属, 是淡黄色固体,试用化学方程式表示该物质
是淡黄色固体,试用化学方程式表示该物质 的一个重要应用
的一个重要应用___________ 。将 长期露置于空气中,最后将变成物质
长期露置于空气中,最后将变成物质 的化学式为
的化学式为___________ 。现有 和
和 的固体混合物
的固体混合物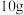 ,加热至质量不再改变,剩余固体质量为
,加热至质量不再改变,剩余固体质量为 的质量分数为
的质量分数为___________ 。
Ⅱ.金属及其化合物在生产生活中有着广泛的应用。
(2)胃舒平(主要成分为氢氧化铝)可用于治疗胃酸过多,氢氧化铝体现___________ 性;___________ (填“能”或“不能”)用氢氧化钠溶液代替。
(3)将 与稀硫酸混合不能反应,但滴入
与稀硫酸混合不能反应,但滴入 后,溶液很快变成蓝色,写出该反应的化学方程式
后,溶液很快变成蓝色,写出该反应的化学方程式___________ 。
(4)利用 溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀掉,从而制作印刷电路板的原理用离子方程式表示为
溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀掉,从而制作印刷电路板的原理用离子方程式表示为___________ 。
A、B、C是中学化学常见的三种物质,它们的相互转化关系如图所示(部分反应条件及产物略去)。

(1)若
 是一种活泼金属,
是一种活泼金属, 是淡黄色固体,试用化学方程式表示该物质
是淡黄色固体,试用化学方程式表示该物质 的一个重要应用
的一个重要应用 长期露置于空气中,最后将变成物质
长期露置于空气中,最后将变成物质 的化学式为
的化学式为 和
和 的固体混合物
的固体混合物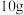 ,加热至质量不再改变,剩余固体质量为
,加热至质量不再改变,剩余固体质量为 的质量分数为
的质量分数为Ⅱ.金属及其化合物在生产生活中有着广泛的应用。
(2)胃舒平(主要成分为氢氧化铝)可用于治疗胃酸过多,氢氧化铝体现
(3)将
 与稀硫酸混合不能反应,但滴入
与稀硫酸混合不能反应,但滴入 后,溶液很快变成蓝色,写出该反应的化学方程式
后,溶液很快变成蓝色,写出该反应的化学方程式(4)利用
 溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀掉,从而制作印刷电路板的原理用离子方程式表示为
溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀掉,从而制作印刷电路板的原理用离子方程式表示为
您最近一年使用:0次



