用硝酸氧化蔗糖水解的产物可以制备草酸。实验过程如下:

①将蔗糖溶液与少许硫酸混合水浴加热;
②控制反应温度,边搅拌边缓慢滴加混酸(65% HNO3、98% H2SO4的混合溶液),装置如图1所示(加热、搅拌和仪器固定装置均已略去);
硝酸氧化蔗糖水解液过程中发生反应:C6H12O6+12HNO3 3H2C2O4+9NO2↑+3NO↑+9H2O
3H2C2O4+9NO2↑+3NO↑+9H2O
请回答下列问题:
(1)实验①加入少许硫酸的目的是___________ 。
(2)冷凝水进水方向是___________ 口(填“a”或“b”)。
(3)利用草酸晶体分解制备CO的原理为H2C2O4•xH2O CO↑+CO2↑+(x+1)H2O,欲获得纯净干燥的CO气体,应将分解气依次通过盛有
CO↑+CO2↑+(x+1)H2O,欲获得纯净干燥的CO气体,应将分解气依次通过盛有 ___________ 和 ___________ 的洗气瓶。
(4)将产品在90℃以下的恒温箱内烘干至恒重,得到二水合草酸。用酸性KMnO4标准溶液滴定,反应的离子方程式为2MnO +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。称取该样品0.12g,加适量水完全溶解,然后用0.020mol/L的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。称取该样品0.12g,加适量水完全溶解,然后用0.020mol/L的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为 ___________ 。滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为 ___________ 。

①将蔗糖溶液与少许硫酸混合水浴加热;
②控制反应温度,边搅拌边缓慢滴加混酸(65% HNO3、98% H2SO4的混合溶液),装置如图1所示(加热、搅拌和仪器固定装置均已略去);
硝酸氧化蔗糖水解液过程中发生反应:C6H12O6+12HNO3
 3H2C2O4+9NO2↑+3NO↑+9H2O
3H2C2O4+9NO2↑+3NO↑+9H2O请回答下列问题:
(1)实验①加入少许硫酸的目的是
(2)冷凝水进水方向是
(3)利用草酸晶体分解制备CO的原理为H2C2O4•xH2O
 CO↑+CO2↑+(x+1)H2O,欲获得纯净干燥的CO气体,应将分解气依次通过盛有
CO↑+CO2↑+(x+1)H2O,欲获得纯净干燥的CO气体,应将分解气依次通过盛有 (4)将产品在90℃以下的恒温箱内烘干至恒重,得到二水合草酸。用酸性KMnO4标准溶液滴定,反应的离子方程式为2MnO
 +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。称取该样品0.12g,加适量水完全溶解,然后用0.020mol/L的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。称取该样品0.12g,加适量水完全溶解,然后用0.020mol/L的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为
更新时间:2024-01-05 14:55:07
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】部分氯及铁的单质和化合物“价—类”图如下:

回答下列问题:
(1)d的电子式为___________ 。
(2)实验室采用固体和浓a溶液加热制备b,写出离子方程式:___________ ;在该反应中,氧化剂与还原剂的物质的量之比为___________ 。
(3)在酚酞溶液中滴加足量c的钠盐水溶液,观察到溶液先变红色后很快褪色,其原因是___________ (用离子方程式表示)。c的钠盐溶液中离子浓度大小排序为___________ 。
(4)f在空气中加热所得固体产物的化学式为___________ 。取少量i溶液于试管中,加入适量氢氧化钠溶液能观察到的现象是___________ ,将制得的g置于空气中生成h的化学方程式为___________ 。
(5)在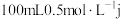 的氯化物水溶液中加入e,反应后的溶液中含浓度相等的2种金属离子(不考虑盐类水解),则溶解e的质量为
的氯化物水溶液中加入e,反应后的溶液中含浓度相等的2种金属离子(不考虑盐类水解),则溶解e的质量为___________ g。

回答下列问题:
(1)d的电子式为
(2)实验室采用固体和浓a溶液加热制备b,写出离子方程式:
(3)在酚酞溶液中滴加足量c的钠盐水溶液,观察到溶液先变红色后很快褪色,其原因是
(4)f在空气中加热所得固体产物的化学式为
(5)在
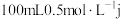 的氯化物水溶液中加入e,反应后的溶液中含浓度相等的2种金属离子(不考虑盐类水解),则溶解e的质量为
的氯化物水溶液中加入e,反应后的溶液中含浓度相等的2种金属离子(不考虑盐类水解),则溶解e的质量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】高纯 在光热发电领域应用广泛,部分生产方法及性质研究如下:
在光热发电领域应用广泛,部分生产方法及性质研究如下: 、NO、
、NO、 。请回答下列问题:
。请回答下列问题:
(1)方法I中,5℃时反应的离子方程式是________ 。写出溶液A中的所有离子:________ .
(2)KOH溶液吸收NO、 ,反应方程式如下:
,反应方程式如下:
i.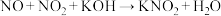 (未配平)
(未配平)
ii.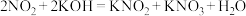
①配平并写出反应i的化学方程式:________ ;
②方法II中,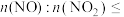
________ ,氮氧化物才能被足量的KOH溶液充分吸收。
(3)方法II中,“氧化吸收液”的目的是________ 。
(4)已知气体B是一种单质,则所得固体C为________ (填写化学式)。
(5)在某温度下, 分解得到的
分解得到的 可用于制备新型高效多功能水处理剂
可用于制备新型高效多功能水处理剂 。
。
①写出 与
与 、
、 共热制取
共热制取 的化学方程式:
的化学方程式:________ 。
② 水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性。请依据上述信息,设计检验沉淀中的金属元素的实验方案:
水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性。请依据上述信息,设计检验沉淀中的金属元素的实验方案:________ 。
 在光热发电领域应用广泛,部分生产方法及性质研究如下:
在光热发电领域应用广泛,部分生产方法及性质研究如下: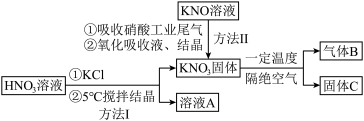
 、NO、
、NO、 。请回答下列问题:
。请回答下列问题:(1)方法I中,5℃时反应的离子方程式是
(2)KOH溶液吸收NO、
 ,反应方程式如下:
,反应方程式如下:i.
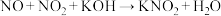 (未配平)
(未配平)ii.
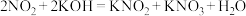
①配平并写出反应i的化学方程式:
②方法II中,
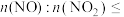
(3)方法II中,“氧化吸收液”的目的是
(4)已知气体B是一种单质,则所得固体C为
(5)在某温度下,
 分解得到的
分解得到的 可用于制备新型高效多功能水处理剂
可用于制备新型高效多功能水处理剂 。
。①写出
 与
与 、
、 共热制取
共热制取 的化学方程式:
的化学方程式:②
 水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性。请依据上述信息,设计检验沉淀中的金属元素的实验方案:
水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性。请依据上述信息,设计检验沉淀中的金属元素的实验方案:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
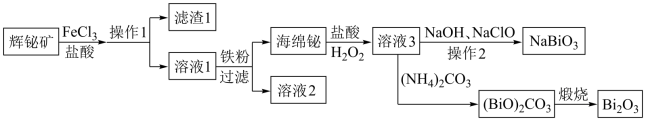
【推荐3】NaBiO3可作为钢铁分析中测定锰的氧化剂,Bi2O3在电子行业有着广泛应用,可利用浮选过的辉铋矿(主要成分是Bi2S3,还含少量SiO2等杂质)来制备。其工艺流程如下:
回答下列问题:
(1)辉铋矿的“浸出液”中铋元素主要以Bi3+形式存在,写出Bi2S3与FeCl3溶液反应的离子方程式:______ ,滤渣1的主要成分是__________ (填化学式)和硫。
(2)NaBiO3是为数不多的钠盐沉淀之一,由溶液3制得纯净的NaBiO3,操作2包括_____________ 。
(3)Bi2O3与Na2O2可在熔融状态下反应制得NaBiO3,其副产物的化学式为________________ 。
(4)写出“煅烧”中由碱式碳酸铋[(BiO)2CO3]制备Bi2O3的化学方程式:____________ 。
(5)某工厂用m1 kg辉铋矿(含Bi2S3 60%)制备NaBiO3,最终得到产品m2 kg,产率为__________ 。

回答下列问题:
(1)辉铋矿的“浸出液”中铋元素主要以Bi3+形式存在,写出Bi2S3与FeCl3溶液反应的离子方程式:
(2)NaBiO3是为数不多的钠盐沉淀之一,由溶液3制得纯净的NaBiO3,操作2包括
(3)Bi2O3与Na2O2可在熔融状态下反应制得NaBiO3,其副产物的化学式为
(4)写出“煅烧”中由碱式碳酸铋[(BiO)2CO3]制备Bi2O3的化学方程式:
(5)某工厂用m1 kg辉铋矿(含Bi2S3 60%)制备NaBiO3,最终得到产品m2 kg,产率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】用中和滴定的方法测定NaOH和Na2CO3的混合溶液中NaOH的含量,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全转变成BaCO3沉淀,然后用标准盐酸滴定。请回答:
(1)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,应选用___________ 指示剂,判断到达滴定终点的实验现象是___________ 。
(2)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol/L的盐酸标准液进行滴定,相关数据记录如下:
①实验3到达滴定终点时所耗HCl溶液的体积为___________ mL;依据表中数据,计算出烧碱样品中含NaOH的质量分数为___________ %。(小数点后保留两位数字)
②滴定时的正确操作是左手控制活塞,右手不断摇动锥形瓶,眼睛注视___________ 。
③下列操作会导致烧碱样品中NaOH含量测定值偏高的是___________ 。
A.锥形瓶用蒸馏水洗后未用待测液润洗 B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴定前有气泡,滴定后气泡消失 D.滴定前平视读数,滴定结束俯视读数
(1)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,应选用
(2)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol/L的盐酸标准液进行滴定,相关数据记录如下:
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.00 | 31.00 |
| 2 | 20.00 | 1.00 | 32.04 |
| 3 | 20.00 | 1.10 | 32.18 |
②滴定时的正确操作是左手控制活塞,右手不断摇动锥形瓶,眼睛注视
③下列操作会导致烧碱样品中NaOH含量测定值偏高的是
A.锥形瓶用蒸馏水洗后未用待测液润洗 B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴定前有气泡,滴定后气泡消失 D.滴定前平视读数,滴定结束俯视读数
您最近一年使用:0次
【推荐2】硫代硫酸钠可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S=Na2S2O3。常温下溶液中析出晶体为Na2S2O3⋅5H2O。Na2S2O3⋅5H2O于40〜45℃熔化,48℃分Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图1所示。

I.现按如下方法制备Na2S2O3⋅5H2O:将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按如图2示安装好装置。

(1)仪器2的名称为_______ ,装置6中可加入_______ 。
A.BaCl2溶液 B.浓 H2SO4 C.酸性KMnO4溶液 D.NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
①Na2CO3+SO2═Na2SO3+CO2
②Na2S+SO2+H2O═Na2SO3+H2S
③2H2S+SO2═3S↓+2H2O
④Na2SO3+ S Na2S2O3
Na2S2O3
总反应为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7的理由是:_______ (用文字和相关离子方程式表示)。
Ⅱ.分离Na2S2O3⋅5H2O并测定含量:

(3)从热的反应混合液中获得Na2S2O3·5H2O粗晶体,需经过下列实验步骤,请选择正确的选项:热的反应混合液→活性炭脱色并保温→_______ →获得Na2S2O3·5H2O粗晶体
a.用冰水浴冷却结晶,抽滤
b.用少量水洗涤晶体、烘干
c.80℃蒸发浓缩滤液至溶液表面出现晶膜
d.用乙醇洗涤晶体、晾干
e.45℃蒸发浓缩滤液至溶液呈微黄色浑浊
f.趁热过滤
制得的粗产品中往往含有少量杂质。为了测定粗产品中Na2S2O3⋅5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定杂质与酸性KMnO4溶液不反应)。称取1.28g粗样品溶于水,用0.40mol/LKMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O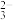 全部被氧化时,消耗KMnO4溶液20.00mL。产品中Na2S2O3⋅5H2O的质量分数为
全部被氧化时,消耗KMnO4溶液20.00mL。产品中Na2S2O3⋅5H2O的质量分数为_______ 。

I.现按如下方法制备Na2S2O3⋅5H2O:将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按如图2示安装好装置。

(1)仪器2的名称为
A.BaCl2溶液 B.浓 H2SO4 C.酸性KMnO4溶液 D.NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
①Na2CO3+SO2═Na2SO3+CO2
②Na2S+SO2+H2O═Na2SO3+H2S
③2H2S+SO2═3S↓+2H2O
④Na2SO3+ S
 Na2S2O3
Na2S2O3总反应为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7的理由是:
Ⅱ.分离Na2S2O3⋅5H2O并测定含量:

(3)从热的反应混合液中获得Na2S2O3·5H2O粗晶体,需经过下列实验步骤,请选择正确的选项:热的反应混合液→活性炭脱色并保温→
a.用冰水浴冷却结晶,抽滤
b.用少量水洗涤晶体、烘干
c.80℃蒸发浓缩滤液至溶液表面出现晶膜
d.用乙醇洗涤晶体、晾干
e.45℃蒸发浓缩滤液至溶液呈微黄色浑浊
f.趁热过滤
制得的粗产品中往往含有少量杂质。为了测定粗产品中Na2S2O3⋅5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定杂质与酸性KMnO4溶液不反应)。称取1.28g粗样品溶于水,用0.40mol/LKMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O
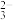 全部被氧化时,消耗KMnO4溶液20.00mL。产品中Na2S2O3⋅5H2O的质量分数为
全部被氧化时,消耗KMnO4溶液20.00mL。产品中Na2S2O3⋅5H2O的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用标准的酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0mL1.0×10-4mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式_______ 。
(2)标准液应装在_______ (酸式、碱式)滴定管中,判断滴定终点的方法是_______ 。
(3)计算:血液中含钙离子的浓度为_______ g·mL-1。
(4)滴定后读数时俯视,则测定结果_______ (偏高、偏低、没影响)
(1)写出用KMnO4滴定H2C2O4的离子方程式
(2)标准液应装在
(3)计算:血液中含钙离子的浓度为
(4)滴定后读数时俯视,则测定结果
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
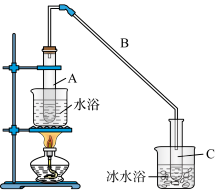
已知: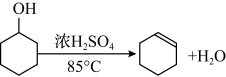
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_______ ,导管B的作用是_______ 。
②试管C置于冰水浴中的目的是_______ 。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。可以用_______ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置进行蒸馏,蒸馏时要加入生石灰,目的是_______ 。
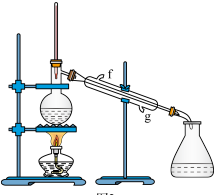

已知:

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是
②试管C置于冰水浴中的目的是
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。可以用
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置进行蒸馏,蒸馏时要加入生石灰,目的是

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
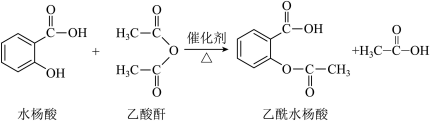
【推荐2】乙酰水杨酸(阿司匹林)是应用广泛的解热、镇痛和抗炎药,它对肠胃的刺激较小,在体内还具有抗血栓的作用,可用于预防心脑血管疾病,与青霉素、安定并称为“医药史上三大经典药物”。其合成原理如下:
(一)制备过程
①向100mL的三颈烧瓶中依次加入6.9g干燥的水杨酸、8.0mL新蒸的乙酸酐和0.5mL浓硫酸(作催化剂),磁力搅拌下,小心加热,控制温度在70℃左右反应30min。
②稍冷后,将反应液缓慢倒入100mL冰水中冷却15min,用图2装置减压抽滤,将所有产品收集到布氏漏斗中,滤饼用少量冷水多次洗涤,继续抽滤,得到乙酰水杨酸粗品。
(二)提纯过程
③将粗产品转移至100mL圆底烧瓶中,再加入20mL乙酸乙酯,加热溶解,如有不溶物出现,趁热过滤,热滤液置冰箱中冷却至-5℃~0℃,抽滤,洗涤,干燥,得无色晶体乙酰水杨酸,称重得4.50g。
回答下列问题:
(1)图2中“抽滤”操作相对于普通过滤的优点是_______ 。
(2)步骤①中加热操作宜采用_______ ,图1中仪器A的名称为_______ ,A的作用是防止外界的水蒸气进入三颈烧瓶导致发生副反应,降低水杨酸的转化率。写出该副反应的化学方程式_______ 。
(3)步骤②用冷水洗涤后,如何检验阿司匹林中是否还有杂质水杨酸剩余?_______ 。
(4)步骤③的提纯方法是_______ (写操作名称)。
(5)计算乙酰水杨酸(阿司匹林)的产率为_______ 。
| 物质 | 相对分子质量 | 密度/g/cm3 | 熔点/℃ | 其他性质 |
| 水杨酸 | 138 | 1.44 | 157~159 | 溶于乙醇、微溶于水 |
| 乙酸酐 | 102 | 1.08 | -72~-74 | 沸点140℃,无色透明液体,遇水形成乙酸 |
| 阿司匹林 | 180 | 1.35 | 135~138 | 分解温度为128~135℃,溶于乙醇、微溶于水 |
| 乙酸乙酯 | 88 | 0.90 | -87 | 沸点77℃,微溶于水,溶于乙醇等有机溶剂 |

(一)制备过程
①向100mL的三颈烧瓶中依次加入6.9g干燥的水杨酸、8.0mL新蒸的乙酸酐和0.5mL浓硫酸(作催化剂),磁力搅拌下,小心加热,控制温度在70℃左右反应30min。
②稍冷后,将反应液缓慢倒入100mL冰水中冷却15min,用图2装置减压抽滤,将所有产品收集到布氏漏斗中,滤饼用少量冷水多次洗涤,继续抽滤,得到乙酰水杨酸粗品。
(二)提纯过程
③将粗产品转移至100mL圆底烧瓶中,再加入20mL乙酸乙酯,加热溶解,如有不溶物出现,趁热过滤,热滤液置冰箱中冷却至-5℃~0℃,抽滤,洗涤,干燥,得无色晶体乙酰水杨酸,称重得4.50g。
回答下列问题:
(1)图2中“抽滤”操作相对于普通过滤的优点是
(2)步骤①中加热操作宜采用
(3)步骤②用冷水洗涤后,如何检验阿司匹林中是否还有杂质水杨酸剩余?
(4)步骤③的提纯方法是
(5)计算乙酰水杨酸(阿司匹林)的产率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O;CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质如表所示:
(1)仪器A中发生反应的化学方程式为:______ 。
(2)装置B中的试剂是______ ,若撤去装置B,可能导致装置D中副产物______ (填化学式)的量增加;装置D可采用______ 加热的方法控制反应温度在70℃左右。
(3)装置D中球形冷凝管的作用为______ 。写出E中所有可能发生的无机反应的离子方程式:______ 。
(4)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol·L-1碘标准溶液22.00mL,再加入适量Na2CO3溶液,待反应完全后,加盐酸调节溶液的pH,立即用0.02000mol·L-1Na2S2O3溶液滴定至终点。进行三次平行实验,测得消耗Na2S2O3溶液20.00mL。则产品的纯度为______ 。(计算结果保留三位有效数字)
滴定的反应原理:CCl3CHO+OH-=CHCl3+HCOO-;HCOO-+I2=H++2I-+CO2↑;I2+2S2O =2I-+S4O
=2I-+S4O 。
。
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O;CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质如表所示:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(2)装置B中的试剂是
(3)装置D中球形冷凝管的作用为
(4)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol·L-1碘标准溶液22.00mL,再加入适量Na2CO3溶液,待反应完全后,加盐酸调节溶液的pH,立即用0.02000mol·L-1Na2S2O3溶液滴定至终点。进行三次平行实验,测得消耗Na2S2O3溶液20.00mL。则产品的纯度为
滴定的反应原理:CCl3CHO+OH-=CHCl3+HCOO-;HCOO-+I2=H++2I-+CO2↑;I2+2S2O
 =2I-+S4O
=2I-+S4O 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某兴趣小组同学在实验室用加热1-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如图所示装置,其中夹持仪器、加热仪器及冷却水管没有画出。
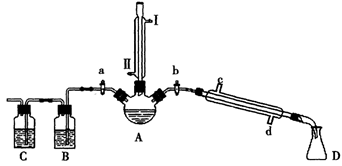
请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。
竖直冷凝管接通冷凝水,进水口是_____(填“I”或“Ⅱ”);冷凝回流的主要目的是________。
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等。熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。
B、C中应盛放的试剂分别是____和 ,写出C装置中主要的化学方程式:_________。
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
请你补充下列实验步骤,直到分离出1-溴丁烷。
①待烧瓶冷却后,拔去竖直的冷凝管;
②____;③_____;④_______;⑤_______,收集所得馏分。
(4)若实验中所取1-丁醇、NaBr分别为7.4 g、13.0 g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g1-溴丁烷,则1-溴丁烷的产率是_____。(保留2位有效数字)

请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。
竖直冷凝管接通冷凝水,进水口是_____(填“I”或“Ⅱ”);冷凝回流的主要目的是________。
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等。熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。
B、C中应盛放的试剂分别是____和 ,写出C装置中主要的化学方程式:_________。
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
请你补充下列实验步骤,直到分离出1-溴丁烷。
①待烧瓶冷却后,拔去竖直的冷凝管;
②____;③_____;④_______;⑤_______,收集所得馏分。
(4)若实验中所取1-丁醇、NaBr分别为7.4 g、13.0 g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g1-溴丁烷,则1-溴丁烷的产率是_____。(保留2位有效数字)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】钴是一种中等活泼金属,化合价为+2价和+3价,其中CoCl2易溶于水。某校同学设计实验制取(CH3COO)2Co(乙酸钴)并验证其分解产物。回答下列问题:
I.甲同学用Co2O3与盐酸反应制备CoCl2·4H2O,其实验装置如图:
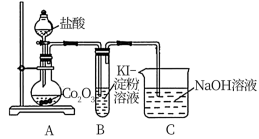
①烧瓶中发生反应的氧化剂和还原剂的物质的量之比为___________ 。
②装置B中的现象可以说明氧化性___________ >___________ ,从原子结构的角度解释___________ 。
II.乙同学利用甲同学制得的CoCl2·4H2O在醋酸氛围中制得无水(CH3COO)2Co,并利用下列装置检验(CH2COO)2Co在氮气气氛中的分解产物。已知PdCl2溶液能被CO还原为Pd。
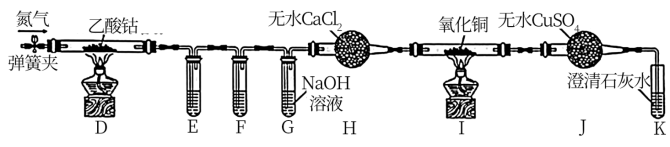
①装置E、F分别盛放___________ 和___________ 。
②E、F、G中的试剂均足量,观察到I中氧化铜变红,J中固体由白色变蓝色,K中石灰水变浑浊,则可得出的结论是___________ 。
③通入氮气的作用是___________ 。
I.甲同学用Co2O3与盐酸反应制备CoCl2·4H2O,其实验装置如图:

①烧瓶中发生反应的氧化剂和还原剂的物质的量之比为
②装置B中的现象可以说明氧化性
II.乙同学利用甲同学制得的CoCl2·4H2O在醋酸氛围中制得无水(CH3COO)2Co,并利用下列装置检验(CH2COO)2Co在氮气气氛中的分解产物。已知PdCl2溶液能被CO还原为Pd。

①装置E、F分别盛放
②E、F、G中的试剂均足量,观察到I中氧化铜变红,J中固体由白色变蓝色,K中石灰水变浑浊,则可得出的结论是
③通入氮气的作用是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
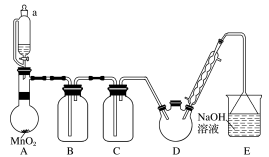
【推荐3】为了探究Cl2、 SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。
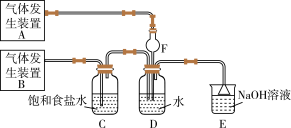
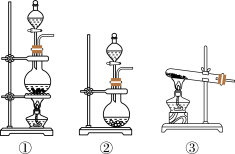
(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是______________ ;发生装置B应选择以下三种装置中的_____________ (填序号)。
(2) D装置中主要反应的离子方程式为_____________________________ 。
(3)为验证通入D装置中的气体是Cl2过量还是SO2过量,兴趣小组的同学准备了以下试剂:
①氯化铁溶液②氯化亚铁溶液 ③硫氰化钾溶液④酸性高锰酸钾溶液若Cl2过量,取适量D中溶液滴加至盛有______________ (选填一个序号)试剂的试管内,再加入________________ (选填一个序号)试剂。发生的现象是______________________ 。若SO2过量,取适量D中溶液滴加至盛有______________ (选填一个序 号)试剂的试管内,发生的现象是__________________________________________ 。

(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是

(2) D装置中主要反应的离子方程式为
(3)为验证通入D装置中的气体是Cl2过量还是SO2过量,兴趣小组的同学准备了以下试剂:
①氯化铁溶液②氯化亚铁溶液 ③硫氰化钾溶液④酸性高锰酸钾溶液若Cl2过量,取适量D中溶液滴加至盛有
您最近一年使用:0次



