1 . 城市污水中含有一定量的 、
、 ,向污水中加入菌体和
,向污水中加入菌体和 溶液,在菌体的作用下依次发生过程Ⅰ、过程Ⅱ,从而实现
溶液,在菌体的作用下依次发生过程Ⅰ、过程Ⅱ,从而实现 、
、 的脱除,其过程如图所示。下列说法正确的是
的脱除,其过程如图所示。下列说法正确的是
 、
、 ,向污水中加入菌体和
,向污水中加入菌体和 溶液,在菌体的作用下依次发生过程Ⅰ、过程Ⅱ,从而实现
溶液,在菌体的作用下依次发生过程Ⅰ、过程Ⅱ,从而实现 、
、 的脱除,其过程如图所示。下列说法正确的是
的脱除,其过程如图所示。下列说法正确的是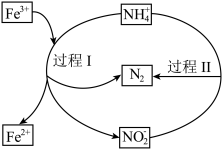
A.“过程Ⅰ”中 为催化剂 为催化剂 |
B. 的氧化性强于 的氧化性强于 |
C.“过程Ⅱ”中氧化产物和还原产物的质量之比为 |
D.“过程Ⅰ”中 和 和 的物质的量之比为 的物质的量之比为 ,则氧化剂与还原剂物质的量之比为 ,则氧化剂与还原剂物质的量之比为 |
您最近一年使用:0次
2023-09-23更新
|
600次组卷
|
10卷引用:山东省滨州市2023-2024学年高三上学期11月期中考试化学试题
山东省滨州市2023-2024学年高三上学期11月期中考试化学试题湘豫名校联考2023-2024学年高三上学期一轮诊断化学试题河南省信阳市信阳高级中学2024届高三上学期9月一模化学试题黑龙江省双鸭山市第一中学2023-2024学年高三上学期10月月考化学试题(已下线)选择题11-15湖南省湘西州吉首市2024届高三上学期第二届中小学生教师解题大赛化学试题江西省赣州市信丰中学2023-2024学年高一上学期11月月考化学试题河南省南阳市邓州市第一高级中学校2023-2024学年高一上学期期末考试化学试题(已下线)选择题6-10河南省洛阳市宜阳县第一高级中学2023-2024学年高一上学期(研学班)期末考试化学试卷
名校
解题方法
2 . 煤燃烧排放的烟气中含有 和
和 ,是大气的主要污染源之一。用
,是大气的主要污染源之一。用 溶液对烟气
溶液对烟气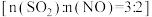 同时脱硫脱硝(分别生成
同时脱硫脱硝(分别生成 、
、 ,得到
,得到 、
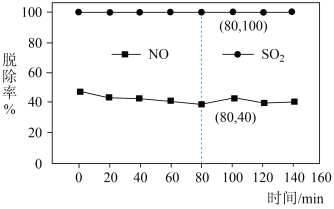
、 )脱除率如图,下列说法不正确的是
)脱除率如图,下列说法不正确的是
 和
和 ,是大气的主要污染源之一。用
,是大气的主要污染源之一。用 溶液对烟气
溶液对烟气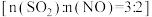 同时脱硫脱硝(分别生成
同时脱硫脱硝(分别生成 、
、 ,得到
,得到 、
、 )脱除率如图,下列说法不正确的是
)脱除率如图,下列说法不正确的是
A.脱除 的反应: 的反应: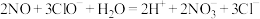 |
B.依据图中信息,在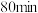 时,吸收液中 时,吸收液中 |
C. 脱除率高于 脱除率高于 的原因可能是 的原因可能是 在水中的溶解度大于 在水中的溶解度大于 |
D.随着脱除反应的进行,吸收剂溶液的 逐渐减小 逐渐减小 |
您最近一年使用:0次
2023-08-16更新
|
167次组卷
|
10卷引用:山东省滕州市2023-2024学年高三上学期期中考试化学试题
山东省滕州市2023-2024学年高三上学期期中考试化学试题山东省师范大学附属中学2021届高三上学期第二次考试化学试题黑龙江省齐齐哈尔市实验中学等3校2022-2023学年高三上学期11月期中考试化学试题北京大兴区2020届高三一模考试化学试题河南省三门峡市2021届高三10月阶段性考试化学试题辽宁省丹东市2021届高三上学期10月阶段测试化学试题黑龙江省大庆铁人、鸡西一中、鹤岗一中三校2021届高三上学期联考化学试题(已下线)专项特训2 非金属及其化合物对环境的影响河南省周口恒大中学2023-2024学年高一上学期10月月考化学试题北京市顺义区第一中学2023-2024学年高一下学期3月月考化学试题
名校
3 . 汽车尾气(含有碳氢化合物、CO、 和NO)等物质是造成城市空气污染的重要原因之一、研究汽车尾气的绿色排放具有重要意义。回答下列问题:
和NO)等物质是造成城市空气污染的重要原因之一、研究汽车尾气的绿色排放具有重要意义。回答下列问题:
(1)治理方法之一是在汽车的排气管上装“催化转化器”(用铂、钯合金作催化剂)。它的特点是使CO和NO反应,生成可参与大气循环的无毒气体,并使碳氢化合物充分燃烧及 的转化。
的转化。
①CO和NO反应的化学方程式为___________ 。
② 的转化过程在一定程度上提高了空气的酸度,其原因是
的转化过程在一定程度上提高了空气的酸度,其原因是___________ 。
(2)“稀薄燃烧”也是普遍采用的治理方法。“稀薄燃烧”是指汽油在较大空/燃比(空气与燃料气的体积比)条件下燃烧。但“稀薄燃烧”时,常用的汽车尾气净化装置不能有效地将 转化为
转化为 。不同空/燃比的汽车尾气中主要污染物的含量变化如图所示。
。不同空/燃比的汽车尾气中主要污染物的含量变化如图所示。

①“稀薄燃烧”技术除节约能源外,还具有的优点是___________ 。
②某探究小组同学按下列流程探究不同催化剂对 还原NO反应的催化性能。
还原NO反应的催化性能。
NO与 混合气体→催化反应器→检测→尾气处理
混合气体→催化反应器→检测→尾气处理
i.催化反应器中 与NO生成
与NO生成 ,当生成1mol
,当生成1mol 时,转移的电子数为
时,转移的电子数为___________ mol。
ii.控制其它实验条件相同,在催化转化器中装载不同催化剂,将催化反应后的混合气体按相同流量缓缓通入滴有酚酞的稀硫酸溶液中(溶液的体积和浓度相同)。为比较不同催化剂的催化性能,需要记录的实验数据是___________ 。
iii.实验发现当NO与 混合气体中混入一定量空气时,催化反应后的混合气体中NO的含量明显升高,NO的含量明显升高的原因是
混合气体中混入一定量空气时,催化反应后的混合气体中NO的含量明显升高,NO的含量明显升高的原因是___________ (用化学方程式表示)。
 和NO)等物质是造成城市空气污染的重要原因之一、研究汽车尾气的绿色排放具有重要意义。回答下列问题:
和NO)等物质是造成城市空气污染的重要原因之一、研究汽车尾气的绿色排放具有重要意义。回答下列问题:(1)治理方法之一是在汽车的排气管上装“催化转化器”(用铂、钯合金作催化剂)。它的特点是使CO和NO反应,生成可参与大气循环的无毒气体,并使碳氢化合物充分燃烧及
 的转化。
的转化。①CO和NO反应的化学方程式为
②
 的转化过程在一定程度上提高了空气的酸度,其原因是
的转化过程在一定程度上提高了空气的酸度,其原因是(2)“稀薄燃烧”也是普遍采用的治理方法。“稀薄燃烧”是指汽油在较大空/燃比(空气与燃料气的体积比)条件下燃烧。但“稀薄燃烧”时,常用的汽车尾气净化装置不能有效地将
 转化为
转化为 。不同空/燃比的汽车尾气中主要污染物的含量变化如图所示。
。不同空/燃比的汽车尾气中主要污染物的含量变化如图所示。
①“稀薄燃烧”技术除节约能源外,还具有的优点是
②某探究小组同学按下列流程探究不同催化剂对
 还原NO反应的催化性能。
还原NO反应的催化性能。NO与
 混合气体→催化反应器→检测→尾气处理
混合气体→催化反应器→检测→尾气处理i.催化反应器中
 与NO生成
与NO生成 ,当生成1mol
,当生成1mol 时,转移的电子数为
时,转移的电子数为ii.控制其它实验条件相同,在催化转化器中装载不同催化剂,将催化反应后的混合气体按相同流量缓缓通入滴有酚酞的稀硫酸溶液中(溶液的体积和浓度相同)。为比较不同催化剂的催化性能,需要记录的实验数据是
iii.实验发现当NO与
 混合气体中混入一定量空气时,催化反应后的混合气体中NO的含量明显升高,NO的含量明显升高的原因是
混合气体中混入一定量空气时,催化反应后的混合气体中NO的含量明显升高,NO的含量明显升高的原因是
您最近一年使用:0次
2023-07-17更新
|
188次组卷
|
2卷引用:山东省聊城市2022-2023学年高一下学期4月期中考试化学试题
解题方法
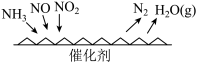
4 . 图示分析是学习化学重要手段之一,学习过程中常遇到各类“数形结合”问题。结合所给图示回答相关问题:
(1)从元素化合价和物质类别两个维度学习、研究物质的性质及转化,是一种行之有效的方法。下图是氮元素的“价类二维图”的部分信息。
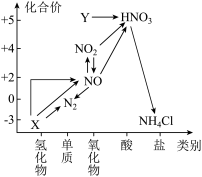
①X的电子式为___________ ;Y的化学式为___________ 。
②图中关于 转化为
转化为 的反应过程,下列说法不正确的是
的反应过程,下列说法不正确的是___________ 。
a.氮元素的化合价不发生变化
b.该转化过程中, 一定既是氧化剂,又是还原剂
一定既是氧化剂,又是还原剂
c.若用 与
与 反应制取
反应制取 ,可生成另一种产物
,可生成另一种产物
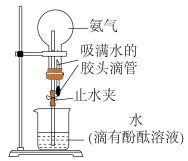
③下图为氨气水溶性的探究:利用如图所示的装置进行实验,欲观察的现象是___________ ;合理的验证操作为___________ 。
④ 和
和 在固氮酶的作用下转化为氨气,最后生成被植物吸收的
在固氮酶的作用下转化为氨气,最后生成被植物吸收的 ,其中固氮酶的作用是
,其中固氮酶的作用是___________ 。
(2) 、
、 和
和 是大气初期污染物的主要成分,
是大气初期污染物的主要成分, 催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示。当
催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示。当 与
与 的物质的量之比为1:1时,与足量氨气在一定条件下发生反应,该反应的化学方程式为
的物质的量之比为1:1时,与足量氨气在一定条件下发生反应,该反应的化学方程式为___________ 。
(3)研究表明硝酸与金属反应时,最容易生成亚硝酸( ,弱酸),然后才转化成
,弱酸),然后才转化成 ,如果溶液中存在更强的氧化剂,如过氧化氢,它完全有能力将新产生的亚硝酸再氧化成硝酸,如图为金属在不同浓度的
,如果溶液中存在更强的氧化剂,如过氧化氢,它完全有能力将新产生的亚硝酸再氧化成硝酸,如图为金属在不同浓度的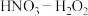 混合溶液中的溶解速率和生成
混合溶液中的溶解速率和生成 的体积V的变化示意图,请回答下列问题:
的体积V的变化示意图,请回答下列问题:

①最佳溶解金属的混合溶液中 的质量分数为
的质量分数为___________ ,理由是___________ 。
②过氧化氢与亚硝酸反应的化学方程式为___________ 。
(1)从元素化合价和物质类别两个维度学习、研究物质的性质及转化,是一种行之有效的方法。下图是氮元素的“价类二维图”的部分信息。

①X的电子式为
②图中关于
 转化为
转化为 的反应过程,下列说法不正确的是
的反应过程,下列说法不正确的是a.氮元素的化合价不发生变化
b.该转化过程中,
 一定既是氧化剂,又是还原剂
一定既是氧化剂,又是还原剂c.若用
 与
与 反应制取
反应制取 ,可生成另一种产物
,可生成另一种产物
③下图为氨气水溶性的探究:利用如图所示的装置进行实验,欲观察的现象是

④
 和
和 在固氮酶的作用下转化为氨气,最后生成被植物吸收的
在固氮酶的作用下转化为氨气,最后生成被植物吸收的 ,其中固氮酶的作用是
,其中固氮酶的作用是(2)
 、
、 和
和 是大气初期污染物的主要成分,
是大气初期污染物的主要成分, 催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示。当
催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示。当 与
与 的物质的量之比为1:1时,与足量氨气在一定条件下发生反应,该反应的化学方程式为
的物质的量之比为1:1时,与足量氨气在一定条件下发生反应,该反应的化学方程式为
(3)研究表明硝酸与金属反应时,最容易生成亚硝酸(
 ,弱酸),然后才转化成
,弱酸),然后才转化成 ,如果溶液中存在更强的氧化剂,如过氧化氢,它完全有能力将新产生的亚硝酸再氧化成硝酸,如图为金属在不同浓度的
,如果溶液中存在更强的氧化剂,如过氧化氢,它完全有能力将新产生的亚硝酸再氧化成硝酸,如图为金属在不同浓度的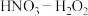 混合溶液中的溶解速率和生成
混合溶液中的溶解速率和生成 的体积V的变化示意图,请回答下列问题:
的体积V的变化示意图,请回答下列问题:
①最佳溶解金属的混合溶液中
 的质量分数为
的质量分数为②过氧化氢与亚硝酸反应的化学方程式为
您最近一年使用:0次
名校
5 . 物质的类别和核心元素的化合价是研究物质化学性质的两个重要角度。硫元素的价类二维图如图所示(其中h、g的阳离子均为 ),请回答下列问题:
),请回答下列问题:

(1)e的化学式是___________ 。
(2)实验室常用g和f的浓溶液制备气体c,写出其化学方程式___________ 。
(3)将气体c通入a的水溶液,溶液变浑浊,用化学方程式解释___________ ,体现了c的___________ 性。
(4)过量的铜与f的浓溶液在加热条件下可以发生,化学方程式为___________ ,反应后铜片有剩余,为使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如 溶液),则该反应的离子方程式为
溶液),则该反应的离子方程式为___________ 。
 ),请回答下列问题:
),请回答下列问题:
(1)e的化学式是
(2)实验室常用g和f的浓溶液制备气体c,写出其化学方程式
(3)将气体c通入a的水溶液,溶液变浑浊,用化学方程式解释
(4)过量的铜与f的浓溶液在加热条件下可以发生,化学方程式为
 溶液),则该反应的离子方程式为
溶液),则该反应的离子方程式为
您最近一年使用:0次
名校
6 . 实验室利用钴渣[含 、
、 等]制备
等]制备 的流程如图所示:
的流程如图所示:

已知: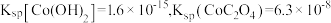
下列说法正确的是
 、
、 等]制备
等]制备 的流程如图所示:
的流程如图所示:
已知:
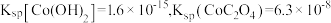
下列说法正确的是
A.“溶解还原”过程中得到的 与消耗的 与消耗的 物质的量之比为 物质的量之比为 |
B.“沉钴”时,不用 溶液是为了防止溶液碱性太强而生成 溶液是为了防止溶液碱性太强而生成 沉淀 沉淀 |
C.可以用氢氧化钠溶液检验 固体是否洗涤干净 固体是否洗涤干净 |
D.“焙烧”的方程式为 |
您最近一年使用:0次
2023-04-21更新
|
926次组卷
|
5卷引用:山东省济宁市兖州区2023-2024学年高三上学期期中考试化学试题
名校
解题方法
7 .  是一种重要的化工产品。以菱锰矿(主要成分为
是一种重要的化工产品。以菱锰矿(主要成分为 ,还含有
,还含有 、FeO、CoO等)为原料制备
、FeO、CoO等)为原料制备 的工艺流程如下图。
的工艺流程如下图。
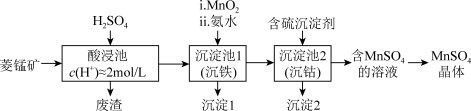
资料:金属离子沉淀的pH
(1)酸浸后所得溶液的金属阳离子包括 、
、 、
、_______ 。
(2)沉淀池1中,先加 充分反应后再加氨水,写出加
充分反应后再加氨水,写出加 时发生反应的离子方程式:
时发生反应的离子方程式:_______ 。
(3)沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是_______ 。
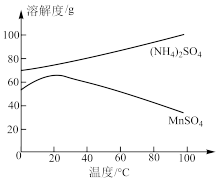
(4)图为 和
和 的溶解度曲线。从“含
的溶解度曲线。从“含 的溶液”中提取“
的溶液”中提取“ 晶体”的操作为
晶体”的操作为_______ 、洗涤、干燥。
(5)受实际条件限制,“酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下。
i.称取a g废渣,加酸将锰元素全部溶出成 ,过滤,将滤液定容于100mL容量瓶中;
,过滤,将滤液定容于100mL容量瓶中;
ii.取25.00 mL溶液于锥形瓶中,加入少量催化剂和过量 溶液,加热、充分反应后,煮沸溶液使过量的
溶液,加热、充分反应后,煮沸溶液使过量的 分解。
分解。
iii.加入指示剂,用b mol/L 溶液滴定,滴定至终点时消耗
溶液滴定,滴定至终点时消耗 溶液的体积为c mL ,
溶液的体积为c mL , 重新变成
重新变成 。
。
①补全步骤ⅱ中反应的离子方程式:_______ 。
 +
+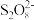 +_______
+_______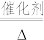
 +_______+_______
+_______+_______
②废渣中锰元素的质量分数为_______ 。
 是一种重要的化工产品。以菱锰矿(主要成分为
是一种重要的化工产品。以菱锰矿(主要成分为 ,还含有
,还含有 、FeO、CoO等)为原料制备
、FeO、CoO等)为原料制备 的工艺流程如下图。
的工艺流程如下图。
资料:金属离子沉淀的pH
| 金属离子 | Fe3+ | Fe2+ | Co2+ | Mn2+ |
| 开始沉淀 | 1.5 | 6.3 | 7.4 | 7.6 |
| 完全沉淀 | 2.8 | 8.3 | 9.4 | 10.2 |
 、
、 、
、(2)沉淀池1中,先加
 充分反应后再加氨水,写出加
充分反应后再加氨水,写出加 时发生反应的离子方程式:
时发生反应的离子方程式:(3)沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是
(4)图为
 和
和 的溶解度曲线。从“含
的溶解度曲线。从“含 的溶液”中提取“
的溶液”中提取“ 晶体”的操作为
晶体”的操作为
(5)受实际条件限制,“酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下。
i.称取a g废渣,加酸将锰元素全部溶出成
 ,过滤,将滤液定容于100mL容量瓶中;
,过滤,将滤液定容于100mL容量瓶中;ii.取25.00 mL溶液于锥形瓶中,加入少量催化剂和过量
 溶液,加热、充分反应后,煮沸溶液使过量的
溶液,加热、充分反应后,煮沸溶液使过量的 分解。
分解。iii.加入指示剂,用b mol/L
 溶液滴定,滴定至终点时消耗
溶液滴定,滴定至终点时消耗 溶液的体积为c mL ,
溶液的体积为c mL , 重新变成
重新变成 。
。①补全步骤ⅱ中反应的离子方程式:
 +
+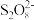 +_______
+_______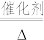
 +_______+_______
+_______+_______②废渣中锰元素的质量分数为
您最近一年使用:0次
2023-04-15更新
|
268次组卷
|
3卷引用: 山东省青岛第十七中学2020-2021学年高三下学期期中考试化学试题
8 . 氧钒碱式碳酸铵晶体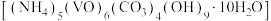 可用于制备热敏材料。以含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、有机物等)来制备氧钒碱式碳酸铵晶体的一种工艺流程如下:
可用于制备热敏材料。以含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、有机物等)来制备氧钒碱式碳酸铵晶体的一种工艺流程如下:

已知:含钒离子在溶液中的主要存在形式与溶液pH的关系:
(1)“焙烧”过程中除了 、
、 、
、 、
、 中的某些物质参加反应外,“焙烧”的另一个作用是
中的某些物质参加反应外,“焙烧”的另一个作用是_______ 。
(2)写出“焙烧”过程中生成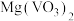 的化学方程式:
的化学方程式:_______ 。
(3)“调 ”的作用除了沉淀某些金属阳离子外,还有的作用是
”的作用除了沉淀某些金属阳离子外,还有的作用是_______ 。
(4)若“净化Ⅱ”加入过量的 ,可能导致的后果为
,可能导致的后果为_______ 。
(5)称量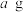 产品于锥形瓶中,先用
产品于锥形瓶中,先用 蒸馏水与
蒸馏水与 稀硫酸溶解后,再加入
稀硫酸溶解后,再加入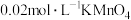 溶液至稍过量,充分反应后继续滴加1%的
溶液至稍过量,充分反应后继续滴加1%的 溶液至稍过量,再用尿素除去过量
溶液至稍过量,再用尿素除去过量 ,最后用
,最后用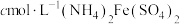 标准溶液滴定至终点,消耗标准溶液的体积为
标准溶液滴定至终点,消耗标准溶液的体积为 。(已知滴定反应为
。(已知滴定反应为 )
)
① 溶液的作用是
溶液的作用是_______ 。
②粗产品中钒的质量分数表达式为_______ (以 计)。
计)。
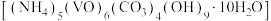 可用于制备热敏材料。以含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、有机物等)来制备氧钒碱式碳酸铵晶体的一种工艺流程如下:
可用于制备热敏材料。以含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、有机物等)来制备氧钒碱式碳酸铵晶体的一种工艺流程如下:
已知:含钒离子在溶液中的主要存在形式与溶液pH的关系:
| pH | 4~6 | 6~8 | 8~10 |
| 主要离子 |  |  | 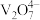 |
 、
、 、
、 、
、 中的某些物质参加反应外,“焙烧”的另一个作用是
中的某些物质参加反应外,“焙烧”的另一个作用是(2)写出“焙烧”过程中生成
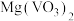 的化学方程式:
的化学方程式:(3)“调
 ”的作用除了沉淀某些金属阳离子外,还有的作用是
”的作用除了沉淀某些金属阳离子外,还有的作用是(4)若“净化Ⅱ”加入过量的
 ,可能导致的后果为
,可能导致的后果为(5)称量
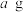 产品于锥形瓶中,先用
产品于锥形瓶中,先用 蒸馏水与
蒸馏水与 稀硫酸溶解后,再加入
稀硫酸溶解后,再加入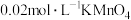 溶液至稍过量,充分反应后继续滴加1%的
溶液至稍过量,充分反应后继续滴加1%的 溶液至稍过量,再用尿素除去过量
溶液至稍过量,再用尿素除去过量 ,最后用
,最后用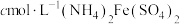 标准溶液滴定至终点,消耗标准溶液的体积为
标准溶液滴定至终点,消耗标准溶液的体积为 。(已知滴定反应为
。(已知滴定反应为 )
)①
 溶液的作用是
溶液的作用是②粗产品中钒的质量分数表达式为
 计)。
计)。
您最近一年使用:0次
2023-03-16更新
|
288次组卷
|
2卷引用:山东省青岛第二中学2022-2023学年高三上学期期中考试化学试题
名校
解题方法
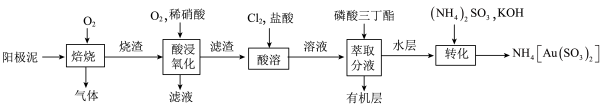
9 . 某化学兴趣小组通过查阅文献,设计了从阳极泥(成分为 、
、 、
、 、
、 )中回收贵重金属的工艺,其流程如图所示,已知:“酸溶”时Pt、Au分别转化为
)中回收贵重金属的工艺,其流程如图所示,已知:“酸溶”时Pt、Au分别转化为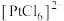 和
和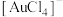 ,下列判断错误的是
,下列判断错误的是
 、
、 、
、 、
、 )中回收贵重金属的工艺,其流程如图所示,已知:“酸溶”时Pt、Au分别转化为
)中回收贵重金属的工艺,其流程如图所示,已知:“酸溶”时Pt、Au分别转化为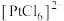 和
和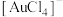 ,下列判断错误的是
,下列判断错误的是
A.“焙烧”时, 转化为 转化为 的反应中氧化剂与还原剂物质的量之比为1:2 的反应中氧化剂与还原剂物质的量之比为1:2 |
B.“酸浸氧化”时, 的作用之一是防止 的作用之一是防止 排放到空气中污染环境 排放到空气中污染环境 |
C.“酸溶”时,金溶解的离子方程式为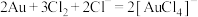 |
D.有机层中回收的金属元素是 ,萃取分液用到的玻璃仪器是漏斗和烧杯 ,萃取分液用到的玻璃仪器是漏斗和烧杯 |
您最近一年使用:0次
2023-03-16更新
|
641次组卷
|
7卷引用:山东省青岛第二中学2022-2023学年高三上学期期中考试化学试题
山东省青岛第二中学2022-2023学年高三上学期期中考试化学试题(已下线)山东省青岛市2023届高三下学期一模化学试题变式题(不定项选择题)江西省宜丰中学、宜春一中 2022-2023学年高二下学期4月期中联考化学试题(已下线)2023年高考山东卷化学真题变式题(不定项选择题)重庆市育才中学校2022届高三高考冲刺考试三化学试题(已下线)考点05 氧化还原反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点16 铜及其金属材料-备战2023年高考化学一轮复习考点帮(全国通用)
10 .  是一种可溶性盐,它能被常见的强氧化剂氧化。回答下列问题:
是一种可溶性盐,它能被常见的强氧化剂氧化。回答下列问题:
(1)金属加工后的废液中含有2%~5%的 ,它是一种环境污染物。人们用
,它是一种环境污染物。人们用 溶液来处理此废液,使亚硝酸钠转化为无毒物质。该反应分两步进行:
溶液来处理此废液,使亚硝酸钠转化为无毒物质。该反应分两步进行:
第一步: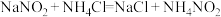
第二步: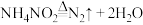
下列对上述反应的叙述中正确的是_______(填字母)。
①两步均为氧化还原反应 ②第二步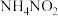 仅发生氧化反应 ③第二步
仅发生氧化反应 ③第二步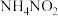 发生了分解反应 ④第二步中
发生了分解反应 ④第二步中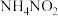 既被氧化又被还原 ⑤第一步为复分解反应
既被氧化又被还原 ⑤第一步为复分解反应
(2)实验室中,亚硝酸钠可用来处理过量的叠氮化钠,有关反应的化学方程式如下:
a.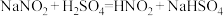
b.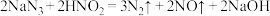
用单线桥法标出b反应中电子转移情况:_______ 。
(3) 、
、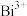 、
、 、
、 、
、 、
、 组成的一个氧化还原反应体系中,发生
组成的一个氧化还原反应体系中,发生 的反应过程。
的反应过程。
①该反应中,被氧化的元素是_______ (填元素符号),氧化剂是_______ (填离子符号)。
②将以上物质分别填入下面对应的横线上,并配平该反应:_______ 。
_______+_______+_______=_______+_______+_______ 。
。
 是一种可溶性盐,它能被常见的强氧化剂氧化。回答下列问题:
是一种可溶性盐,它能被常见的强氧化剂氧化。回答下列问题:(1)金属加工后的废液中含有2%~5%的
 ,它是一种环境污染物。人们用
,它是一种环境污染物。人们用 溶液来处理此废液,使亚硝酸钠转化为无毒物质。该反应分两步进行:
溶液来处理此废液,使亚硝酸钠转化为无毒物质。该反应分两步进行:第一步:
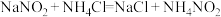
第二步:
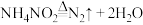
下列对上述反应的叙述中正确的是_______(填字母)。
①两步均为氧化还原反应 ②第二步
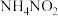 仅发生氧化反应 ③第二步
仅发生氧化反应 ③第二步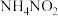 发生了分解反应 ④第二步中
发生了分解反应 ④第二步中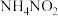 既被氧化又被还原 ⑤第一步为复分解反应
既被氧化又被还原 ⑤第一步为复分解反应| A.①③ | B.①④ | C.②③④ | D.③④⑤ |
a.
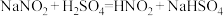
b.
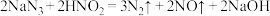
用单线桥法标出b反应中电子转移情况:
(3)
 、
、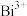 、
、 、
、 、
、 、
、 组成的一个氧化还原反应体系中,发生
组成的一个氧化还原反应体系中,发生 的反应过程。
的反应过程。①该反应中,被氧化的元素是
②将以上物质分别填入下面对应的横线上,并配平该反应:
_______+_______+_______=_______+_______+_______
 。
。
您最近一年使用:0次



