名校
解题方法
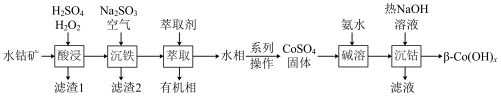
1 . 利用水钴矿(主要成分为 、
、 、FeO、
、FeO、 、
、 )制备二次电池添加剂
)制备二次电池添加剂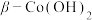 的流程如下。
的流程如下。
已知:i.沉淀过快无法形成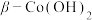 ,
, 在碱性溶液中易被
在碱性溶液中易被 氧化。
氧化。
ii.25℃时,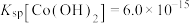 ,
, 的
的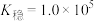 。
。
(1)“酸浸”中 与
与 、
、 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(2)“沉铁”中 被
被 与空气混合产生的
与空气混合产生的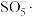 自由基氧化,
自由基氧化,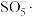 被还原为
被还原为_______ 。
(3)“萃取”可分离Co、Mn元素。下列物质可作萃取剂的是___________ 。(填标号)
A. B.
B. C.
C.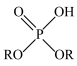
(4)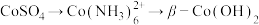 过程中:
过程中:
①“沉钴”中,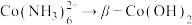 的离子方程式为
的离子方程式为___________ ,该反应的
___________ 。
②制备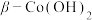 ,先加氨水再加NaOH溶液的理由是
,先加氨水再加NaOH溶液的理由是___________ 。
③“沉钴”中使用热NaOH溶液的目的是___________ 。
 、
、 、FeO、
、FeO、 、
、 )制备二次电池添加剂
)制备二次电池添加剂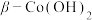 的流程如下。
的流程如下。
已知:i.沉淀过快无法形成
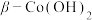 ,
, 在碱性溶液中易被
在碱性溶液中易被 氧化。
氧化。ii.25℃时,
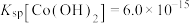 ,
, 的
的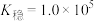 。
。(1)“酸浸”中
 与
与 、
、 发生反应的离子方程式为
发生反应的离子方程式为(2)“沉铁”中
 被
被 与空气混合产生的
与空气混合产生的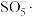 自由基氧化,
自由基氧化,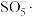 被还原为
被还原为(3)“萃取”可分离Co、Mn元素。下列物质可作萃取剂的是
A.
 B.
B. C.
C.
(4)
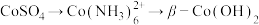 过程中:
过程中:①“沉钴”中,
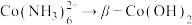 的离子方程式为
的离子方程式为
②制备
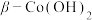 ,先加氨水再加NaOH溶液的理由是
,先加氨水再加NaOH溶液的理由是③“沉钴”中使用热NaOH溶液的目的是
您最近一年使用:0次
名校
2 .  气体是一种优良的消毒剂,常用于自来水的消毒。工业上常将
气体是一种优良的消毒剂,常用于自来水的消毒。工业上常将 制备成
制备成 固体以便运输和贮存,具体流程如图:
固体以便运输和贮存,具体流程如图:
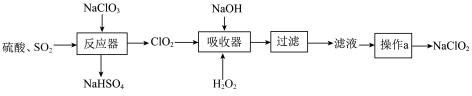
(1)反应器中发生反应的化学方程式为___________ 。
(2)吸收器中反应时有使带火星的木条复燃的气体产生,则 的作用为
的作用为___________ (填“氧化剂”或“还原剂”)。
(3)为了测定获得产品中 的纯度,进行如下实验:
的纯度,进行如下实验:
①准确称取2.000g上述产品,溶于水配成250.00mL的溶液。
②取25.00mL待测液,加入过量的KI溶液和 溶液发生如下反应:
溶液发生如下反应: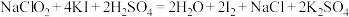 ,杂质不与KI反应。
,杂质不与KI反应。
③以淀粉作指示剂,再加入
 溶液;恰好完全反应时消耗
溶液;恰好完全反应时消耗 溶液的体积为40.00mL。已知:
溶液的体积为40.00mL。已知: )。
)。
计算该样品中 的纯度
的纯度___________ 。
(4)以 和稀盐酸为原料制备
和稀盐酸为原料制备 ,其原理如下:
,其原理如下: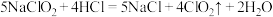 。当有1mol
。当有1mol 发生上述反应,转移电子的数目为
发生上述反应,转移电子的数目为___________ ,若盐酸浓度过大,则在上述过程中 会发生副反应产生
会发生副反应产生 。写出副反应的离子方程式
。写出副反应的离子方程式___________ 。
(5)“有效氯”的定义为:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力。则
的氧化能力。则 的“有效氯”为
的“有效氯”为___________ (保留两位小数)。
 气体是一种优良的消毒剂,常用于自来水的消毒。工业上常将
气体是一种优良的消毒剂,常用于自来水的消毒。工业上常将 制备成
制备成 固体以便运输和贮存,具体流程如图:
固体以便运输和贮存,具体流程如图:
(1)反应器中发生反应的化学方程式为
(2)吸收器中反应时有使带火星的木条复燃的气体产生,则
 的作用为
的作用为(3)为了测定获得产品中
 的纯度,进行如下实验:
的纯度,进行如下实验:①准确称取2.000g上述产品,溶于水配成250.00mL的溶液。
②取25.00mL待测液,加入过量的KI溶液和
 溶液发生如下反应:
溶液发生如下反应: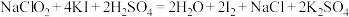 ,杂质不与KI反应。
,杂质不与KI反应。③以淀粉作指示剂,再加入

 溶液;恰好完全反应时消耗
溶液;恰好完全反应时消耗 溶液的体积为40.00mL。已知:
溶液的体积为40.00mL。已知: )。
)。计算该样品中
 的纯度
的纯度(4)以
 和稀盐酸为原料制备
和稀盐酸为原料制备 ,其原理如下:
,其原理如下: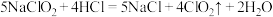 。当有1mol
。当有1mol 发生上述反应,转移电子的数目为
发生上述反应,转移电子的数目为 会发生副反应产生
会发生副反应产生 。写出副反应的离子方程式
。写出副反应的离子方程式(5)“有效氯”的定义为:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力。则
的氧化能力。则 的“有效氯”为
的“有效氯”为
您最近一年使用:0次
名校
3 . 有一包固体,可能含有镁粉、炭粉、氧化铜、氢氧化钠、氯化钾中的一种或几种。为探究固体的组成,某化学兴趣小组进行了如图所示实验:
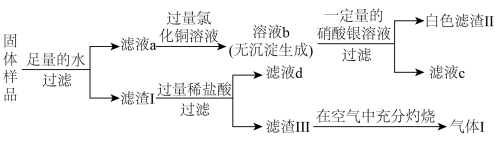
已知:①常温下,镁粉不与冷水反应;②滤液d的颜色为蓝色。
回答下列问题:
(1)滤渣Ⅲ的主要成分为___________ 。
(2)镁粉在氮气中燃烧生成 ,该物质能与水发生反应生成沉淀与气体,两种元素的化合价均不发生变化,写出
,该物质能与水发生反应生成沉淀与气体,两种元素的化合价均不发生变化,写出 与水发生反应的化学方程式为
与水发生反应的化学方程式为___________ 。
(3)由滤液a→溶液b可知,该固体中一定不含___________ (填化学式)。
(4)白色滤渣Ⅱ为________ (填名称)。能否据此判断该固体中含有氯化钾?_____ (填“能”或“不能”)。
(5)某金属氯化物 的摩尔质量为
的摩尔质量为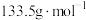 ,取该金属氯化物26.7g配成水汽液,与足量
,取该金属氯化物26.7g配成水汽液,与足量 溶液完全反应,生成86.1g白色沉淀。则金属M的摩尔质量为
溶液完全反应,生成86.1g白色沉淀。则金属M的摩尔质量为___________ 。

已知:①常温下,镁粉不与冷水反应;②滤液d的颜色为蓝色。
回答下列问题:
(1)滤渣Ⅲ的主要成分为
(2)镁粉在氮气中燃烧生成
 ,该物质能与水发生反应生成沉淀与气体,两种元素的化合价均不发生变化,写出
,该物质能与水发生反应生成沉淀与气体,两种元素的化合价均不发生变化,写出 与水发生反应的化学方程式为
与水发生反应的化学方程式为(3)由滤液a→溶液b可知,该固体中一定不含
(4)白色滤渣Ⅱ为
(5)某金属氯化物
 的摩尔质量为
的摩尔质量为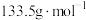 ,取该金属氯化物26.7g配成水汽液,与足量
,取该金属氯化物26.7g配成水汽液,与足量 溶液完全反应,生成86.1g白色沉淀。则金属M的摩尔质量为
溶液完全反应,生成86.1g白色沉淀。则金属M的摩尔质量为
您最近一年使用:0次
名校
解题方法
4 . 填空。
(1)有下列四个反应:
①SO3+H2O=H2SO4
②Cl2+H2O=HCl+HClO
③2F2+2H2O=4HF+O2
④SO2+2NaOH=Na2SO3+H2O
上述反应中不属于氧化还原反应的是___________ (填序号,下同);H2O只作还原剂的是___________ ;属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是___________ 。
(2)工业盐的主要成分是NaNO2,以前有许多起因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有___________ 性。下列不能实现这种转化的物质是___________ (填字母)。
a.酸性KMnO4溶液 b.FeCl3 c.O2 d.浓硫酸
(3)已知氧化性Fe3+>Cu2+>Fe2+,在溶有Fe2(SO4)3和CuSO4的溶液中加入一定量的铁粉,下列说法正确的是___________。(填字母)
(4)我国古代炼丹术中用的铅丹与硝酸反应方程式是:X(铅丹)+4HNO3=PbO2+2Pb(NO3)2+2H2O,则铅丹的化学式为___________ ,其中+2价的Pb和+4价的Pb含量之比为:___________ 。
(5)治理汽车尾气方法之一是在汽车的排气管上安装“催化转化器”,CO和NO可以转化为两种无毒的气体,写出化学方程式,用单线桥标出电子转移的方向和数目:___________ 。
(1)有下列四个反应:
①SO3+H2O=H2SO4
②Cl2+H2O=HCl+HClO
③2F2+2H2O=4HF+O2
④SO2+2NaOH=Na2SO3+H2O
上述反应中不属于氧化还原反应的是
(2)工业盐的主要成分是NaNO2,以前有许多起因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有
a.酸性KMnO4溶液 b.FeCl3 c.O2 d.浓硫酸
(3)已知氧化性Fe3+>Cu2+>Fe2+,在溶有Fe2(SO4)3和CuSO4的溶液中加入一定量的铁粉,下列说法正确的是___________。(填字母)
| A.若铁粉无剩余,且溶液中有Cu2+,则溶液中可能有Fe3+ |
| B.若铁粉无剩余,溶液中一定有Fe2+,一定无Cu2+ |
| C.若铁粉有剩余,则不溶物一定有铜 |
| D.若铁粉有剩余,则溶液中一定有Fe2+和Cu2+ |
(5)治理汽车尾气方法之一是在汽车的排气管上安装“催化转化器”,CO和NO可以转化为两种无毒的气体,写出化学方程式,用单线桥标出电子转移的方向和数目:
您最近一年使用:0次
名校
解题方法
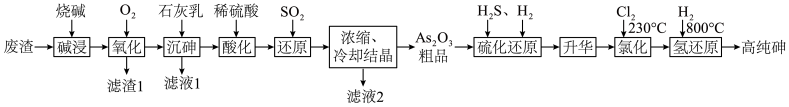
5 . 随着第三代半导体材料砷化镓、砷化铟的发展,使得高纯砷的需求量越来越大。用含砷废渣(主要成分为 )制备高纯砷工艺流程如图。
)制备高纯砷工艺流程如图。
已知:①砷的主要化合价有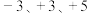 ;
;
②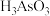 低温可分解;
低温可分解;
③砷与氯气在200~250℃时生成低价氯化物。
回答下列问题:
(1)“碱浸”发生的反应为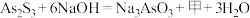 ,则甲的化学式为
,则甲的化学式为___________ 。
(2)“滤渣1”的主要成分为___________ 。
(3)“沉砷”生成 的最佳温度是85℃,温度过高,沉淀率却下降,原因为
的最佳温度是85℃,温度过高,沉淀率却下降,原因为___________ 。
(4)“还原”反应的离子方程式为___________ 。
(5)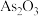 俗称砒霜,剧毒,法医学上鉴定砷的马氏试砷法是将试样与锌、盐酸混合,将生成的
俗称砒霜,剧毒,法医学上鉴定砷的马氏试砷法是将试样与锌、盐酸混合,将生成的 导入热玻璃管,分解,观察玻璃管壁是否有黑亮的“砷镜”生成,用反应的化学方程式解释该原理
导入热玻璃管,分解,观察玻璃管壁是否有黑亮的“砷镜”生成,用反应的化学方程式解释该原理___________ 。
(6)“氢还原”反应中氧化剂和还原剂的物质的量之比为___________ 。
(7)可循环利用的物质有___________ 。
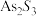 )制备高纯砷工艺流程如图。
)制备高纯砷工艺流程如图。
已知:①砷的主要化合价有
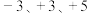 ;
;②
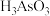 低温可分解;
低温可分解;③砷与氯气在200~250℃时生成低价氯化物。
回答下列问题:
(1)“碱浸”发生的反应为
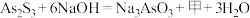 ,则甲的化学式为
,则甲的化学式为(2)“滤渣1”的主要成分为
(3)“沉砷”生成
 的最佳温度是85℃,温度过高,沉淀率却下降,原因为
的最佳温度是85℃,温度过高,沉淀率却下降,原因为(4)“还原”反应的离子方程式为
(5)
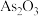 俗称砒霜,剧毒,法医学上鉴定砷的马氏试砷法是将试样与锌、盐酸混合,将生成的
俗称砒霜,剧毒,法医学上鉴定砷的马氏试砷法是将试样与锌、盐酸混合,将生成的 导入热玻璃管,分解,观察玻璃管壁是否有黑亮的“砷镜”生成,用反应的化学方程式解释该原理
导入热玻璃管,分解,观察玻璃管壁是否有黑亮的“砷镜”生成,用反应的化学方程式解释该原理(6)“氢还原”反应中氧化剂和还原剂的物质的量之比为
(7)可循环利用的物质有
您最近一年使用:0次
名校
解题方法
6 . 环烷酸镍主要用于顺丁橡胶和其他产品的有机合成催化剂。用废镍催化剂(主要含Ni、Al、Cr、Cu、FeS和有机物等)合成环烷酸镍的工艺流程如图。
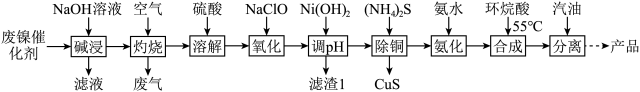
已知:溶液中金属离子沉淀开始和沉淀完全的 如表
如表
回答下列问题:
(1)“碱浸”发生反应的化学方程式为___________
(2)“灼烧”产生的废气主要有 、
、___________ 等。
(3)“溶解”时先加入一定量的水,然后分次加入浓硫酸,与直接用稀硫酸溶解相比,其优点是___________
(4)“氧化”反应的离子方程式为___________
(5)“滤渣1”的主要成分除 外,还有
外,还有___________ 。“调 ”时,当溶液中
”时,当溶液中 恰好沉淀完全时,
恰好沉淀完全时,  为
为___________  [已知金属离子c(Mn+)≤1×10-5mol/L时沉淀全完]。
[已知金属离子c(Mn+)≤1×10-5mol/L时沉淀全完]。
(6)“分离”时,加入汽油后将反应液分为两层,上层为含环烷酸镍的液体,下层为主要含___________ (填化学式)的液体,从上层液体中要得到环烷酸镍产品的分离方法为___________ 。

已知:溶液中金属离子沉淀开始和沉淀完全的
 如表
如表| 金属离子 |  |  |  |  |  |
沉淀开始的 | 7.0 | 1.8 | 6.2 | 5.4 | 4.5 |
沉淀完全的 | 9.0 | 3.2 | 8.6 | 6.7 | 5.6 |
(1)“碱浸”发生反应的化学方程式为
(2)“灼烧”产生的废气主要有
 、
、(3)“溶解”时先加入一定量的水,然后分次加入浓硫酸,与直接用稀硫酸溶解相比,其优点是
(4)“氧化”反应的离子方程式为
(5)“滤渣1”的主要成分除
 外,还有
外,还有 ”时,当溶液中
”时,当溶液中 恰好沉淀完全时,
恰好沉淀完全时,  为
为 [已知金属离子c(Mn+)≤1×10-5mol/L时沉淀全完]。
[已知金属离子c(Mn+)≤1×10-5mol/L时沉淀全完]。(6)“分离”时,加入汽油后将反应液分为两层,上层为含环烷酸镍的液体,下层为主要含
您最近一年使用:0次
名校
解题方法
7 . 物质的转化是化学研究的内容之一、回答下列问题:
Ⅰ.一种分解氯化铵( )实现产物分离的物质转化关系如下图所示(a、b、c、d分别代表相应的物质)。
)实现产物分离的物质转化关系如下图所示(a、b、c、d分别代表相应的物质)。

(1)上述转化过程中涉及的物质,除 外,属于盐的是
外,属于盐的是___________ 。(写物质的化学式)
(2)转化过程的总反应方程式为___________ 。
(3)上述转化过程有副产物 生成。请用化学方程式解释其原因
生成。请用化学方程式解释其原因___________ 。
Ⅱ.实验室常用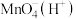 与
与 反应来测定
反应来测定 的浓度,其反应原理(转化过程)如图所示。
的浓度,其反应原理(转化过程)如图所示。
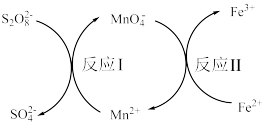
(4)反应Ⅰ中 是
是___________ (填“还原剂”或“氧化剂”)。发生反应Ⅰ时,溶液颜色变化是由无色到___________ 色。
(5)由反应Ⅰ、Ⅱ,判断 、
、 、
、 三者氧化性由强到弱的顺序为:
三者氧化性由强到弱的顺序为:___________ 。
(6)反应Ⅱ的离子方程式为___________ 。每有1mol 参加反应,转移
参加反应,转移___________ mol电子。
Ⅰ.一种分解氯化铵(
 )实现产物分离的物质转化关系如下图所示(a、b、c、d分别代表相应的物质)。
)实现产物分离的物质转化关系如下图所示(a、b、c、d分别代表相应的物质)。
(1)上述转化过程中涉及的物质,除
 外,属于盐的是
外,属于盐的是(2)转化过程的总反应方程式为
(3)上述转化过程有副产物
 生成。请用化学方程式解释其原因
生成。请用化学方程式解释其原因Ⅱ.实验室常用
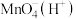 与
与 反应来测定
反应来测定 的浓度,其反应原理(转化过程)如图所示。
的浓度,其反应原理(转化过程)如图所示。
(4)反应Ⅰ中
 是
是(5)由反应Ⅰ、Ⅱ,判断
 、
、 、
、 三者氧化性由强到弱的顺序为:
三者氧化性由强到弱的顺序为:(6)反应Ⅱ的离子方程式为
 参加反应,转移
参加反应,转移
您最近一年使用:0次
名校
解题方法
8 . 如图为钠和氯的价类二维图,请据图完成下列问题:
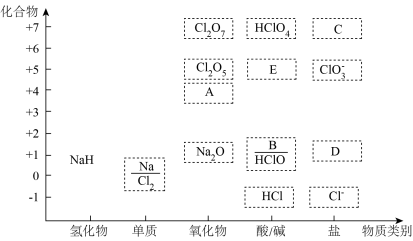
(1)NaH中的氢为___________ 价。可与水反应生成氢气,该反应中氧化产物和还原产物的质量比为___________ 。
(2)A是氯的氧化物,其化学式为___________ 。A可用于自来水消毒。其消毒效率是 的
的___________ 倍(还原产物都是 ,消毒效率以单位物质的量的物质得到的电子数表示)。
,消毒效率以单位物质的量的物质得到的电子数表示)。
(3)B属于碱,其水溶液与 反应生成D的离子方程式为
反应生成D的离子方程式为___________ 。
(4)C是高氯酸钠,受热分解可产生 和非含氧酸盐,则高氯酸钠热分解的化学方程式为
和非含氧酸盐,则高氯酸钠热分解的化学方程式为___________ 。
(5)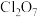 可与水反应生成
可与水反应生成 ,
, 生成E也是发生类似的反应,请写出
生成E也是发生类似的反应,请写出 与B在水中生成
与B在水中生成 的离子反应方程式
的离子反应方程式___________ 。

(1)NaH中的氢为
(2)A是氯的氧化物,其化学式为
 的
的 ,消毒效率以单位物质的量的物质得到的电子数表示)。
,消毒效率以单位物质的量的物质得到的电子数表示)。(3)B属于碱,其水溶液与
 反应生成D的离子方程式为
反应生成D的离子方程式为(4)C是高氯酸钠,受热分解可产生
 和非含氧酸盐,则高氯酸钠热分解的化学方程式为
和非含氧酸盐,则高氯酸钠热分解的化学方程式为(5)
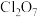 可与水反应生成
可与水反应生成 ,
, 生成E也是发生类似的反应,请写出
生成E也是发生类似的反应,请写出 与B在水中生成
与B在水中生成 的离子反应方程式
的离子反应方程式
您最近一年使用:0次
名校
解题方法
9 . 高铁酸钾是一种非氯高效消毒剂,主要用于饮用水处理。高铁酸钾(K2FeO4)在强碱性条件下能够稳定存在。工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入饱和的KOH,使高铁酸钾析出。反应:Fe(OH)3+ClO-+OH-—FeO +Cl-+H2O(未配平)
+Cl-+H2O(未配平)
(1)配平离子反应方程式:___________ 。
(2)若反应过程中转移了3mol电子,则还原产物的物质的量为___________ mol。
(3)用双线桥标出电子转移的方向和数目___________ 。
(4)向Na2FeO4溶液中加入适量饱和的KOH溶液,有K2FeO4析出,请写出该反应的化学方程式___________ 。
 +Cl-+H2O(未配平)
+Cl-+H2O(未配平)(1)配平离子反应方程式:
(2)若反应过程中转移了3mol电子,则还原产物的物质的量为
(3)用双线桥标出电子转移的方向和数目
(4)向Na2FeO4溶液中加入适量饱和的KOH溶液,有K2FeO4析出,请写出该反应的化学方程式
您最近一年使用:0次
10 . 根据下表信息,下列叙述中正确的是
| 序号 | 氧化剂 | 还原剂 | 氧化产物 | 还原产物 |
| ① |  (足量) (足量) |  |  | |
| ② |  |  |  |  |
| ③ |  | 浓盐酸 |  | |
| ④ |  | 浓盐酸 |  |  |
A.表中①反应的氧化产物只能有 |
B.表中②生成1个 将有4个电子转移 将有4个电子转移 |
C.表中④的离子方程式配平后, 的化学计量数为16 的化学计量数为16 |
| D.表中③还原产物是KCl |
您最近一年使用:0次



