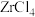1 . 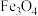 磁材料应用广泛,制备流程如图。下列说法错误的是
磁材料应用广泛,制备流程如图。下列说法错误的是
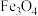 磁材料应用广泛,制备流程如图。下列说法错误的是
磁材料应用广泛,制备流程如图。下列说法错误的是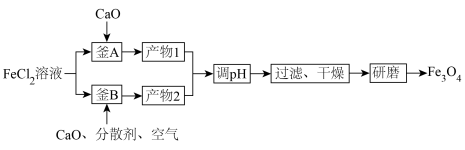
| A.“产物1”需要密封保存防止氧化 |
B.“釜B”中主要反应的化学方程式为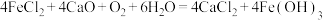 |
C.“产物1”与“产物2”中参与生成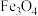 反应的物质的物质的量之比为2:1 反应的物质的物质的量之比为2:1 |
| D.“分散剂”可破坏形成的胶体来促进氧化 |
您最近半年使用:0次
2 . 以水钴矿(Co2O3·H2O,含Fe2O3、MgO、CaO)和辉铜矿(Cu2S,含SiO2、Fe2O3)为原料制取胆矾和单质钴。
①常温下,Ksp(MgF2)=6.25×10-9,Ksp(CaSO4)=7.1×10-7,Ksp(CoCO3)=2.4×10-7;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
③萃取Cu2+的反应原理;Cu2++2HR CuR2+2H+;
CuR2+2H+;
④Mg、Ca、Fe、Co均能与强酸反应产生H2。
回答下列问题:
(1)“酸浸”过程硫元素价态变为+6价,写出“酸浸”过程中主要反应的化学方程式:___________ 。
(2)“滤渣1”的主要成分为___________ 。
(3)常温下,“滤液1”中(Fe元素都以Fe3+形式存在)加“氧化铜”调pH不小于___________ 。
(4)常温下,若“滤液2”中c(Mg2+)=0.015mol/L(忽略溶液中极少量的Ca2+),除去2L“滤液2”中的Mg2+,至少需加入NaF固体的质量为___________ g(忽略溶液体积的变化)。
(5)“反萃取”步骤中加入的“试剂a”为___________ 。
(6)采用惰性电极电解CoCl2溶液﹑在无离子交换膜的条件下,不能用CoSO4溶液代替CoCl2溶液的理由是___________ 。
(7)将制得的胆矾配成溶液,先加入足量氨水,得到深蓝色溶液,再通入SO2至弱酸性,生成白色沉淀。经仪器分析:白色沉淀含H、N,O、S、Cu五种元素,且Cu∶N∶S=1∶4∶l;所含Cu离子中无单电子;晶体的部分组成微粒的空间构型分别为三角锥形和正四面体形。则白色沉淀的化学式为___________ 。
①常温下,Ksp(MgF2)=6.25×10-9,Ksp(CaSO4)=7.1×10-7,Ksp(CoCO3)=2.4×10-7;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 金属离子 | Fe3+ | Fe2+ | Co2+ | Cu2+ |
| 开始沉淀时(c=0.01mol/L)的pH | 2.7 | 7.5 | 7.6 | 4.7 |
| 完全沉淀时(c=10-5mol/L)的pH | 3.7 | 9.0 | 9.1 | 6.2 |
 CuR2+2H+;
CuR2+2H+;④Mg、Ca、Fe、Co均能与强酸反应产生H2。
回答下列问题:
(1)“酸浸”过程硫元素价态变为+6价,写出“酸浸”过程中主要反应的化学方程式:
(2)“滤渣1”的主要成分为
(3)常温下,“滤液1”中(Fe元素都以Fe3+形式存在)加“氧化铜”调pH不小于
(4)常温下,若“滤液2”中c(Mg2+)=0.015mol/L(忽略溶液中极少量的Ca2+),除去2L“滤液2”中的Mg2+,至少需加入NaF固体的质量为
(5)“反萃取”步骤中加入的“试剂a”为
(6)采用惰性电极电解CoCl2溶液﹑在无离子交换膜的条件下,不能用CoSO4溶液代替CoCl2溶液的理由是
(7)将制得的胆矾配成溶液,先加入足量氨水,得到深蓝色溶液,再通入SO2至弱酸性,生成白色沉淀。经仪器分析:白色沉淀含H、N,O、S、Cu五种元素,且Cu∶N∶S=1∶4∶l;所含Cu离子中无单电子;晶体的部分组成微粒的空间构型分别为三角锥形和正四面体形。则白色沉淀的化学式为
您最近半年使用:0次
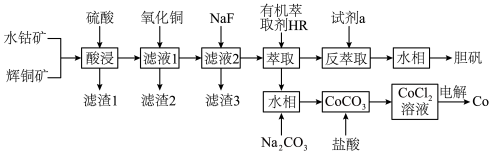
3 . 某科研小组通过以下方案制备连二亚硫酸钠( )并测定其纯度。
)并测定其纯度。
资料: 具有强还原性,空气中极易被氧化,易溶于水且随温度的升高溶解度增大,不溶于乙醇,在碱性介质中较稳定:低于52℃时
具有强还原性,空气中极易被氧化,易溶于水且随温度的升高溶解度增大,不溶于乙醇,在碱性介质中较稳定:低于52℃时 在水溶液中以
在水溶液中以 形态结晶,高于52℃时
形态结晶,高于52℃时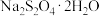 在碱性溶液中脱水成无水盐。
在碱性溶液中脱水成无水盐。
回答下列问题:
(1)无氧条件下,用锌粉还原 和
和 的混合液,即可制得连二亚硫酸钠;
的混合液,即可制得连二亚硫酸钠;

操作步骤:连接装置,关闭三通阀→___________ (填操作名称)→称取一定质量Zn置于三颈烧瓶中→___________ (填标号)pH传感→搅拌直至完全溶解。 和
和 的混合液→充入
的混合液→充入 →抽真空
→抽真空
B.抽真空→注入 和
和 的混合液→充入
的混合液→充入
C.抽真空→充入 →注入
→注入 和
和 的混合液
的混合液
(2)在上述所得溶液中滴加稍过量NaOH溶液控制pH在8.2~10.5之间,使 转化为
转化为 沉淀过滤除去:将所得溶液分批逐步加入一定量的NaCl固体搅拌,水蒸气加热略高于52℃左右结晶→
沉淀过滤除去:将所得溶液分批逐步加入一定量的NaCl固体搅拌,水蒸气加热略高于52℃左右结晶→___________ →用乙醇洗涤→干燥,可获得 。
。
(3)隔绝空气加热 固体完全分解得到固体产物
固体完全分解得到固体产物 、
、 和
和 ,但实验过程未能做到完全隔绝空气,设计实验证明该分解产物中含有
,但实验过程未能做到完全隔绝空气,设计实验证明该分解产物中含有 :
:___________ 。
(4)下图是硫的四种含氧酸根的结构推断具有强氧化性的是___________ (填标号); 转化为
转化为 的离子反应方程式为
的离子反应方程式为___________ 。
(5) 含量的测定
含量的测定
实验原理: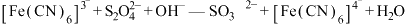 (未配平)。
(未配平)。
实验过程:称取0.25g产品加入三颈烧瓶中,维持氮气氛围,加入适量NaOH溶液,再滴加0.10
 标准溶液,达到滴定终点时消耗22.00mL标准溶液。则产品中
标准溶液,达到滴定终点时消耗22.00mL标准溶液。则产品中 的质量分数为
的质量分数为
___________ %(杂质不参与反应,保留四位有效数字)。
 )并测定其纯度。
)并测定其纯度。资料:
 具有强还原性,空气中极易被氧化,易溶于水且随温度的升高溶解度增大,不溶于乙醇,在碱性介质中较稳定:低于52℃时
具有强还原性,空气中极易被氧化,易溶于水且随温度的升高溶解度增大,不溶于乙醇,在碱性介质中较稳定:低于52℃时 在水溶液中以
在水溶液中以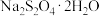 形态结晶,高于52℃时
形态结晶,高于52℃时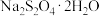 在碱性溶液中脱水成无水盐。
在碱性溶液中脱水成无水盐。回答下列问题:
(1)无氧条件下,用锌粉还原
 和
和 的混合液,即可制得连二亚硫酸钠;
的混合液,即可制得连二亚硫酸钠;
操作步骤:连接装置,关闭三通阀→
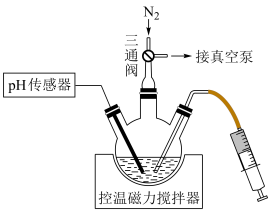
 和
和 的混合液→充入
的混合液→充入 →抽真空
→抽真空B.抽真空→注入
 和
和 的混合液→充入
的混合液→充入
C.抽真空→充入
 →注入
→注入 和
和 的混合液
的混合液(2)在上述所得溶液中滴加稍过量NaOH溶液控制pH在8.2~10.5之间,使
 转化为
转化为 沉淀过滤除去:将所得溶液分批逐步加入一定量的NaCl固体搅拌,水蒸气加热略高于52℃左右结晶→
沉淀过滤除去:将所得溶液分批逐步加入一定量的NaCl固体搅拌,水蒸气加热略高于52℃左右结晶→ 。
。(3)隔绝空气加热
 固体完全分解得到固体产物
固体完全分解得到固体产物 、
、 和
和 ,但实验过程未能做到完全隔绝空气,设计实验证明该分解产物中含有
,但实验过程未能做到完全隔绝空气,设计实验证明该分解产物中含有 :
:(4)下图是硫的四种含氧酸根的结构推断具有强氧化性的是
A.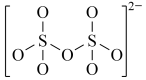 B.
B.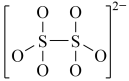 C.
C.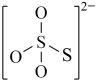 D.
D.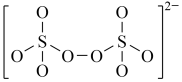
 转化为
转化为 的离子反应方程式为
的离子反应方程式为(5)
 含量的测定
含量的测定实验原理:
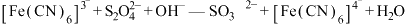 (未配平)。
(未配平)。实验过程:称取0.25g产品加入三颈烧瓶中,维持氮气氛围,加入适量NaOH溶液,再滴加0.10

 标准溶液,达到滴定终点时消耗22.00mL标准溶液。则产品中
标准溶液,达到滴定终点时消耗22.00mL标准溶液。则产品中 的质量分数为
的质量分数为
您最近半年使用:0次
4 . 锆是一种稀有金属,广泛用在航空航天、军工、核反应、原子能领域。一种以锆英砂(主要含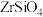 ,还含有少量Cr、Fe、Hf等元素)为原料生产金属锆和副产物硅酸钙的工艺流程如下:
,还含有少量Cr、Fe、Hf等元素)为原料生产金属锆和副产物硅酸钙的工艺流程如下: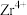 、
、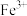 、
、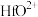 、
、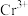 ;
;
②25℃时, ,
,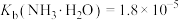 ;
;
③部分氯化物的沸点数据如表所示:
回答下列问题:
(1)“碱熔”时有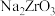 生成,则
生成,则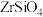 发生反应的化学方程式为
发生反应的化学方程式为______ ,温度和时间对锆英砂碱熔分解率的影响如图所示,应采取的条件为______ 。______ ,流程中可循环利用的物质除TOPO外,还有______ (填化学式)。
(3)“氨沉”时产物为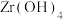 、
、 和
和 ,反应结束后溶液中
,反应结束后溶液中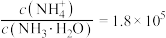 ,则
,则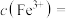
______  ,“滤液2”中主要成分是
,“滤液2”中主要成分是______ (填化学式)。
(4)“煅烧”时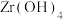 分解生成
分解生成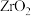 ,“沸腾氯化”时
,“沸腾氯化”时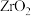 发生反应的化学方程式为
发生反应的化学方程式为______ ,氯化反应结束通入 ,目的是
,目的是______ 。
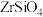 ,还含有少量Cr、Fe、Hf等元素)为原料生产金属锆和副产物硅酸钙的工艺流程如下:
,还含有少量Cr、Fe、Hf等元素)为原料生产金属锆和副产物硅酸钙的工艺流程如下: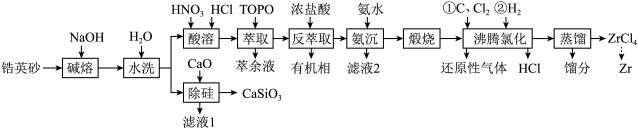
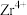 、
、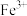 、
、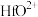 、
、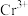 ;
;②25℃时,
 ,
,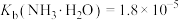 ;
;③部分氯化物的沸点数据如表所示:
物质 |
|
|
|
|
沸点/℃ | 331 | 1300 | 316 | 700 |
(1)“碱熔”时有
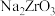 生成,则
生成,则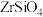 发生反应的化学方程式为
发生反应的化学方程式为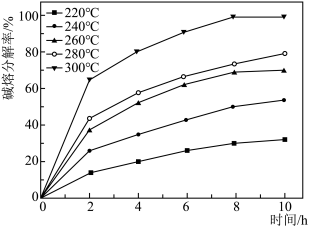
(3)“氨沉”时产物为
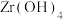 、
、 和
和 ,反应结束后溶液中
,反应结束后溶液中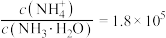 ,则
,则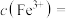
 ,“滤液2”中主要成分是
,“滤液2”中主要成分是(4)“煅烧”时
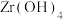 分解生成
分解生成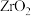 ,“沸腾氯化”时
,“沸腾氯化”时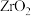 发生反应的化学方程式为
发生反应的化学方程式为 ,目的是
,目的是
您最近半年使用:0次
解题方法
5 . 用软锰矿( ,含
,含 、
、 杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料
杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料 的工艺流程如下:
的工艺流程如下: ,
,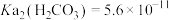 ,
,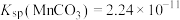
有关离子沉淀时的pH:
回答下列问题:
(1)“滤渣1”除了S、 外,还有
外,还有___________ (填化学式)。
(2)“试剂a”可以选用___________ (填标号),“除杂”应调pH范围是___________ 。
A.NaClO B. C.
C. D.NaOH
D.NaOH
(3)“沉锰”时发生反应的离子方程式为___________ 。
(4)“沉锰”后上层清液中
___________ 。
(5)“焙烧”时发生反应的化学方程式为___________ 。
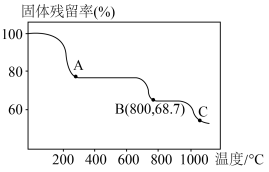
(6)碳酸锰在空气中加热,固体残留率随温度变化如图。碳酸锰在300℃时已完全脱碳,则B点对应的物质的化学式为___________ 。
 ,含
,含 、
、 杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料
杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料 的工艺流程如下:
的工艺流程如下: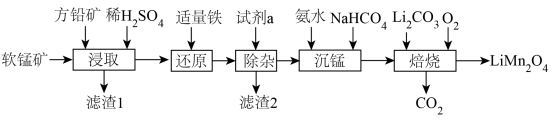
 ,
,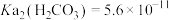 ,
,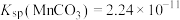
有关离子沉淀时的pH:
 |  |  |  | |
| 开始沉淀时 | 8.3 | 7.6 | 2.7 | 3.0 |
| 沉淀完全时 | 9.8 | 9.6 | 3.7 | 4.7 |
(1)“滤渣1”除了S、
 外,还有
外,还有(2)“试剂a”可以选用
A.NaClO B.
 C.
C. D.NaOH
D.NaOH(3)“沉锰”时发生反应的离子方程式为
(4)“沉锰”后上层清液中

(5)“焙烧”时发生反应的化学方程式为
(6)碳酸锰在空气中加热,固体残留率随温度变化如图。碳酸锰在300℃时已完全脱碳,则B点对应的物质的化学式为
您最近半年使用:0次
6 . 氧钒碱式碳酸铵晶体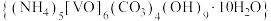 ,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知
,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知 易被
易被 氧化)。回答下列问题。
氧化)。回答下列问题。
Ⅰ.制备
步骤1:向 中加入足量盐酸酸化的
中加入足量盐酸酸化的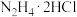 溶液,微沸数分钟。
溶液,微沸数分钟。
步骤2:向足量 溶液中缓慢加入制得的
溶液中缓慢加入制得的 溶液,有气泡产生并析出紫红色晶体。
溶液,有气泡产生并析出紫红色晶体。
步骤3:反应结束后抽滤,先后用饱和 溶液、无水乙醇洗涤,静置得产品。
溶液、无水乙醇洗涤,静置得产品。
(1)“步骤1”产生无色无污染的气体,该反应的化学方程式为______ 。
(2)用无水乙醇洗涤的目的是______ 。
(3)“步骤2”可在如图装置中进行。______ 。(按气流方向,用字母标号表示)。
②检查装置气密性,加入试剂。先打开 ,通入一段时间气体目的是
,通入一段时间气体目的是______ ,当观察到______ (填实验现象)时,再关闭 ,打开
,打开 ,进行实验。
,进行实验。
③生成氧钒碱式碳酸铵晶体的化学方程式为______ 。
Ⅱ.产品中氮元素含量的测定
精确称取wg晶体加入如图所示的三颈烧瓶中,然后逐滴加入足量10%NaOH溶液充分反应,通入水蒸气,将氨全部蒸出,并用蒸馏水冲洗导管内壁,用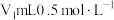 的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5
的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5 盐酸标准溶液滴定,到终点时消耗
盐酸标准溶液滴定,到终点时消耗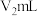 盐酸。
盐酸。
已知: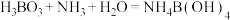 ,
, 。
。
(4)“冰盐水”的作用是______ 。
(5)样品中氮元素质量分数的表达式为______ 。
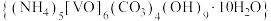 ,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知
,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知 易被
易被 氧化)。回答下列问题。
氧化)。回答下列问题。Ⅰ.制备
步骤1:向
 中加入足量盐酸酸化的
中加入足量盐酸酸化的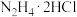 溶液,微沸数分钟。
溶液,微沸数分钟。步骤2:向足量
 溶液中缓慢加入制得的
溶液中缓慢加入制得的 溶液,有气泡产生并析出紫红色晶体。
溶液,有气泡产生并析出紫红色晶体。步骤3:反应结束后抽滤,先后用饱和
 溶液、无水乙醇洗涤,静置得产品。
溶液、无水乙醇洗涤,静置得产品。(1)“步骤1”产生无色无污染的气体,该反应的化学方程式为
(2)用无水乙醇洗涤的目的是
(3)“步骤2”可在如图装置中进行。
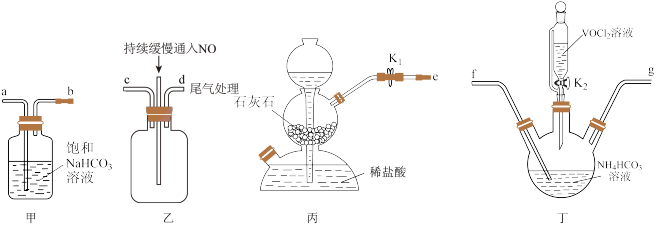
②检查装置气密性,加入试剂。先打开
 ,通入一段时间气体目的是
,通入一段时间气体目的是 ,打开
,打开 ,进行实验。
,进行实验。③生成氧钒碱式碳酸铵晶体的化学方程式为
Ⅱ.产品中氮元素含量的测定
精确称取wg晶体加入如图所示的三颈烧瓶中,然后逐滴加入足量10%NaOH溶液充分反应,通入水蒸气,将氨全部蒸出,并用蒸馏水冲洗导管内壁,用
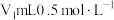 的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5
的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5 盐酸标准溶液滴定,到终点时消耗
盐酸标准溶液滴定,到终点时消耗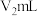 盐酸。
盐酸。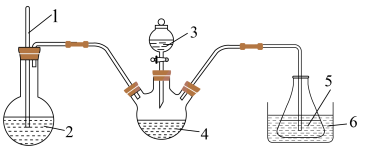
已知:
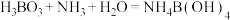 ,
, 。
。(4)“冰盐水”的作用是
(5)样品中氮元素质量分数的表达式为
您最近半年使用:0次
名校
解题方法
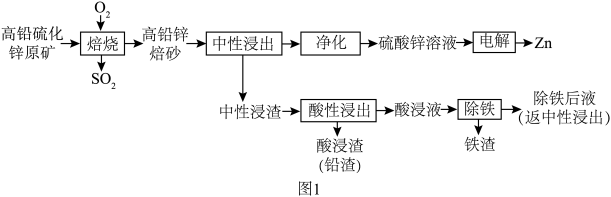
7 . 从高铅硫化锌原矿(主要成分为ZnS、PbS、FeS2、ZnCO3)中提取有价金属的工艺流程如图1所示。回答下列问题:___________ (填一条)。
(2)硫化锌的“焙烧”过程中,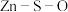 系在温度为1100K下的
系在温度为1100K下的 [
[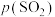 、
、 分别为平衡时两种物质的分压]的等温平衡状态图如图2所示。
分别为平衡时两种物质的分压]的等温平衡状态图如图2所示。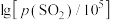 、
、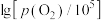 均为-5时,含锌产物为
均为-5时,含锌产物为___________ (填化学式)。
②一定条件下,焙烧过程中A点ZnS发生反应的化学方程式为___________ 。
③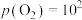 kPa时,若要使ZnSO4转化成更多的ZnO,需进行的操作为
kPa时,若要使ZnSO4转化成更多的ZnO,需进行的操作为___________ (填“降低SO2的分压”或“升高SO2的分压”)。
(3)“中性浸渣”中含有ZnO、PbO、Fe2O3。
①“酸性浸出”时加入的酸是___________ (填化学式,下同)。
②“除铁后液”的主要溶质为___________ 。
③“除铁”过程:先加入ZnS将Fe3+还原为Fe2+,再加入ZnO并通入O2,将其转化为FeOOH.若1 molFe2+转化为FeOOH,则在标准状况下消耗___________ LO2。
(4)“电解”时电极均为Pt极,则阳极反应式为___________ 。
(2)硫化锌的“焙烧”过程中,
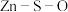 系在温度为1100K下的
系在温度为1100K下的 [
[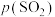 、
、 分别为平衡时两种物质的分压]的等温平衡状态图如图2所示。
分别为平衡时两种物质的分压]的等温平衡状态图如图2所示。 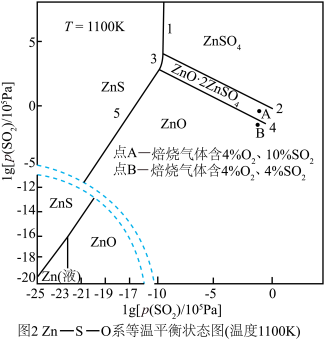
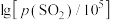 、
、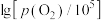 均为-5时,含锌产物为
均为-5时,含锌产物为②一定条件下,焙烧过程中A点ZnS发生反应的化学方程式为
③
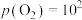 kPa时,若要使ZnSO4转化成更多的ZnO,需进行的操作为
kPa时,若要使ZnSO4转化成更多的ZnO,需进行的操作为(3)“中性浸渣”中含有ZnO、PbO、Fe2O3。
①“酸性浸出”时加入的酸是
②“除铁后液”的主要溶质为
③“除铁”过程:先加入ZnS将Fe3+还原为Fe2+,再加入ZnO并通入O2,将其转化为FeOOH.若1 molFe2+转化为FeOOH,则在标准状况下消耗
(4)“电解”时电极均为Pt极,则阳极反应式为
您最近半年使用:0次
名校
解题方法
8 . 周期表中ⅢA族单质及其化合物应用广泛。 极易水解生成
极易水解生成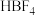 (
(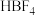 在水溶液中完全电离为
在水溶液中完全电离为 和
和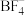 )和硼酸(
)和硼酸( ),硼酸是一元弱酸,能溶于水;硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯
),硼酸是一元弱酸,能溶于水;硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯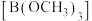 ;
; 是一种重要还原剂,其与热水反应生成
是一种重要还原剂,其与热水反应生成 和硼酸钠(
和硼酸钠(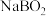 );高温下
);高温下 和焦炭在氯气的氛围中反应,生成
和焦炭在氯气的氛围中反应,生成 及一种剧毒气体;GaN是第三代半导体研究的热点。下列化学反应表示正确的是
及一种剧毒气体;GaN是第三代半导体研究的热点。下列化学反应表示正确的是
 极易水解生成
极易水解生成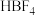 (
(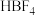 在水溶液中完全电离为
在水溶液中完全电离为 和
和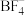 )和硼酸(
)和硼酸( ),硼酸是一元弱酸,能溶于水;硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯
),硼酸是一元弱酸,能溶于水;硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯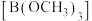 ;
; 是一种重要还原剂,其与热水反应生成
是一种重要还原剂,其与热水反应生成 和硼酸钠(
和硼酸钠(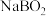 );高温下
);高温下 和焦炭在氯气的氛围中反应,生成
和焦炭在氯气的氛围中反应,生成 及一种剧毒气体;GaN是第三代半导体研究的热点。下列化学反应表示正确的是
及一种剧毒气体;GaN是第三代半导体研究的热点。下列化学反应表示正确的是A. 与热水反应: 与热水反应: |
B.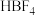 溶液与NaOH溶液反应: 溶液与NaOH溶液反应: |
C.用石墨作电极电解 制备Al的阴极反应式: 制备Al的阴极反应式: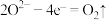 |
D.高温下 、焦炭在氯气中反应: 、焦炭在氯气中反应: |
您最近半年使用:0次
解题方法
9 . 一种利用湿法炼锌净化渣回收钴并制备碱式碳酸锌的工艺如下图所示,已知净化渣含有较多的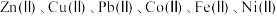 的硫酸盐及氢氧化物(“Ⅱ”指相应元素的化合价为
的硫酸盐及氢氧化物(“Ⅱ”指相应元素的化合价为 价)。
价)。 。
。
(1)浸出渣主要成分为_______ 。
(2)大多数金属硫化物都难溶于水,选择 除铜的原因是
除铜的原因是_______ ,若加入 后溶液中
后溶液中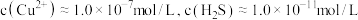 ,则溶液的
,则溶液的 约为
约为_______ 。
(3)研究加入 后温度和时间对金属脱除率的影响,所得曲线如下图所示。
后温度和时间对金属脱除率的影响,所得曲线如下图所示。_______ , 滤渣中还含有
滤渣中还含有_______ 。
(4)在适宜的条件下,加入 并调节溶液
并调节溶液 至
至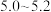 ,反应生成
,反应生成 的离子方程式为
的离子方程式为_______ 。以 湿法炼锌净化渣(
湿法炼锌净化渣( 的质量分数为
的质量分数为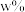 )为原料提取出
)为原料提取出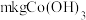 ,在提取过程中钴的损失率为
,在提取过程中钴的损失率为_______  (填含
(填含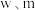 的表达式)。
的表达式)。
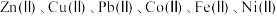 的硫酸盐及氢氧化物(“Ⅱ”指相应元素的化合价为
的硫酸盐及氢氧化物(“Ⅱ”指相应元素的化合价为 价)。
价)。
 。
。(1)浸出渣主要成分为
(2)大多数金属硫化物都难溶于水,选择
 除铜的原因是
除铜的原因是 后溶液中
后溶液中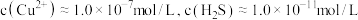 ,则溶液的
,则溶液的 约为
约为(3)研究加入
 后温度和时间对金属脱除率的影响,所得曲线如下图所示。
后温度和时间对金属脱除率的影响,所得曲线如下图所示。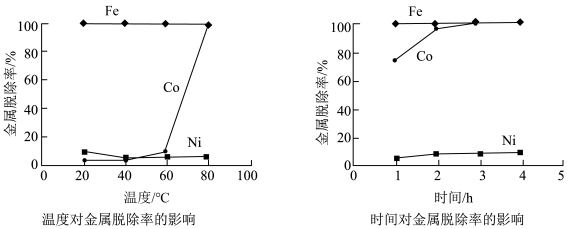
 滤渣中还含有
滤渣中还含有(4)在适宜的条件下,加入
 并调节溶液
并调节溶液 至
至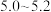 ,反应生成
,反应生成 的离子方程式为
的离子方程式为 湿法炼锌净化渣(
湿法炼锌净化渣( 的质量分数为
的质量分数为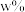 )为原料提取出
)为原料提取出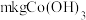 ,在提取过程中钴的损失率为
,在提取过程中钴的损失率为 (填含
(填含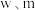 的表达式)。
的表达式)。
您最近半年使用:0次
10 . 铬铁渣是火法炼铬所产生的废渣,其中铬以低价态的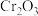 存在,主要杂质为铁、铝、硅的氧化物,从铬铁渣中提取铬的一种流程如图所示
存在,主要杂质为铁、铝、硅的氧化物,从铬铁渣中提取铬的一种流程如图所示 存在,在碱性介质中以
存在,在碱性介质中以 存在。下列说法错误的是
存在。下列说法错误的是
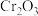 存在,主要杂质为铁、铝、硅的氧化物,从铬铁渣中提取铬的一种流程如图所示
存在,主要杂质为铁、铝、硅的氧化物,从铬铁渣中提取铬的一种流程如图所示
 存在,在碱性介质中以
存在,在碱性介质中以 存在。下列说法错误的是
存在。下列说法错误的是A.焙烧后,含铬化合物主要以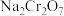 存在 存在 |
| B.加水浸取过滤,滤渣1的主要成分应含有铁元素 |
| C.除铝步骤,为使杂质沉淀彻底,应加入足量稀硫酸 |
D.还原步骤发生的离子反应是: |
您最近半年使用:0次