名校
解题方法
1 . 亚硝酸钙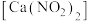 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应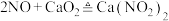 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。 溶液能将NO氧化为
溶液能将NO氧化为 。
。
回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通 ,其目的是
,其目的是________ 。通 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是________ 。
(2)仪器a的名称为________ ,装置D中盛装的试剂是________ (填名称),装置E的作用是________ 。
(3)制备的产品 样品中含有杂质
样品中含有杂质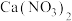 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: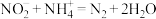 ;“还原
;“还原 ”时加入
”时加入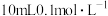 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为________ ,样品中 的纯度为
的纯度为________ (用含m、V的式子表示)。
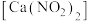 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应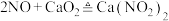 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。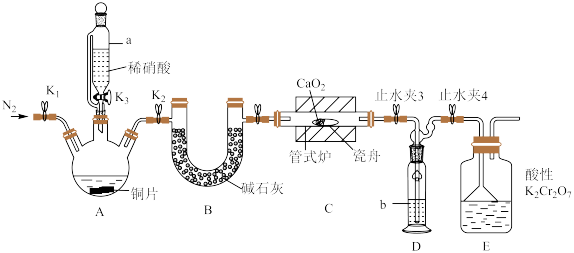
 溶液能将NO氧化为
溶液能将NO氧化为 。
。回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通
 ,其目的是
,其目的是 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是(2)仪器a的名称为
(3)制备的产品
 样品中含有杂质
样品中含有杂质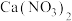 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: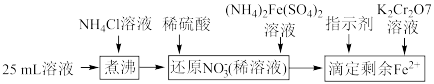
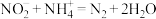 ;“还原
;“还原 ”时加入
”时加入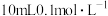 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为 的纯度为
的纯度为
您最近半年使用:0次
昨日更新
|
8次组卷
|
2卷引用: 湖南省北师联盟2024届高三下学期模拟考试三模化学试题
名校
解题方法
2 . 高砷烟尘(主要成分有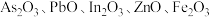 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 ,和金属铟的工业流程如下:
,和金属铟的工业流程如下: 在酸性溶液中以
在酸性溶液中以 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;
② 在
在 易分解为
易分解为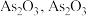 难溶于水;
难溶于水;
③ 。
。
回答下列问题:
(1)滤渣的主要成分为_______ (填化学式)。
(2)“高压酸浸”时, 的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过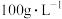 时,
时, 的浸出率随硫酸浓度增大而略微减小的原因可能为
的浸出率随硫酸浓度增大而略微减小的原因可能为_______ 。 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ 。已知 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为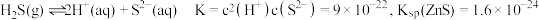 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的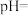
_______ 。
(4)“还原”后溶液酸性增强,主要原因是_______ (用离子方程式表示)。
(5)“结晶”操作为_______ 、过滤、洗涤、干燥。
(6)“萃余液”中含有的金属阳离子为_______ (填离子符号),将 溶液电解得到金属铟,阴极的电极反应式为
溶液电解得到金属铟,阴极的电极反应式为_______ 。
(7)硫化铟铜是一种新型的纳米材料,具有优异的光电性能和光催化性能。一种由S、 三种元素组成的化合物的晶胞如图所示。采用
三种元素组成的化合物的晶胞如图所示。采用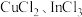 和
和 合成硫化铟铜薄膜,该反应的化学方程式是
合成硫化铟铜薄膜,该反应的化学方程式是_______ ,该晶胞的六个面均为矩形,上、下底面的晶胞参数为 ,高为
,高为 ,晶体密度为
,晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为_______ (用含a、b、d的式子表示)。
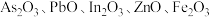 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 ,和金属铟的工业流程如下:
,和金属铟的工业流程如下: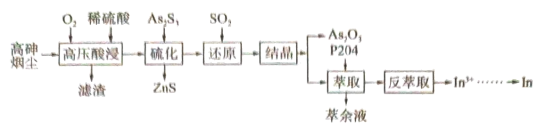
 在酸性溶液中以
在酸性溶液中以 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;②
 在
在 易分解为
易分解为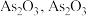 难溶于水;
难溶于水;③
 。
。回答下列问题:
(1)滤渣的主要成分为
(2)“高压酸浸”时,
 的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过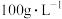 时,
时, 的浸出率随硫酸浓度增大而略微减小的原因可能为
的浸出率随硫酸浓度增大而略微减小的原因可能为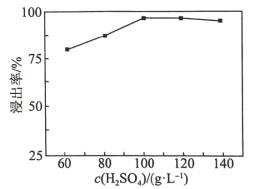
 ,发生反应的离子方程式为
,发生反应的离子方程式为 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为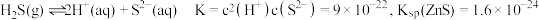 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的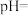
(4)“还原”后溶液酸性增强,主要原因是
(5)“结晶”操作为
(6)“萃余液”中含有的金属阳离子为
 溶液电解得到金属铟,阴极的电极反应式为
溶液电解得到金属铟,阴极的电极反应式为(7)硫化铟铜是一种新型的纳米材料,具有优异的光电性能和光催化性能。一种由S、
 三种元素组成的化合物的晶胞如图所示。采用
三种元素组成的化合物的晶胞如图所示。采用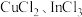 和
和 合成硫化铟铜薄膜,该反应的化学方程式是
合成硫化铟铜薄膜,该反应的化学方程式是 ,高为
,高为 ,晶体密度为
,晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近半年使用:0次
解题方法
3 . 硫酸铈铵[ ,相对分子质量为596]微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。以氟碳铈矿(含
,相对分子质量为596]微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。以氟碳铈矿(含 等)为原料制备硫酸铈铵的工艺流程如图所示。
等)为原料制备硫酸铈铵的工艺流程如图所示。
 在空气中易被氧化为
在空气中易被氧化为 ;
; ;
;
回答下列问题:
(1)“滤渣A”的成分除 外,还有
外,还有_____________ (填化学式);
(2)“焙烧”时,下列采取的措施正确的是_____________(填标号);
(3)在另一种工艺中,在氟碳铈矿粉中加入碳酸氢钠固体同时通入氧气焙烧,得到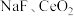 两种固体以及两种高温下的气态物质,该反应的化学方程式为
两种固体以及两种高温下的气态物质,该反应的化学方程式为____________________________ ;
(4)“酸浸”中,铈浸出率与温度的关系如图1所示,铈浸出率与硫酸浓度的关系如图2所示。工业生产应选择的适宜条件是_____________(填标号)。
(5) 分子中
分子中 键角
键角_________ (填“大于”“小于”或“等于”)硫脲分子中 键角;
键角;
(6)“溶解”时加入稀盐酸后,还需加入另一种化学试剂X,根据题中信息推测,加入X的作用是__________ ;
(7)含 溶液与足量
溶液与足量 溶液反应生成
溶液反应生成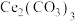 沉淀的离子方程式为
沉淀的离子方程式为________________ ;
(8)利用硫化锌锂电池电解含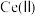 的溶液,可将
的溶液,可将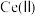 转化为
转化为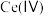 .该硫化锌锂电池放电时,负极材料的立方晶胞组成变化如图所示;
.该硫化锌锂电池放电时,负极材料的立方晶胞组成变化如图所示; 中,
中,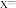
________ ;
②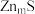 晶胞中,
晶胞中, 填充在
填充在 构成的部分正四面体空隙中,
构成的部分正四面体空隙中, 和
和 之间最近的核间距为
之间最近的核间距为 ,则
,则 晶体的密度为
晶体的密度为__________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 ,相对分子质量为596]微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。以氟碳铈矿(含
,相对分子质量为596]微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。以氟碳铈矿(含 等)为原料制备硫酸铈铵的工艺流程如图所示。
等)为原料制备硫酸铈铵的工艺流程如图所示。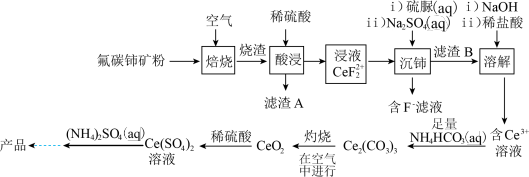
 在空气中易被氧化为
在空气中易被氧化为 ;
;②硫脲的结构简式为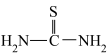 ,具有还原性;
,具有还原性;
 ;
;回答下列问题:
(1)“滤渣A”的成分除
 外,还有
外,还有(2)“焙烧”时,下列采取的措施正确的是_____________(填标号);
| A.采用高压空气,使矿粉呈“沸腾”状 |
| B.空气从焙烧炉上部通入,矿粉从焙烧炉下部加入 |
| C.空气从焙烧炉下部通入,矿粉从焙烧炉上部加入 |
| D.空气、矿粉均从焙烧炉上部通入或加入 |
(3)在另一种工艺中,在氟碳铈矿粉中加入碳酸氢钠固体同时通入氧气焙烧,得到
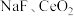 两种固体以及两种高温下的气态物质,该反应的化学方程式为
两种固体以及两种高温下的气态物质,该反应的化学方程式为(4)“酸浸”中,铈浸出率与温度的关系如图1所示,铈浸出率与硫酸浓度的关系如图2所示。工业生产应选择的适宜条件是_____________(填标号)。

A.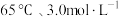 | B.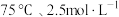 | C. | D. |
(5)
 分子中
分子中 键角
键角 键角;
键角;(6)“溶解”时加入稀盐酸后,还需加入另一种化学试剂X,根据题中信息推测,加入X的作用是
(7)含
 溶液与足量
溶液与足量 溶液反应生成
溶液反应生成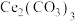 沉淀的离子方程式为
沉淀的离子方程式为(8)利用硫化锌锂电池电解含
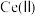 的溶液,可将
的溶液,可将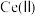 转化为
转化为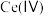 .该硫化锌锂电池放电时,负极材料的立方晶胞组成变化如图所示;
.该硫化锌锂电池放电时,负极材料的立方晶胞组成变化如图所示;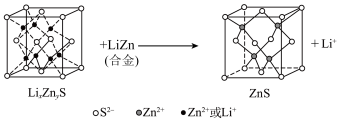
 中,
中,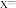
②
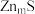 晶胞中,
晶胞中, 填充在
填充在 构成的部分正四面体空隙中,
构成的部分正四面体空隙中, 和
和 之间最近的核间距为
之间最近的核间距为 ,则
,则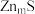 晶体的密度为
晶体的密度为 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近半年使用:0次
名校
解题方法
4 . 新能源汽车工业飞速发展依赖于锂离子电池的新型电极材料的研究取得的重大成果。 可以实现海水中
可以实现海水中 的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含
的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含 及少量
及少量 和
和 )为原料生产高纯
)为原料生产高纯 的工艺流程如图甲。
的工艺流程如图甲。
(1)“浸锰”时, 生成
生成 的离子方程式为
的离子方程式为___________ 。
(2)步骤Ⅱ中, 的萃取率与
的萃取率与 的关系如图乙,当
的关系如图乙,当 后,随
后,随 增大,
增大, 萃取率下降的原因是
萃取率下降的原因是___________ 。 ,若
,若 ,常温下调节
,常温下调节 范围应为
范围应为___________ {已知该条件下,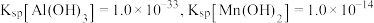 }。
}。
(4)海水中锂的总含量为陆地总含量的5000倍以上,但海水中锂的质量浓度仅为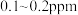 ,从海水中提取锂首先需要对低浓度的
,从海水中提取锂首先需要对低浓度的 进行选择性富集,而
进行选择性富集,而 能够嵌入高纯
能够嵌入高纯 并在一定条件下脱出,据此可以进行
并在一定条件下脱出,据此可以进行 的富集。
的富集。
①以 和高纯
和高纯 为原料,充分混合后在720℃下煅烧
为原料,充分混合后在720℃下煅烧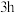 ,冷却至室温后即可得到复合氧化物
,冷却至室温后即可得到复合氧化物 。用
。用 的盐酸在60℃下处理
的盐酸在60℃下处理 ,将其中所有
,将其中所有 置换后得到
置换后得到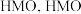 可以和
可以和 反应再生成
反应再生成 ,然后
,然后 与酸作用脱出
与酸作用脱出 从而实现
从而实现 的富集。如此循环处理。合成
的富集。如此循环处理。合成 的化学方程式为
的化学方程式为___________ ;
②用酸处理 时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含
时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含 元素的微粒是
元素的微粒是___________ 。这一副反应对再生后的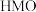 的锂富集性能的影响是
的锂富集性能的影响是___________ 。
(5)利用高纯 实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
步骤1:向 所在的腔室通入海水,启动电源1,使海水中的
所在的腔室通入海水,启动电源1,使海水中的 进入
进入 结构而形成
结构而形成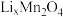 ;
;
步骤2:关闭电源1和海水通道,启动电源2,同时向电极2上通入空气,使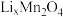 中的
中的 脱出进入腔室2。
脱出进入腔室2。 对
对 的富集效果,将
的富集效果,将 的
的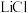 溶液通入
溶液通入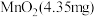 所在腔室,启动电源1,使电流恒定在
所在腔室,启动电源1,使电流恒定在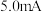 ,累计工作
,累计工作 后发现
后发现 的电极电势快速下降,则
的电极电势快速下降,则 中的
中的
___________ (已知 电子的电量为
电子的电量为 。电流效率为
。电流效率为 )。
)。
②电源2工作时, 电极上发生的电极反应为
电极上发生的电极反应为___________ 。
 可以实现海水中
可以实现海水中 的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含
的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含 及少量
及少量 和
和 )为原料生产高纯
)为原料生产高纯 的工艺流程如图甲。
的工艺流程如图甲。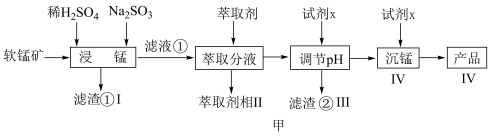
(1)“浸锰”时,
 生成
生成 的离子方程式为
的离子方程式为(2)步骤Ⅱ中,
 的萃取率与
的萃取率与 的关系如图乙,当
的关系如图乙,当 后,随
后,随 增大,
增大, 萃取率下降的原因是
萃取率下降的原因是
 ,若
,若 ,常温下调节
,常温下调节 范围应为
范围应为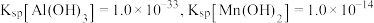 }。
}。(4)海水中锂的总含量为陆地总含量的5000倍以上,但海水中锂的质量浓度仅为
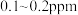 ,从海水中提取锂首先需要对低浓度的
,从海水中提取锂首先需要对低浓度的 进行选择性富集,而
进行选择性富集,而 能够嵌入高纯
能够嵌入高纯 并在一定条件下脱出,据此可以进行
并在一定条件下脱出,据此可以进行 的富集。
的富集。①以
 和高纯
和高纯 为原料,充分混合后在720℃下煅烧
为原料,充分混合后在720℃下煅烧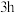 ,冷却至室温后即可得到复合氧化物
,冷却至室温后即可得到复合氧化物 。用
。用 的盐酸在60℃下处理
的盐酸在60℃下处理 ,将其中所有
,将其中所有 置换后得到
置换后得到 可以和
可以和 反应再生成
反应再生成 ,然后
,然后 与酸作用脱出
与酸作用脱出 从而实现
从而实现 的富集。如此循环处理。合成
的富集。如此循环处理。合成 的化学方程式为
的化学方程式为②用酸处理
 时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含
时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含 元素的微粒是
元素的微粒是 的锂富集性能的影响是
的锂富集性能的影响是(5)利用高纯
 实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:步骤1:向
 所在的腔室通入海水,启动电源1,使海水中的
所在的腔室通入海水,启动电源1,使海水中的 进入
进入 结构而形成
结构而形成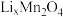 ;
;步骤2:关闭电源1和海水通道,启动电源2,同时向电极2上通入空气,使
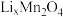 中的
中的 脱出进入腔室2。
脱出进入腔室2。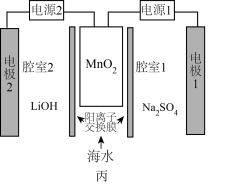
 对
对 的富集效果,将
的富集效果,将 的
的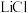 溶液通入
溶液通入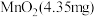 所在腔室,启动电源1,使电流恒定在
所在腔室,启动电源1,使电流恒定在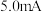 ,累计工作
,累计工作 后发现
后发现 的电极电势快速下降,则
的电极电势快速下降,则 中的
中的
 电子的电量为
电子的电量为 。电流效率为
。电流效率为 )。
)。②电源2工作时,
 电极上发生的电极反应为
电极上发生的电极反应为
您最近半年使用:0次
解题方法
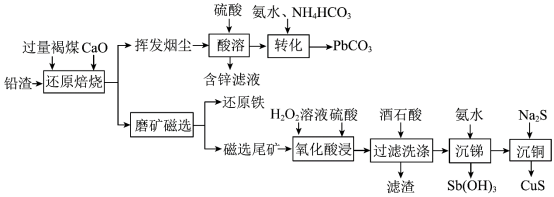
5 . 铅渣由多种氧化物及它们相互结合而形成的化合物、固溶体、共晶混合物所组成。对铅渣进行综合利用,回收其中的有价金属(Cu、Fe、Pb、Zn、Sb)的部分工艺流程如下: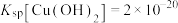 ,
, ,
, 。
。
②金属离子浓度等于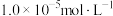 时,可认为其恰好沉淀完全。
时,可认为其恰好沉淀完全。
(1)Sb元素的原子序数为51,与氮元素同主族,其基态电子排布式为[Kr]___________ 。
(2)“还原焙烧”时, 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(3)挥发烟尘中的主要氧化物为 。“转化”过程中,发生反应的离子方程式为
。“转化”过程中,发生反应的离子方程式为___________ 。
(4)“氧化酸浸”过程中,若将物质的量为2mol的 合金(其中Cu与Sb物质的量之比为
合金(其中Cu与Sb物质的量之比为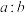 )氧化,至少需要
)氧化,至少需要 的物质的量为
的物质的量为___________ mol(用含a、b的式子表示)。
(5)“过滤洗涤”过程中,加入酒石酸(分子式为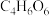 ,结构简式
,结构简式 )发生如下反应:
)发生如下反应: ;
;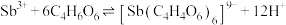 。
。
①上述两个配合物中,提供孤对电子的元素为___________ (填元素符号)。
②“过滤洗涤”时,用酒石酸稀溶液洗涤滤渣而不用水。用酒石酸稀溶液洗涤可减少金属离子的损失,原因为___________ 。
(6)“沉锑”过程中,锑恰好沉淀完全时,溶液中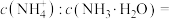
___________ 。
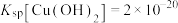 ,
, ,
, 。
。②金属离子浓度等于
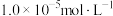 时,可认为其恰好沉淀完全。
时,可认为其恰好沉淀完全。(1)Sb元素的原子序数为51,与氮元素同主族,其基态电子排布式为[Kr]
(2)“还原焙烧”时,
 发生反应的化学方程式为
发生反应的化学方程式为(3)挥发烟尘中的主要氧化物为
 。“转化”过程中,发生反应的离子方程式为
。“转化”过程中,发生反应的离子方程式为(4)“氧化酸浸”过程中,若将物质的量为2mol的
 合金(其中Cu与Sb物质的量之比为
合金(其中Cu与Sb物质的量之比为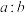 )氧化,至少需要
)氧化,至少需要 的物质的量为
的物质的量为(5)“过滤洗涤”过程中,加入酒石酸(分子式为
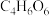 ,结构简式
,结构简式 )发生如下反应:
)发生如下反应: ;
;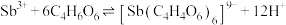 。
。①上述两个配合物中,提供孤对电子的元素为
②“过滤洗涤”时,用酒石酸稀溶液洗涤滤渣而不用水。用酒石酸稀溶液洗涤可减少金属离子的损失,原因为
(6)“沉锑”过程中,锑恰好沉淀完全时,溶液中
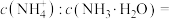
您最近半年使用:0次
名校
6 . 以赤泥(含有大量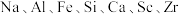 等的氧化物)为原料制备钪的工艺流程如下。
等的氧化物)为原料制备钪的工艺流程如下。
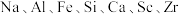 等的氧化物)为原料制备钪的工艺流程如下。
等的氧化物)为原料制备钪的工艺流程如下。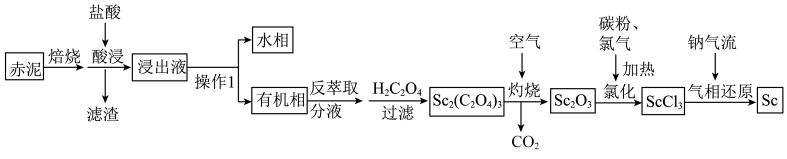
A. 位于元素周期表的第四周期ⅧB族 位于元素周期表的第四周期ⅧB族 |
| B.操作1使用的主要玻璃仪器为漏斗、烧杯 |
C.灼烧时生成 ,消耗 ,消耗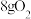 |
D.盐酸溶解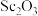 时生成难溶的 时生成难溶的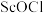 的离子反应为 的离子反应为 |
您最近半年使用:0次
名校
7 . 实验室以 溶液和碳酸氢铵溶液制备氧钒(IV)碱式碳酸铵晶体
溶液和碳酸氢铵溶液制备氧钒(IV)碱式碳酸铵晶体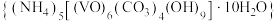 ,装置如图所示。已知:
,装置如图所示。已知: 能被
能被 氧化。下列说法不正确的是
氧化。下列说法不正确的是
 溶液和碳酸氢铵溶液制备氧钒(IV)碱式碳酸铵晶体
溶液和碳酸氢铵溶液制备氧钒(IV)碱式碳酸铵晶体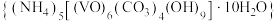 ,装置如图所示。已知:
,装置如图所示。已知: 能被
能被 氧化。下列说法不正确的是
氧化。下列说法不正确的是
A.Ⅱ中的试剂为饱和 溶液 溶液 |
B.实验开始时应先打开活塞 ,一段时间后,再打开活塞 ,一段时间后,再打开活塞 |
| C.Ⅲ中的反应为氧化还原反应 |
D.反应完全,小心取下分液漏斗,停止通气,立即塞上橡胶塞,将锥形瓶置于 保护下的干燥器中,静置过夜,得到晶体 保护下的干燥器中,静置过夜,得到晶体 |
您最近半年使用:0次
7日内更新
|
255次组卷
|
2卷引用:湖南省新高考教学教研联盟2023-2024学年高三下学期第二次联考化学试题
名校
解题方法
8 . 重铬酸钾是一种用途广泛的化合物。工业上以铬铁矿[主要成分为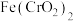 ,还含有
,还含有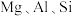 等的氧化物]为主要原料制备重铬酸钾
等的氧化物]为主要原料制备重铬酸钾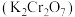 的一种工艺流程如图。回答下列问题:
的一种工艺流程如图。回答下列问题: 和
和 。
。
(1)焙烧”时将铬铁矿粉碎的目的是_______ ,滤渣I中能提炼出一种红色油漆颜料,则焙烧时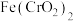 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(2)滤渣Ⅱ的主要成分是_______ 。
(3)“除杂”时需加热,其目的是_______ 。
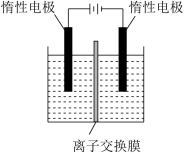
(4)“电解”是利用膜电解技术(装置如图所示),将 转化为
转化为 。阳极池发生反应的总的离子方程式为
。阳极池发生反应的总的离子方程式为_______ 。
(5)加入饱和 溶液后蒸发结晶,能得到
溶液后蒸发结晶,能得到 的原因是
的原因是_______ 。
(6)该流程中,能循环利用的物质有_______ (填化学式)。
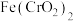 ,还含有
,还含有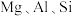 等的氧化物]为主要原料制备重铬酸钾
等的氧化物]为主要原料制备重铬酸钾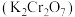 的一种工艺流程如图。回答下列问题:
的一种工艺流程如图。回答下列问题:
 和
和 。
。(1)焙烧”时将铬铁矿粉碎的目的是
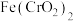 发生反应的化学方程式为
发生反应的化学方程式为(2)滤渣Ⅱ的主要成分是
(3)“除杂”时需加热,其目的是
(4)“电解”是利用膜电解技术(装置如图所示),将
 转化为
转化为 。阳极池发生反应的总的离子方程式为
。阳极池发生反应的总的离子方程式为
(5)加入饱和
 溶液后蒸发结晶,能得到
溶液后蒸发结晶,能得到 的原因是
的原因是(6)该流程中,能循环利用的物质有
您最近半年使用:0次
名校
9 . 燃煤产生的烟气中含有较多 、
、 、
、 等影响环境的气体,如何综合利用这些气体一直是科研人员研究的热点。下列说法正确的是
等影响环境的气体,如何综合利用这些气体一直是科研人员研究的热点。下列说法正确的是
 、
、 、
、 等影响环境的气体,如何综合利用这些气体一直是科研人员研究的热点。下列说法正确的是
等影响环境的气体,如何综合利用这些气体一直是科研人员研究的热点。下列说法正确的是A.将 通入足量的 通入足量的 溶液中,发生反应的化学方程式为 溶液中,发生反应的化学方程式为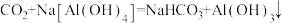 |
B.将 通入足量的酸性高锰酸钾溶液中,发生反应的离子方程式为 通入足量的酸性高锰酸钾溶液中,发生反应的离子方程式为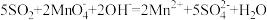 |
C.将 通入烧碱溶液中,发生反应的化学方程式为 通入烧碱溶液中,发生反应的化学方程式为 |
D.将 通入足量的次氯酸钠溶液中,发生反应的离子方程式为 通入足量的次氯酸钠溶液中,发生反应的离子方程式为 |
您最近半年使用:0次
名校
解题方法
10 . 在生活中亚硝酸钠 应用十分广泛,它是一种白色固体,外观与
应用十分广泛,它是一种白色固体,外观与 极其相似;少量可做食品的防腐剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知
极其相似;少量可做食品的防腐剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。 能被高锰酸钾氧化,但不能被浓硫酸氧化。
能被高锰酸钾氧化,但不能被浓硫酸氧化。
②酸性高锰酸钾溶液可将 氧化成
氧化成 。
。
回答下列问题:
(1)装置 中的装浓硝酸的仪器名称是
中的装浓硝酸的仪器名称是_____________________ ,仪器按气流方向连接顺序为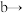
_____________________ 。
(2)①反应开始前打开止水夹 ,通入过量氮气的目的是
,通入过量氮气的目的是_________________________ 。
②反应结束后打开止水夹 ,再通入过量氮气的目的是
,再通入过量氮气的目的是_____________________ 。
(3)写出装置 中发生反应的离子方程式
中发生反应的离子方程式_________________________________________________________________ 。
(4)装置 能除去挥发的
能除去挥发的 蒸汽,另一作用是
蒸汽,另一作用是_________________________________________________ 。
(5)写出装置 中发生反应的离子方程式
中发生反应的离子方程式_________________________________________________________________ 。
 应用十分广泛,它是一种白色固体,外观与
应用十分广泛,它是一种白色固体,外观与 极其相似;少量可做食品的防腐剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知
极其相似;少量可做食品的防腐剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。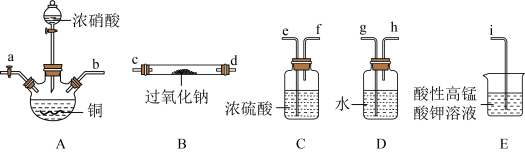
 能被高锰酸钾氧化,但不能被浓硫酸氧化。
能被高锰酸钾氧化,但不能被浓硫酸氧化。②酸性高锰酸钾溶液可将
 氧化成
氧化成 。
。回答下列问题:
(1)装置
 中的装浓硝酸的仪器名称是
中的装浓硝酸的仪器名称是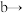
(2)①反应开始前打开止水夹
 ,通入过量氮气的目的是
,通入过量氮气的目的是②反应结束后打开止水夹
 ,再通入过量氮气的目的是
,再通入过量氮气的目的是(3)写出装置
 中发生反应的离子方程式
中发生反应的离子方程式(4)装置
 能除去挥发的
能除去挥发的 蒸汽,另一作用是
蒸汽,另一作用是(5)写出装置
 中发生反应的离子方程式
中发生反应的离子方程式
您最近半年使用:0次



