1 . 铊(Tl)本身是一种剧毒物质,为毒性最大的金属元素之一,但是铊在工业中的用途非常广泛,主要存在于一些矿物和工业废水中,也可以从含铊的合金中提取.从某铅锌厂的富铊灰(主要成分为 、
、 、
、 、
、 、
、 )中回收铊的工艺流程如图所示:
)中回收铊的工艺流程如图所示:
①在氯化物-硫酸水溶液中,铊元素以 形式存在;
形式存在;
(2)萃取过程的反应原理为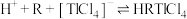 .
.
请回答下列问题:
(1)基态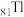 原子核外电子的运动状态有
原子核外电子的运动状态有________ 种.
(2)“浸取I”过程中为提高铊的浸取速率,可采取的措施有________________ (写出两条).
(3)写出“浸取I”中 发生反应的化学方程式:
发生反应的化学方程式:________________ ,“滤渣”的主要成分是________ (填化学式).
(4)请从化学平衡的角度解释“反萃取”过程中加入 溶液的原因:
溶液的原因:________________ .
(5)写出“还原氯化沉淀”中反应的离子方程式:________________ .
(6)通过沉淀法也可以去除工业废水中的 和
和 .
.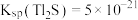 ,某地区规定工业污水中铊的污染物排放限值为
,某地区规定工业污水中铊的污染物排放限值为 ,若铊的含量符合国家排放限值,则处理后的废水中
,若铊的含量符合国家排放限值,则处理后的废水中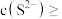
________  (假设污水中铊全部以
(假设污水中铊全部以 形式存在).
形式存在).
②向含铊废水中加入溴水,使 充分氧化成
充分氧化成 ,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是________________ .
 、
、 、
、 、
、 、
、 )中回收铊的工艺流程如图所示:
)中回收铊的工艺流程如图所示: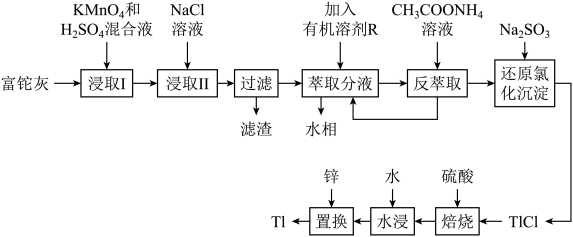
①在氯化物-硫酸水溶液中,铊元素以
 形式存在;
形式存在;(2)萃取过程的反应原理为
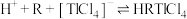 .
.请回答下列问题:
(1)基态
 原子核外电子的运动状态有
原子核外电子的运动状态有(2)“浸取I”过程中为提高铊的浸取速率,可采取的措施有
(3)写出“浸取I”中
 发生反应的化学方程式:
发生反应的化学方程式:(4)请从化学平衡的角度解释“反萃取”过程中加入
 溶液的原因:
溶液的原因:(5)写出“还原氯化沉淀”中反应的离子方程式:
(6)通过沉淀法也可以去除工业废水中的
 和
和 .
.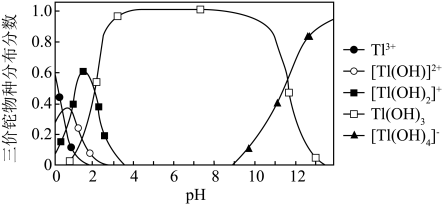
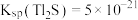 ,某地区规定工业污水中铊的污染物排放限值为
,某地区规定工业污水中铊的污染物排放限值为 ,若铊的含量符合国家排放限值,则处理后的废水中
,若铊的含量符合国家排放限值,则处理后的废水中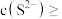
 (假设污水中铊全部以
(假设污水中铊全部以 形式存在).
形式存在).②向含铊废水中加入溴水,使
 充分氧化成
充分氧化成 ,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
您最近一年使用:0次
名校
2 . 铬的化合物应用广泛,工业上以铬铁矿(含Al、Si氧化物等杂质)为主要原料制备红矾钠( )的工艺流程如下图。已知:①
)的工艺流程如下图。已知:① 中Cr的化合价为+3;②焙烧的目的是将
中Cr的化合价为+3;②焙烧的目的是将 转化为
转化为 ,并将Al、Si氧化物转化为可溶性钠盐。
,并将Al、Si氧化物转化为可溶性钠盐。
(1)与基态铬原子的最外层电子数相同且同周期的元素有_________ 种。
(2)为了提高“焙烧”效果,可采取的一种措施是____________ 。
(3)“浸取”所得的滤渣为 由此推断
由此推断 “焙烧”时发生主要反应的化学方程式为
“焙烧”时发生主要反应的化学方程式为________ 。
(4)常温下,矿物中相关元素可溶性组分物质的量浓度的对数[ ]与pH的关系如图所示。当溶液中可溶性组分浓度
]与pH的关系如图所示。当溶液中可溶性组分浓度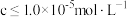 时,可认为已除尽。则“中和”时pH的理论范围为
时,可认为已除尽。则“中和”时pH的理论范围为________ ;“酸化”过程中的离子方程式为____________ 。 的酸性废水,用金属铁作阳极、石墨作阴极,一段时间后产生
的酸性废水,用金属铁作阳极、石墨作阴极,一段时间后产生 和
和 沉淀。
沉淀。
①若电解后溶液中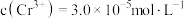 ,则
,则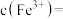
__________  {已知
{已知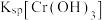
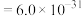 ,
,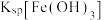 可从第(4)小题图中计算得出}。
可从第(4)小题图中计算得出}。
②电解法处理含 的酸性废水,下列有关原理的说法正确的是
的酸性废水,下列有关原理的说法正确的是_________ (填标号)。
A.阳极反应为
B.电解过程中溶液pH不会变化
C.如果石墨作阳极,电解过程不变
D.电路中每转移12mol电子,阳极有1mol 被还原
被还原
 )的工艺流程如下图。已知:①
)的工艺流程如下图。已知:① 中Cr的化合价为+3;②焙烧的目的是将
中Cr的化合价为+3;②焙烧的目的是将 转化为
转化为 ,并将Al、Si氧化物转化为可溶性钠盐。
,并将Al、Si氧化物转化为可溶性钠盐。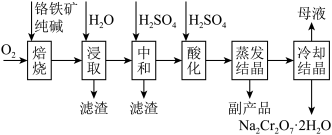
(1)与基态铬原子的最外层电子数相同且同周期的元素有
(2)为了提高“焙烧”效果,可采取的一种措施是
(3)“浸取”所得的滤渣为
 由此推断
由此推断 “焙烧”时发生主要反应的化学方程式为
“焙烧”时发生主要反应的化学方程式为(4)常温下,矿物中相关元素可溶性组分物质的量浓度的对数[
 ]与pH的关系如图所示。当溶液中可溶性组分浓度
]与pH的关系如图所示。当溶液中可溶性组分浓度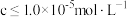 时,可认为已除尽。则“中和”时pH的理论范围为
时,可认为已除尽。则“中和”时pH的理论范围为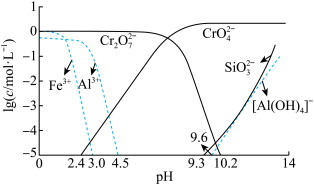
 的酸性废水,用金属铁作阳极、石墨作阴极,一段时间后产生
的酸性废水,用金属铁作阳极、石墨作阴极,一段时间后产生 和
和 沉淀。
沉淀。①若电解后溶液中
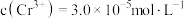 ,则
,则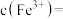
 {已知
{已知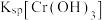
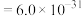 ,
,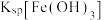 可从第(4)小题图中计算得出}。
可从第(4)小题图中计算得出}。②电解法处理含
 的酸性废水,下列有关原理的说法正确的是
的酸性废水,下列有关原理的说法正确的是A.阳极反应为

B.电解过程中溶液pH不会变化
C.如果石墨作阳极,电解过程不变
D.电路中每转移12mol电子,阳极有1mol
 被还原
被还原
您最近一年使用:0次
名校
解题方法
3 . 亚硝酸钙 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。 溶液能将NO氧化为
溶液能将NO氧化为 。
。
回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通 ,其目的是
,其目的是________ 。通 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是________ 。
(2)仪器a的名称为________ ,装置D中盛装的试剂是________ (填名称),装置E的作用是________ 。
(3)制备的产品 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: ;“还原
;“还原 ”时加入
”时加入 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为________ ,样品中 的纯度为
的纯度为________ (用含m、V的式子表示)。
 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。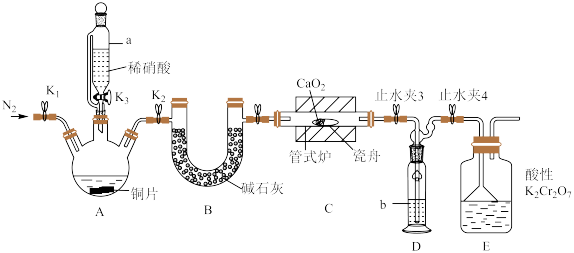
 溶液能将NO氧化为
溶液能将NO氧化为 。
。回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通
 ,其目的是
,其目的是 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是(2)仪器a的名称为
(3)制备的产品
 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: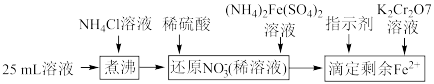
 ;“还原
;“还原 ”时加入
”时加入 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为 的纯度为
的纯度为
您最近一年使用:0次
2024-05-23更新
|
225次组卷
|
5卷引用: 湖南省北师联盟2024届高三下学期模拟考试三模化学试题
名校
4 . 铊(Tl)广泛用于电子、军工、航天、化工、治金、通讯等方面,一种以红铊矿(主要成分是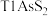 ,含少量
,含少量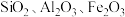 ,等杂质)为原料制备金属铊的流程如图所示。
,等杂质)为原料制备金属铊的流程如图所示。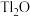 )膜,而失去金属光泽变得灰暗。
)膜,而失去金属光泽变得灰暗。
②TlCl难溶于水,而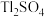 溶于水。
溶于水。
③溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
如下表所示:
回答下列问题:
(1) 中三元素的基态原子含有未成对电子数最多的元素是
中三元素的基态原子含有未成对电子数最多的元素是_______ 。(填元素符号)
(2)“焙烧1”中, 最终转化为
最终转化为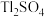 ﹔
﹔ 和
和 也转化为相应的硫酸盐。其中,
也转化为相应的硫酸盐。其中, 转化为
转化为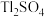 分如下两步完成。请写出第二步反应的化学方程式。
分如下两步完成。请写出第二步反应的化学方程式。
第一步( 与
与 反应):
反应):
第二步:_______ 。
(3)滤渣的成分 属于共价晶体,晶体中每个最小环含有
属于共价晶体,晶体中每个最小环含有_______ 个原子。
(4)“沉铊”步骤中,需要加入过量 ,其原因是
,其原因是_______ 。(用化学用语和简要的文字解释)
(5)向“沉铊”后的滤液中加入生石灰至 时才能外排,此时滤液中的
时才能外排,此时滤液中的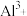 浓度为
浓度为_______  。(指数允许是小数)
。(指数允许是小数)
(6)“焙烧2”中发生的反应为 。则“置换”步骤中发生反应的离子方程式为
。则“置换”步骤中发生反应的离子方程式为_______ 。
(7)所得产品高纯铊应保存在_______ 中。
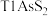 ,含少量
,含少量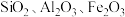 ,等杂质)为原料制备金属铊的流程如图所示。
,等杂质)为原料制备金属铊的流程如图所示。
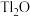 )膜,而失去金属光泽变得灰暗。
)膜,而失去金属光泽变得灰暗。②TlCl难溶于水,而
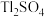 溶于水。
溶于水。③溶液中金属离子开始沉淀和完全沉淀的
 如下表所示:
如下表所示:| 金属离子 |  |  |
开始沉淀的 | 2.2 | 3.5 |
沉淀完全( )的 )的 | 3.2 | 4.7 |
(1)
 中三元素的基态原子含有未成对电子数最多的元素是
中三元素的基态原子含有未成对电子数最多的元素是(2)“焙烧1”中,
 最终转化为
最终转化为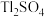 ﹔
﹔ 和
和 也转化为相应的硫酸盐。其中,
也转化为相应的硫酸盐。其中, 转化为
转化为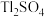 分如下两步完成。请写出第二步反应的化学方程式。
分如下两步完成。请写出第二步反应的化学方程式。第一步(
 与
与 反应):
反应):
第二步:
(3)滤渣的成分
 属于共价晶体,晶体中每个最小环含有
属于共价晶体,晶体中每个最小环含有(4)“沉铊”步骤中,需要加入过量
 ,其原因是
,其原因是(5)向“沉铊”后的滤液中加入生石灰至
 时才能外排,此时滤液中的
时才能外排,此时滤液中的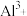 浓度为
浓度为 。(指数允许是小数)
。(指数允许是小数)(6)“焙烧2”中发生的反应为
 。则“置换”步骤中发生反应的离子方程式为
。则“置换”步骤中发生反应的离子方程式为(7)所得产品高纯铊应保存在
您最近一年使用:0次
名校
5 . 工业上以精炼铜的阳极泥为原料(主要成分为Se、CuSe、 等)回收Se。
等)回收Se。 和
和 ,被水吸收时发生反应。
,被水吸收时发生反应。
②Se难溶于水,沸点684.9℃,易与 反应。
反应。
③反应的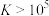 ,代表可完全转化。室温下
,代表可完全转化。室温下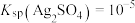 ,
,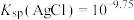 。
。
下列说法正确的是
 等)回收Se。
等)回收Se。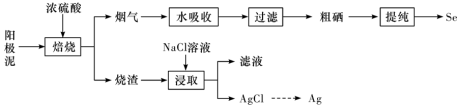
 和
和 ,被水吸收时发生反应。
,被水吸收时发生反应。②Se难溶于水,沸点684.9℃,易与
 反应。
反应。③反应的
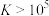 ,代表可完全转化。室温下
,代表可完全转化。室温下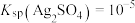 ,
,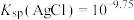 。
。下列说法正确的是
A.理论上,发生反应的 和 和 的物质的量之比为1∶2 的物质的量之比为1∶2 |
| B.在真空中可进行粗硒提纯,可降低体系中硒的沸点 |
C.“滤液”为 溶液 溶液 |
D.加入NaCl溶液浸取时发生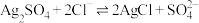 ,该反应过程不可完全转化 ,该反应过程不可完全转化 |
您最近一年使用:0次
名校
解题方法
6 . 新能源汽车工业飞速发展依赖于锂离子电池的新型电极材料的研究取得的重大成果。 可以实现海水中
可以实现海水中 的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含
的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含 及少量
及少量 和
和 )为原料生产高纯
)为原料生产高纯 的工艺流程如图甲。
的工艺流程如图甲。
(1)“浸锰”时, 生成
生成 的离子方程式为
的离子方程式为___________ 。
(2)步骤Ⅱ中, 的萃取率与
的萃取率与 的关系如图乙,当
的关系如图乙,当 后,随
后,随 增大,
增大, 萃取率下降的原因是
萃取率下降的原因是___________ 。 ,若
,若 ,常温下调节
,常温下调节 范围应为
范围应为___________ {已知该条件下,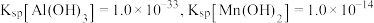 }。
}。
(4)海水中锂的总含量为陆地总含量的5000倍以上,但海水中锂的质量浓度仅为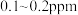 ,从海水中提取锂首先需要对低浓度的
,从海水中提取锂首先需要对低浓度的 进行选择性富集,而
进行选择性富集,而 能够嵌入高纯
能够嵌入高纯 并在一定条件下脱出,据此可以进行
并在一定条件下脱出,据此可以进行 的富集。
的富集。
①以 和高纯
和高纯 为原料,充分混合后在720℃下煅烧
为原料,充分混合后在720℃下煅烧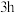 ,冷却至室温后即可得到复合氧化物
,冷却至室温后即可得到复合氧化物 。用
。用 的盐酸在60℃下处理
的盐酸在60℃下处理 ,将其中所有
,将其中所有 置换后得到
置换后得到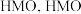 可以和
可以和 反应再生成
反应再生成 ,然后
,然后 与酸作用脱出
与酸作用脱出 从而实现
从而实现 的富集。如此循环处理。合成
的富集。如此循环处理。合成 的化学方程式为
的化学方程式为___________ ;
②用酸处理 时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含
时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含 元素的微粒是
元素的微粒是___________ 。这一副反应对再生后的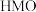 的锂富集性能的影响是
的锂富集性能的影响是___________ 。
(5)利用高纯 实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
步骤1:向 所在的腔室通入海水,启动电源1,使海水中的
所在的腔室通入海水,启动电源1,使海水中的 进入
进入 结构而形成
结构而形成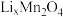 ;
;
步骤2:关闭电源1和海水通道,启动电源2,同时向电极2上通入空气,使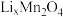 中的
中的 脱出进入腔室2。
脱出进入腔室2。 对
对 的富集效果,将
的富集效果,将 的
的 溶液通入
溶液通入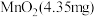 所在腔室,启动电源1,使电流恒定在
所在腔室,启动电源1,使电流恒定在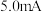 ,累计工作
,累计工作 后发现
后发现 的电极电势快速下降,则
的电极电势快速下降,则 中的
中的
___________ (已知 电子的电量为
电子的电量为 。电流效率为
。电流效率为 )。
)。
②电源2工作时, 电极上发生的电极反应为
电极上发生的电极反应为___________ 。
 可以实现海水中
可以实现海水中 的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含
的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含 及少量
及少量 和
和 )为原料生产高纯
)为原料生产高纯 的工艺流程如图甲。
的工艺流程如图甲。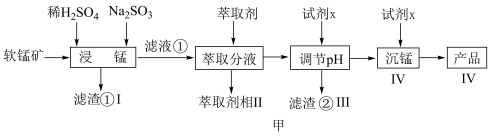
(1)“浸锰”时,
 生成
生成 的离子方程式为
的离子方程式为(2)步骤Ⅱ中,
 的萃取率与
的萃取率与 的关系如图乙,当
的关系如图乙,当 后,随
后,随 增大,
增大, 萃取率下降的原因是
萃取率下降的原因是
 ,若
,若 ,常温下调节
,常温下调节 范围应为
范围应为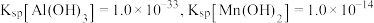 }。
}。(4)海水中锂的总含量为陆地总含量的5000倍以上,但海水中锂的质量浓度仅为
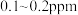 ,从海水中提取锂首先需要对低浓度的
,从海水中提取锂首先需要对低浓度的 进行选择性富集,而
进行选择性富集,而 能够嵌入高纯
能够嵌入高纯 并在一定条件下脱出,据此可以进行
并在一定条件下脱出,据此可以进行 的富集。
的富集。①以
 和高纯
和高纯 为原料,充分混合后在720℃下煅烧
为原料,充分混合后在720℃下煅烧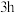 ,冷却至室温后即可得到复合氧化物
,冷却至室温后即可得到复合氧化物 。用
。用 的盐酸在60℃下处理
的盐酸在60℃下处理 ,将其中所有
,将其中所有 置换后得到
置换后得到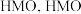 可以和
可以和 反应再生成
反应再生成 ,然后
,然后 与酸作用脱出
与酸作用脱出 从而实现
从而实现 的富集。如此循环处理。合成
的富集。如此循环处理。合成 的化学方程式为
的化学方程式为②用酸处理
 时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含
时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含 元素的微粒是
元素的微粒是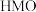 的锂富集性能的影响是
的锂富集性能的影响是(5)利用高纯
 实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:步骤1:向
 所在的腔室通入海水,启动电源1,使海水中的
所在的腔室通入海水,启动电源1,使海水中的 进入
进入 结构而形成
结构而形成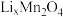 ;
;步骤2:关闭电源1和海水通道,启动电源2,同时向电极2上通入空气,使
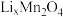 中的
中的 脱出进入腔室2。
脱出进入腔室2。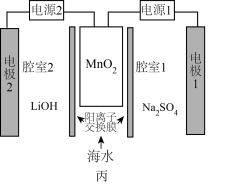
 对
对 的富集效果,将
的富集效果,将 的
的 溶液通入
溶液通入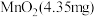 所在腔室,启动电源1,使电流恒定在
所在腔室,启动电源1,使电流恒定在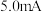 ,累计工作
,累计工作 后发现
后发现 的电极电势快速下降,则
的电极电势快速下降,则 中的
中的
 电子的电量为
电子的电量为 。电流效率为
。电流效率为 )。
)。②电源2工作时,
 电极上发生的电极反应为
电极上发生的电极反应为
您最近一年使用:0次
2024-05-14更新
|
176次组卷
|
2卷引用:湖南省长沙市一中2024届高三下学期高考适应性演练(三)化学试题
解题方法
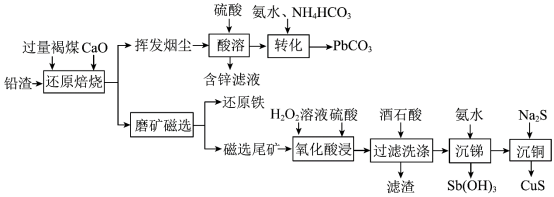
7 . 铅渣由多种氧化物及它们相互结合而形成的化合物、固溶体、共晶混合物所组成。对铅渣进行综合利用,回收其中的有价金属(Cu、Fe、Pb、Zn、Sb)的部分工艺流程如下: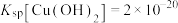 ,
, ,
, 。
。
②金属离子浓度等于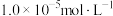 时,可认为其恰好沉淀完全。
时,可认为其恰好沉淀完全。
(1)Sb元素的原子序数为51,与氮元素同主族,其基态电子排布式为[Kr]___________ 。
(2)“还原焙烧”时, 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(3)挥发烟尘中的主要氧化物为 。“转化”过程中,发生反应的离子方程式为
。“转化”过程中,发生反应的离子方程式为___________ 。
(4)“氧化酸浸”过程中,若将物质的量为2mol的 合金(其中Cu与Sb物质的量之比为
合金(其中Cu与Sb物质的量之比为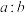 )氧化,至少需要
)氧化,至少需要 的物质的量为
的物质的量为___________ mol(用含a、b的式子表示)。
(5)“过滤洗涤”过程中,加入酒石酸(分子式为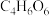 ,结构简式
,结构简式 )发生如下反应:
)发生如下反应: ;
;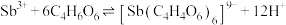 。
。
①上述两个配合物中,提供孤对电子的元素为___________ (填元素符号)。
②“过滤洗涤”时,用酒石酸稀溶液洗涤滤渣而不用水。用酒石酸稀溶液洗涤可减少金属离子的损失,原因为___________ 。
(6)“沉锑”过程中,锑恰好沉淀完全时,溶液中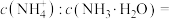
___________ 。
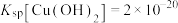 ,
, ,
, 。
。②金属离子浓度等于
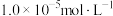 时,可认为其恰好沉淀完全。
时,可认为其恰好沉淀完全。(1)Sb元素的原子序数为51,与氮元素同主族,其基态电子排布式为[Kr]
(2)“还原焙烧”时,
 发生反应的化学方程式为
发生反应的化学方程式为(3)挥发烟尘中的主要氧化物为
 。“转化”过程中,发生反应的离子方程式为
。“转化”过程中,发生反应的离子方程式为(4)“氧化酸浸”过程中,若将物质的量为2mol的
 合金(其中Cu与Sb物质的量之比为
合金(其中Cu与Sb物质的量之比为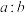 )氧化,至少需要
)氧化,至少需要 的物质的量为
的物质的量为(5)“过滤洗涤”过程中,加入酒石酸(分子式为
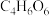 ,结构简式
,结构简式 )发生如下反应:
)发生如下反应: ;
;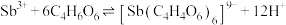 。
。①上述两个配合物中,提供孤对电子的元素为
②“过滤洗涤”时,用酒石酸稀溶液洗涤滤渣而不用水。用酒石酸稀溶液洗涤可减少金属离子的损失,原因为
(6)“沉锑”过程中,锑恰好沉淀完全时,溶液中
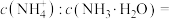
您最近一年使用:0次
名校
解题方法
8 . 重铬酸钾是一种用途广泛的化合物。工业上以铬铁矿[主要成分为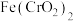 ,还含有
,还含有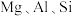 等的氧化物]为主要原料制备重铬酸钾
等的氧化物]为主要原料制备重铬酸钾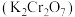 的一种工艺流程如图。回答下列问题:
的一种工艺流程如图。回答下列问题: 和
和 。
。
(1)焙烧”时将铬铁矿粉碎的目的是_______ ,滤渣I中能提炼出一种红色油漆颜料,则焙烧时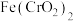 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(2)滤渣Ⅱ的主要成分是_______ 。
(3)“除杂”时需加热,其目的是_______ 。
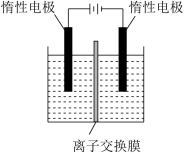
(4)“电解”是利用膜电解技术(装置如图所示),将 转化为
转化为 。阳极池发生反应的总的离子方程式为
。阳极池发生反应的总的离子方程式为_______ 。
(5)加入饱和 溶液后蒸发结晶,能得到
溶液后蒸发结晶,能得到 的原因是
的原因是_______ 。
(6)该流程中,能循环利用的物质有_______ (填化学式)。
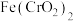 ,还含有
,还含有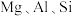 等的氧化物]为主要原料制备重铬酸钾
等的氧化物]为主要原料制备重铬酸钾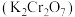 的一种工艺流程如图。回答下列问题:
的一种工艺流程如图。回答下列问题:
 和
和 。
。(1)焙烧”时将铬铁矿粉碎的目的是
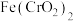 发生反应的化学方程式为
发生反应的化学方程式为(2)滤渣Ⅱ的主要成分是
(3)“除杂”时需加热,其目的是
(4)“电解”是利用膜电解技术(装置如图所示),将
 转化为
转化为 。阳极池发生反应的总的离子方程式为
。阳极池发生反应的总的离子方程式为
(5)加入饱和
 溶液后蒸发结晶,能得到
溶液后蒸发结晶,能得到 的原因是
的原因是(6)该流程中,能循环利用的物质有
您最近一年使用:0次
9 . 以含锌废液(主要成分为 ,含少量的
,含少量的 、
、 )为原料制备
)为原料制备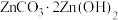 的实验流程如下。设
的实验流程如下。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 ,含少量的
,含少量的 、
、 )为原料制备
)为原料制备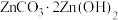 的实验流程如下。设
的实验流程如下。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是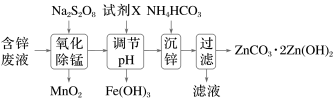
A.1mol过二硫酸钠( )中含有过氧键(-O-O-)数目为 )中含有过氧键(-O-O-)数目为 |
B.“氧化除锰”后的溶液中一定存在: 、 、 、 、 |
C.“调节pH”时试剂X可以选用Zn、ZnO、 等物质 等物质 |
D.“氧化除锰”过程中生成 的离子方程式: 的离子方程式: |
您最近一年使用:0次
解题方法
10 . 氧化钪( )在合金、电光源、催化剂和陶瓷等领域有广泛应用,以链锰矿石(含
)在合金、电光源、催化剂和陶瓷等领域有广泛应用,以链锰矿石(含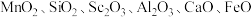 )为原料制备氧化钪的一种工艺流程如图所示。
)为原料制备氧化钪的一种工艺流程如图所示。 ;③草酸可与多种金属离子形成可溶性络合物。
;③草酸可与多种金属离子形成可溶性络合物。
回答下列问题:
(1)为了提高“浸取”效果,可采取的措施有___________ (写出一种)。
(2)“浸取”时铁屑被 氧化为
氧化为 ,该反应的离子方程式是
,该反应的离子方程式是___________ 。
(3)“萃取除铁”时铁和钪的萃取率与O/A(有机相与水相的体积比)的关系如图所示。该工艺中最佳O/A为___________ 。___________ 。
(5)常温下,“沉淀分离”时加入NaOH溶液调节pH至6,滤液中 的浓度为
的浓度为___________ 。
(6)已知 ,
,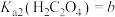 ,
,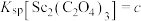 。“沉钪”时,发生反应
。“沉钪”时,发生反应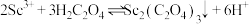 ,此反应的平衡常数
,此反应的平衡常数
___________ (用含a、b、c的代数式表示)。反应过程中,草酸用量过多时,航的沉淀率下降,原因可能是___________ 。
(7)草酸钪晶体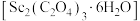 在空气中加热,
在空气中加热, 随温度的变化情况如图所示。550-850 ℃发生反应的化学方程式为
随温度的变化情况如图所示。550-850 ℃发生反应的化学方程式为___________ 。
 )在合金、电光源、催化剂和陶瓷等领域有广泛应用,以链锰矿石(含
)在合金、电光源、催化剂和陶瓷等领域有广泛应用,以链锰矿石(含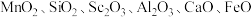 )为原料制备氧化钪的一种工艺流程如图所示。
)为原料制备氧化钪的一种工艺流程如图所示。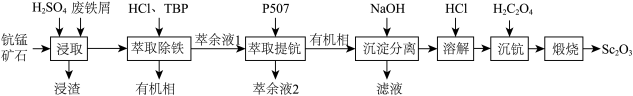
 ;③草酸可与多种金属离子形成可溶性络合物。
;③草酸可与多种金属离子形成可溶性络合物。回答下列问题:
(1)为了提高“浸取”效果,可采取的措施有
(2)“浸取”时铁屑被
 氧化为
氧化为 ,该反应的离子方程式是
,该反应的离子方程式是(3)“萃取除铁”时铁和钪的萃取率与O/A(有机相与水相的体积比)的关系如图所示。该工艺中最佳O/A为

(5)常温下,“沉淀分离”时加入NaOH溶液调节pH至6,滤液中
 的浓度为
的浓度为(6)已知
 ,
,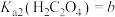 ,
,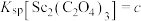 。“沉钪”时,发生反应
。“沉钪”时,发生反应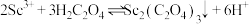 ,此反应的平衡常数
,此反应的平衡常数
(7)草酸钪晶体
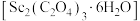 在空气中加热,
在空气中加热, 随温度的变化情况如图所示。550-850 ℃发生反应的化学方程式为
随温度的变化情况如图所示。550-850 ℃发生反应的化学方程式为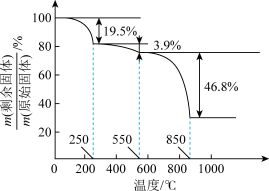
您最近一年使用:0次



