名校
解题方法
1 . 工业上用铝土矿(主要成份是 ,还含有
,还含有 、
、 )提取氧化铝做冶炼铝的原料(纯净的
)提取氧化铝做冶炼铝的原料(纯净的 ),某研究性学习小组设计了如图提取流程:
),某研究性学习小组设计了如图提取流程:
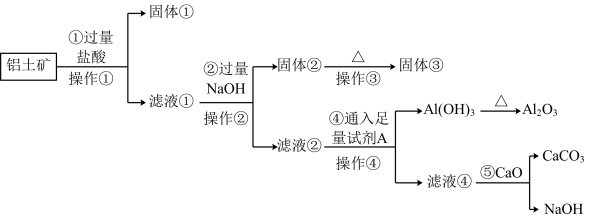
请回答下列问题:
(1)操作①的名称是_______ ,操作③用到的仪器有酒精灯、三脚架、泥三角、_______ 。
(2)写出加入过量 溶液发生反应的主要离子方程式:
溶液发生反应的主要离子方程式:________ 。
(3)流程中的 最好选用
最好选用________ ,发生反应的离子方程式为________ 。
(4)写出反应⑤的化学反应方程式______ ,上述流程中可以循环利用的物质为____ (填化学式)。
(5)有一种含铁、硅等元素的矿石,其主要成分的化学式为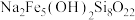 ,该物质中+2价铁与+3价铁的物质的量之比为
,该物质中+2价铁与+3价铁的物质的量之比为______ 。将 该矿石用足量
该矿石用足量______ (填盐酸或硫酸)溶解后,加入过量铜粉使溶液中的铁元素全部变为 ,过滤后滤液用
,过滤后滤液用 的
的 酸性溶液与
酸性溶液与 反应,用去
反应,用去 溶液。该矿石中铁元素的质量分数为
溶液。该矿石中铁元素的质量分数为_______ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
 ,还含有
,还含有 、
、 )提取氧化铝做冶炼铝的原料(纯净的
)提取氧化铝做冶炼铝的原料(纯净的 ),某研究性学习小组设计了如图提取流程:
),某研究性学习小组设计了如图提取流程:
请回答下列问题:
(1)操作①的名称是
(2)写出加入过量
 溶液发生反应的主要离子方程式:
溶液发生反应的主要离子方程式:(3)流程中的
 最好选用
最好选用(4)写出反应⑤的化学反应方程式
(5)有一种含铁、硅等元素的矿石,其主要成分的化学式为
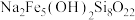 ,该物质中+2价铁与+3价铁的物质的量之比为
,该物质中+2价铁与+3价铁的物质的量之比为 该矿石用足量
该矿石用足量 ,过滤后滤液用
,过滤后滤液用 的
的 酸性溶液与
酸性溶液与 反应,用去
反应,用去 溶液。该矿石中铁元素的质量分数为
溶液。该矿石中铁元素的质量分数为 、
、 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-03-03更新
|
212次组卷
|
3卷引用:湖南省株洲市第一中学2021-2022学年高三上学期期中测试化学试题
名校
解题方法
2 . 某小组利用如图所示装置制备并收集TiCl4(夹持装置略去),并测定由TiCl4制备的纳米xTiO2•yH2O的组成。
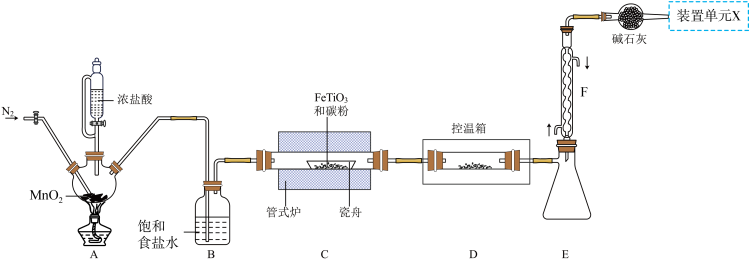
已知:
I. TiCl4高温时能与O2反应,极易水解,能溶于CCl4;
Ⅱ.瓷舟中主反应生成TiCl4、FeCl3(容易二聚成Fe2Cl6)和一种氧化物(有毒气体),还有少量副产物CCL4;
Ⅲ.相关物质的熔沸点如表:
(1)TiCl4摩尔质量大于FeCl3,但沸点却低于FeCl3的原因是_______ 。
(2)写出A中反应的化学方程式_______ ;上述装置存在一处缺陷,会导致TiCl4产率降低,改进的方法是_______ 。
(3)将管式炉加热至900℃时,瓷舟中主要反应的化学方程式为_______ 。
(4)装置E、F的作用为_______ 。
(5)设计实验测定纳米xTiO2•yH2O组成。
已知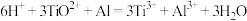 ,
,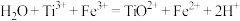
(可选试剂:水、稀硫酸、稀硝酸、氢氧化钠溶液、Al粉、0.1000 的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)
的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)
①取样称重:称取4.675g样品。②酸溶:用足量稀硫酸溶解。
③还原:加入过量Al粉还原至Al粉不再溶解,过滤取滤液定容。定容为500mL,取20.00mL。
④滴定:用0.1000 的NH4Fe(SO4)2标准溶液滴定,标准溶液装在
的NH4Fe(SO4)2标准溶液滴定,标准溶液装在_______ 滴定管(填“酸式”、“碱式”),用_______ 做指示剂,平均消耗标准溶液20.00mL,则xTiO2•yH2O的化学式为_______ 。

已知:
I. TiCl4高温时能与O2反应,极易水解,能溶于CCl4;
Ⅱ.瓷舟中主反应生成TiCl4、FeCl3(容易二聚成Fe2Cl6)和一种氧化物(有毒气体),还有少量副产物CCL4;
Ⅲ.相关物质的熔沸点如表:
TiCl4 | FeCl3 | CCl4 | |
熔点/℃ |
| 306 |
|
沸点/℃ | 136.4 | 315 | 76.8 |
(1)TiCl4摩尔质量大于FeCl3,但沸点却低于FeCl3的原因是
(2)写出A中反应的化学方程式
(3)将管式炉加热至900℃时,瓷舟中主要反应的化学方程式为
(4)装置E、F的作用为
(5)设计实验测定纳米xTiO2•yH2O组成。
已知
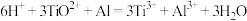 ,
,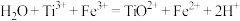
(可选试剂:水、稀硫酸、稀硝酸、氢氧化钠溶液、Al粉、0.1000
 的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)
的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)①取样称重:称取4.675g样品。②酸溶:用足量稀硫酸溶解。
③还原:加入过量Al粉还原至Al粉不再溶解,过滤取滤液定容。定容为500mL,取20.00mL。
④滴定:用0.1000
 的NH4Fe(SO4)2标准溶液滴定,标准溶液装在
的NH4Fe(SO4)2标准溶液滴定,标准溶液装在
您最近一年使用:0次
2024-02-19更新
|
910次组卷
|
3卷引用:湖南省株洲市第一中学2021届高三下学期第二次模拟检测化学试题
湖南省株洲市第一中学2021届高三下学期第二次模拟检测化学试题(已下线)2024届广东省华南师范大学附属中学 广雅中学 深圳中学 广东实验中学高三上学期四校联考化学试题广东省云浮市云安区云安中学2023-2024学年高三下学期3月考试化学试题
名校
3 .  是一种常见的氧化剂,广泛用于生活中作消毒剂。某小组设计实验探究
是一种常见的氧化剂,广泛用于生活中作消毒剂。某小组设计实验探究 的氧化能力与介质pH的关系(已知
的氧化能力与介质pH的关系(已知 溶液呈绿色,酸性条件下发生歧化反应生成
溶液呈绿色,酸性条件下发生歧化反应生成 和
和 )。
)。
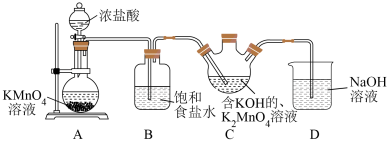
请回答下列问题:
(1)装置A中盛放 溶液的仪器名称为
溶液的仪器名称为___________ ,实验开始前应进行的操作为___________ ,装置D的作用为___________ 。
(2)装置A中浓盐酸在反应中表现出来的性质是___________ 。
(3)由实验推知,A中氧化性:
___________ (填“>”、“<”或“=”) ;若装置C中绿色溶液变为紫红色,
;若装置C中绿色溶液变为紫红色,___________ (填“能”或“不能”)根据此现象判断 的氧化性强于
的氧化性强于 。
。
(4)有关高锰酸钾的实验及现象如表所示。
①已知实验Ⅰ中氧化产物为 ,则实验Ⅰ中发生反应的离子方程式为
,则实验Ⅰ中发生反应的离子方程式为___________ 。
②实验结论:其他条件相同,介质pH越低, 氧化性越
氧化性越___________ (填“强”或“弱”)。
 是一种常见的氧化剂,广泛用于生活中作消毒剂。某小组设计实验探究
是一种常见的氧化剂,广泛用于生活中作消毒剂。某小组设计实验探究 的氧化能力与介质pH的关系(已知
的氧化能力与介质pH的关系(已知 溶液呈绿色,酸性条件下发生歧化反应生成
溶液呈绿色,酸性条件下发生歧化反应生成 和
和 )。
)。
请回答下列问题:
(1)装置A中盛放
 溶液的仪器名称为
溶液的仪器名称为(2)装置A中浓盐酸在反应中表现出来的性质是
(3)由实验推知,A中氧化性:

 ;若装置C中绿色溶液变为紫红色,
;若装置C中绿色溶液变为紫红色, 的氧化性强于
的氧化性强于 。
。(4)有关高锰酸钾的实验及现象如表所示。
| 实验 | 装置 | 试剂R(5 mL含0.1 mol·L  的溶液) 的溶液) | 现象(通入乙烯的体积相等) |
| Ⅰ | 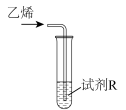 |  溶液 溶液 | 较快产生黑色沉淀 |
| Ⅱ | KOH和 溶液 溶液 | 紫红色溶液较慢变为绿色溶液 | |
| Ⅲ | 稀硫酸和 溶液 溶液 | 紫红色溶液很快变为无色溶液 |
 ,则实验Ⅰ中发生反应的离子方程式为
,则实验Ⅰ中发生反应的离子方程式为②实验结论:其他条件相同,介质pH越低,
 氧化性越
氧化性越
您最近一年使用:0次
2023-10-27更新
|
252次组卷
|
5卷引用:湖南省株洲市第一中学2021届高三第一次模拟检测化学试题
名校
解题方法
4 . 四氯化钛(TiCl4)极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点为−25℃,沸点为136.4℃。某实验小组设计如图装置(部分加热和夹持装置省略),用Cl2与碳粉、TiO2制备TiCl4。下列说法正确的是
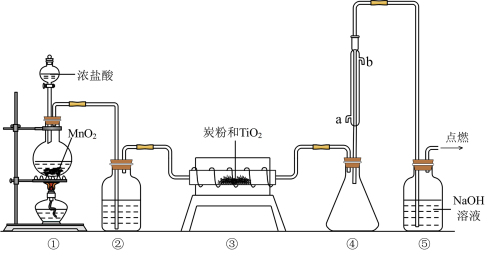

| A.②中应盛装饱和食盐水 |
| B.冷凝管处冷凝水应该由b进a出 |
| C.反应结束时,应先停止①处的加热,后停止③处的加热 |
| D.该设计存在不足,如④、⑤之间缺少防止水蒸气进入④的装置 |
您最近一年使用:0次
2023-03-18更新
|
177次组卷
|
2卷引用:湖南省宁乡市第一高级中学2021届高三第二次模拟考试化学试卷
解题方法
5 . A、B、C、D四种物质之间有下图所示的转化关系。已知A是气体单质,C是红棕色气体。

回答下列问题:
(1)A的电子式:_______ ,C的化学式:_______ 。
(2)在上图D→B的过程中,D表现出强_______ (填“氧化性”或“还原性”)。
(3)写出C→D转化的化学方程式:_______ 。

回答下列问题:
(1)A的电子式:
(2)在上图D→B的过程中,D表现出强
(3)写出C→D转化的化学方程式:
您最近一年使用:0次
名校
6 . I、高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾、次氯酸等还强。工业上制取高铁酸钠的化学方程式是(未配平):Fe(NO3)3+ NaOH + Cl2→ Na2FeO4+ NaNO3+ NaCl + H2O
(1)高铁酸钠中,铁元素的化合价是_______ ;上述制取铁酸钠的反应中,铁元素被_______ (填“还原”或“氧化”)。
(2)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂原因铁元素转化为Fe(OH)3胶体。用饱和氯化铁溶液制备Fe(OH)3胶体方法_______ 。
(3)电子工业常用30%的FeCl3溶液腐蚀覆在绝缘板上的铜箔,制造印刷电路板。
①少量的铜可以完全溶解在FeCl3溶液中,所发生反应的离子方程式为_______ 。
②除去FeCl3溶液中混有的FeCl2可加入或通入_______ 。
A、硝酸 B、稀硫酸 C、氯气 D、氢氧化钠
II、次磷酸(H3PO2)是一种精细磷化工产品,是一元中强酸,具有较强还原性。回答下列问题:
(4)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①利用H3PO2进行化学镀银反应中,氧化剂(Ag+)与还原剂(H3PO2)的物质的量之比为4∶1,则氧化产物为_______ (填化学式)。
②从分类来看,NaH2PO2属于_______ 。
a.正盐 b.酸式盐 c.钠盐 d.氧化物
(5)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。配平白磷与Ba(OH)2溶液反应的化学方程式_______ 。
_______P4 +_______Ba(OH)2 + _______H2O —— _______Ba(H2PO2)2+_______PH3↑
(1)高铁酸钠中,铁元素的化合价是
(2)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂原因铁元素转化为Fe(OH)3胶体。用饱和氯化铁溶液制备Fe(OH)3胶体方法
(3)电子工业常用30%的FeCl3溶液腐蚀覆在绝缘板上的铜箔,制造印刷电路板。
①少量的铜可以完全溶解在FeCl3溶液中,所发生反应的离子方程式为
②除去FeCl3溶液中混有的FeCl2可加入或通入
A、硝酸 B、稀硫酸 C、氯气 D、氢氧化钠
II、次磷酸(H3PO2)是一种精细磷化工产品,是一元中强酸,具有较强还原性。回答下列问题:
(4)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①利用H3PO2进行化学镀银反应中,氧化剂(Ag+)与还原剂(H3PO2)的物质的量之比为4∶1,则氧化产物为
②从分类来看,NaH2PO2属于
a.正盐 b.酸式盐 c.钠盐 d.氧化物
(5)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。配平白磷与Ba(OH)2溶液反应的化学方程式
_______P4 +_______Ba(OH)2 + _______H2O —— _______Ba(H2PO2)2+_______PH3↑
您最近一年使用:0次
2022-10-31更新
|
145次组卷
|
2卷引用:湖南省邵阳市第二中学2021-2022学年高一上学期第一次月考化学试题
解题方法
7 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系:

(1)根据A对应的化合价和物质类别,A为_______ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的含氮化合物有_______ 。
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择_______ 。
(3)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:_______ 。
(4)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。常用的方法是先用热空气吹出Br2,再用SO2水溶液吸收Br2.取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2水溶液吸收Br2反应的化学方程式:_______ 。

(1)根据A对应的化合价和物质类别,A为
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(3)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:
(4)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。常用的方法是先用热空气吹出Br2,再用SO2水溶液吸收Br2.取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2水溶液吸收Br2反应的化学方程式:
您最近一年使用:0次
8 . 醋酸亚铬[(CH3COO)2Cr•H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是____ ,仪器a的名称是____ 。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为____ 。
②同时c中有气体产生,该气体的作用是____ 。
(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是c中产生H2使压强大于大气压;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是____ (冰浴)、过滤、洗涤、干燥。
(4)指出装置d可能存在的缺点____ 。

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为
②同时c中有气体产生,该气体的作用是
(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是c中产生H2使压强大于大气压;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是
(4)指出装置d可能存在的缺点
您最近一年使用:0次
名校
解题方法
9 . 以硅藻土为载体的五氧化二钒( )是接触法生成硫酸的催化剂。从废钒催化剂中回收
)是接触法生成硫酸的催化剂。从废钒催化剂中回收 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
以下是一种废钒催化剂回收工艺路线:
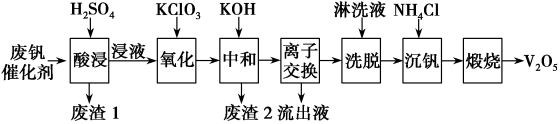
回答下列问题:
(1)“酸浸”时 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为_______ ,同时 转化为
转化为 。“废渣1”的主要成分是
。“废渣1”的主要成分是_______ 。
(2)“氧化”中使 变为
变为 ,则“氧化”环节中还原剂与氧化剂的物质的量之比为
,则“氧化”环节中还原剂与氧化剂的物质的量之比为_______ 。
(3)“离子交换”和“洗脱”可简单表示为: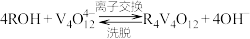 (以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_______ 性(填“酸”或“碱”)。
(4)检验“流出液”中含量最多的阳离子,其实验操作称为_______ 。
(5)“煅烧”中发生反应的化学方程式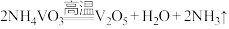 ,写出“沉钒”过程的离子方程式
,写出“沉钒”过程的离子方程式_______ 。
(6)若有1000kg该废钒催化剂,若转化中钒元素利用率为80%,则最多可回收到
_______ kg(保留小数点后一位)。
 )是接触法生成硫酸的催化剂。从废钒催化剂中回收
)是接触法生成硫酸的催化剂。从废钒催化剂中回收 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:| 物质 |  |  |  |  |  |  |
| 质量分数/% | 2.20~2.90 | 2.8~3.32 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时
 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为 转化为
转化为 。“废渣1”的主要成分是
。“废渣1”的主要成分是(2)“氧化”中使
 变为
变为 ,则“氧化”环节中还原剂与氧化剂的物质的量之比为
,则“氧化”环节中还原剂与氧化剂的物质的量之比为(3)“离子交换”和“洗脱”可简单表示为:
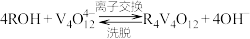 (以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈(4)检验“流出液”中含量最多的阳离子,其实验操作称为
(5)“煅烧”中发生反应的化学方程式
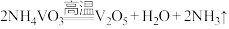 ,写出“沉钒”过程的离子方程式
,写出“沉钒”过程的离子方程式(6)若有1000kg该废钒催化剂,若转化中钒元素利用率为80%,则最多可回收到

您最近一年使用:0次
名校
10 . 锂、铍等金属广泛应用于航空航天、核能和新能源汽车等高新产业。一种从萤石矿(主要含BeO、Li2O、CaF2及少量CaCO3、SiO2、FeO、Fe2O3、Al2O3)中提取的工艺如图:
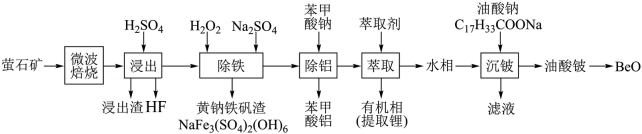
已知:苯甲酸是一元弱酸,白色片状晶体,常温下微溶于水,随温度升高,溶解度增大。
回答下列问题:
(1)“微波焙烧”使矿物内部变得疏松多孔,目的是__________ 。
(2)浸出渣的主要成分是__________ ,“除铁”中可替代H2O2的物质是__________ 。
(3)“除铁”中发生反应的离子方程式:__________ 、__________ 。
(4)“除铝”时,溶液的pH越小,铝的去除率__________ (填“越高”、“越低”或“不变”)。利用“除铝”所得苯甲酸铝沉淀再生苯甲酸的方案为:将苯甲酸铝沉淀溶于热的稀硫酸中,__________ 。
(5)由油酸铍制备BeO的方法是高温焙烧,检验焙烧已完全的操作实验为________ 。

已知:苯甲酸是一元弱酸,白色片状晶体,常温下微溶于水,随温度升高,溶解度增大。
回答下列问题:
(1)“微波焙烧”使矿物内部变得疏松多孔,目的是
(2)浸出渣的主要成分是
(3)“除铁”中发生反应的离子方程式:
(4)“除铝”时,溶液的pH越小,铝的去除率
(5)由油酸铍制备BeO的方法是高温焙烧,检验焙烧已完全的操作实验为
您最近一年使用:0次
2022-05-16更新
|
423次组卷
|
3卷引用:湖南省株洲市第一中学2021届高三下学期第二次模拟检测化学试题
湖南省株洲市第一中学2021届高三下学期第二次模拟检测化学试题山东省肥城市2022届高考适应性训练(一)化学试题(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)

 23.2
23.2

