名校
解题方法
1 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。
Ⅰ.某兴趣小组用Fe2(SO4)3溶液吸收含SO2的尾气(SO2的体积分数约为10%,其余为空气),实验装置如图所示:
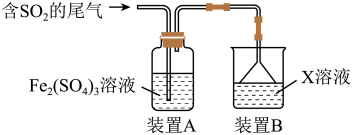
(1)装置A中SO2与Fe2(SO4)3溶液反应生成FeSO4,写出该反应的化学方程式:___________ 。
(2)反应后,若要检验装置A中Fe3+是否过量,可用试剂为___________ ;若要检验SO2是否过量,可用试剂为___________ 。
(3)装置B中所用X溶液常为碱溶液,其作用是___________ 。
(4)若实验测得反应后的装置A中不含有SO2,为测定其中所含FeSO4的物质的量浓度,现进行如下实验:取20.00 mL装置A中溶液,向其中逐滴加入0.100 0 mol/L Ce(SO4)2溶液,发生反应Fe2++Ce4+= Ce3++Fe3+,当反应恰好完全时,共消耗Ce(SO4)2溶液18.00 mL。则FeSO4的物质的量浓度为___________ 。
Ⅱ.工业制硝酸时尾气中含有NO、NO2,可用以下方法吸收:
(5)水吸收法。结合化学方程式说明用水吸收NO2的缺陷___________ 。
(6)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:___________ 。
Ⅰ.某兴趣小组用Fe2(SO4)3溶液吸收含SO2的尾气(SO2的体积分数约为10%,其余为空气),实验装置如图所示:

(1)装置A中SO2与Fe2(SO4)3溶液反应生成FeSO4,写出该反应的化学方程式:
(2)反应后,若要检验装置A中Fe3+是否过量,可用试剂为
(3)装置B中所用X溶液常为碱溶液,其作用是
(4)若实验测得反应后的装置A中不含有SO2,为测定其中所含FeSO4的物质的量浓度,现进行如下实验:取20.00 mL装置A中溶液,向其中逐滴加入0.100 0 mol/L Ce(SO4)2溶液,发生反应Fe2++Ce4+= Ce3++Fe3+,当反应恰好完全时,共消耗Ce(SO4)2溶液18.00 mL。则FeSO4的物质的量浓度为
Ⅱ.工业制硝酸时尾气中含有NO、NO2,可用以下方法吸收:
(5)水吸收法。结合化学方程式说明用水吸收NO2的缺陷
(6)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:
您最近一年使用:0次
名校
解题方法
2 . 三氯化钌( )是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从
)是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从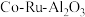 催化剂废料中分离制各
催化剂废料中分离制各 和
和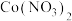 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)基态 原子的价电子排布式为
原子的价电子排布式为___________ 。
(2)“焙烧”后所得固体主要成分为 、
、 、
、 和
和___________ 。
(3)“还原”过程会产生 和
和 沉淀,该反应的化学方程式为
沉淀,该反应的化学方程式为______________________ 。
(4)“酸溶”过程中,先加入盐酸溶解 ,然后加入盐酸羟胺(
,然后加入盐酸羟胺( )得到
)得到 和
和 。则该两种产物的物质的量之比为
。则该两种产物的物质的量之比为___________ 。
(5)“蒸发结晶”在真空度为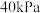 时进行(此时水的沸点是
时进行(此时水的沸点是 ),其目的是
),其目的是___________ 。
(6)若维持 不变,让
不变,让 沉淀完全(
沉淀完全( 浓度不高于
浓度不高于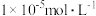 ),则混合体系中
),则混合体系中 的浓度不低于
的浓度不低于___________ 。[已知: ,
,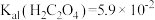 ,
, 结果保留三位小数]
结果保留三位小数]
(7)“沉钴”时,若得到的是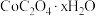 晶体,该反应的离子方程式为
晶体,该反应的离子方程式为______________________ 。
(8)该流程中,还有一种重要成分 未提取,你认为在哪一步骤后进行最合适:
未提取,你认为在哪一步骤后进行最合适:___________ 。
 )是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从
)是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从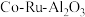 催化剂废料中分离制各
催化剂废料中分离制各 和
和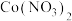 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)基态
 原子的价电子排布式为
原子的价电子排布式为(2)“焙烧”后所得固体主要成分为
 、
、 、
、 和
和(3)“还原”过程会产生
 和
和 沉淀,该反应的化学方程式为
沉淀,该反应的化学方程式为(4)“酸溶”过程中,先加入盐酸溶解
 ,然后加入盐酸羟胺(
,然后加入盐酸羟胺( )得到
)得到 和
和 。则该两种产物的物质的量之比为
。则该两种产物的物质的量之比为(5)“蒸发结晶”在真空度为
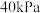 时进行(此时水的沸点是
时进行(此时水的沸点是 ),其目的是
),其目的是(6)若维持
 不变,让
不变,让 沉淀完全(
沉淀完全( 浓度不高于
浓度不高于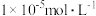 ),则混合体系中
),则混合体系中 的浓度不低于
的浓度不低于 ,
,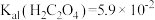 ,
, 结果保留三位小数]
结果保留三位小数](7)“沉钴”时,若得到的是
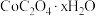 晶体,该反应的离子方程式为
晶体,该反应的离子方程式为(8)该流程中,还有一种重要成分
 未提取,你认为在哪一步骤后进行最合适:
未提取,你认为在哪一步骤后进行最合适:
您最近一年使用:0次
2024-01-09更新
|
1218次组卷
|
5卷引用:湖南省株洲市2023-2024学年高三上学期教学质量统一检测化学试卷
湖南省株洲市2023-2024学年高三上学期教学质量统一检测化学试卷湖南省株洲市2024届高三上学期教学质量统一检测化学试题2024届湖南省长沙市雅礼中学高三下学期3月综合测试(一)化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)大题01 化工流程综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
名校
解题方法
3 . 下列反应的离子方程式正确的是
A.水杨酸与过量碳酸钠溶液反应:2 + +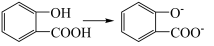 +2 +2 |
B.向碘化亚铁溶液中滴加少量稀硝酸: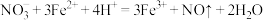 |
C.Mg(HCO3)2溶液中加足量的烧碱溶液: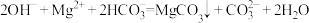 |
D.二元弱酸亚磷酸(H3PO3)溶液中滴加少量的NaOH溶液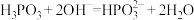 |
您最近一年使用:0次
2023-08-12更新
|
499次组卷
|
4卷引用:湖南省长沙市雅礼中学2023-2024学年高三上学期1月期末化学试题
名校
解题方法
4 . 海水中溴元素主要以 形式存在,工业上从海水中提取溴的流程如下:
形式存在,工业上从海水中提取溴的流程如下:
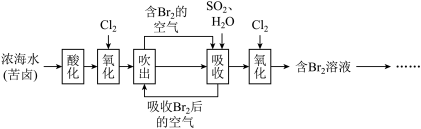
(1)将吹出后的含Br2的空气按一定速率通入吸收塔,用SO2和水进行吸收,写出吸收反应的化学方程式:___________ ,此反应中SO2做___________ (填氧化剂或还原剂)。
(2)工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,完成下列化学方程式:
_______Br2+_______Na2CO3——______NaBrO3+_______CO2+_______________
当有3molBr2参加反应,发生转移的电子的物质的量为___________ 。
(3)用于吸收Br2的SO2是工业制硫酸的重要物质,其中主反应是催化氧化SO2。现将SO2与足量O2置于密闭容器中,在催化剂、500℃条件下发生反应。SO2与SO3的物质的量浓度随时间的变化如图所示,请回答下列问题。

①反应开始至2min末,以SO2 的浓度变化表示该反应的平均速率是___________ ;2min时,反应是否达到化学平衡状态___________ (填“是”或“否”)。
②关于该反应下列说法不正确的是___________ 。
a.催化剂可以增大化学反应速率
b.改变温度或压强,可以实现SO2的完全转化
c.若仅增大容器容积,则该化学反应速率增大
 形式存在,工业上从海水中提取溴的流程如下:
形式存在,工业上从海水中提取溴的流程如下:
(1)将吹出后的含Br2的空气按一定速率通入吸收塔,用SO2和水进行吸收,写出吸收反应的化学方程式:
(2)工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,完成下列化学方程式:
_______Br2+_______Na2CO3——______NaBrO3+_______CO2+________
当有3molBr2参加反应,发生转移的电子的物质的量为
(3)用于吸收Br2的SO2是工业制硫酸的重要物质,其中主反应是催化氧化SO2。现将SO2与足量O2置于密闭容器中,在催化剂、500℃条件下发生反应。SO2与SO3的物质的量浓度随时间的变化如图所示,请回答下列问题。

①反应开始至2min末,以SO2 的浓度变化表示该反应的平均速率是
②关于该反应下列说法不正确的是
a.催化剂可以增大化学反应速率
b.改变温度或压强,可以实现SO2的完全转化
c.若仅增大容器容积,则该化学反应速率增大
您最近一年使用:0次
2023-07-20更新
|
98次组卷
|
3卷引用:湖南省张家界市2022-2023学年高一下学期期末考试化学试题
5 . 对废旧锂离子电池的有效处理可以充分利用资源、保护环境、防止污染。如图是一种典型的酸溶-沉淀法处理钴酸锂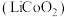 电池的流程。通常在锂离子电池正极材料钴酸锂的表面包覆一层氧化铝,从而延长其使用寿命。
电池的流程。通常在锂离子电池正极材料钴酸锂的表面包覆一层氧化铝,从而延长其使用寿命。

请回答以下问题:
(1)在处理正极材料前,常对其进行粉碎研磨,目的是________ 。
(2)“碱浸”时发生反应的离子方程式为________________ 。
(3)在“中和”时,若选用硫酸,则需严格控制加酸量,最好选用________(填序号)替代稀硫酸。
(4)“酸溶”时的化学方程式为________________ 。酸溶时,温度不能过高,也不能过低,其原因是________________ 。
(5)“沉钴”时发生反应的离子方程式为________________ ,在分离氢氧化钴后,要对其进行洗涤,检验沉淀已洗净的操作为________ 。
(6) 具有两性。
具有两性。 的制备可在
的制备可在 溶液中加稍过量的氨水,而不用
溶液中加稍过量的氨水,而不用 溶液的原因是
溶液的原因是________________ (用化学方程式表示)。
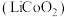 电池的流程。通常在锂离子电池正极材料钴酸锂的表面包覆一层氧化铝,从而延长其使用寿命。
电池的流程。通常在锂离子电池正极材料钴酸锂的表面包覆一层氧化铝,从而延长其使用寿命。
请回答以下问题:
(1)在处理正极材料前,常对其进行粉碎研磨,目的是
(2)“碱浸”时发生反应的离子方程式为
(3)在“中和”时,若选用硫酸,则需严格控制加酸量,最好选用________(填序号)替代稀硫酸。
| A.盐酸 | B.二氧化硫 | C.二氧化碳 | D.高氯酸 |
(5)“沉钴”时发生反应的离子方程式为
(6)
 具有两性。
具有两性。 的制备可在
的制备可在 溶液中加稍过量的氨水,而不用
溶液中加稍过量的氨水,而不用 溶液的原因是
溶液的原因是
您最近一年使用:0次
名校
解题方法
6 . I.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是___________ (填化学式)。
(2)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。
、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:___________ 。
②每生成2mol 转移
转移___________ mol电子,若反应过程中转移了0.5mol电子,则还原产物的物质的量为___________ mol。
II.工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
(3)试剂a是___________ ,操作I用到的玻璃仪器有烧杯、玻璃棒和___________ 。
(4)滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为___________ 。
(5)上述流程中操作III包括___________ 、___________ 、过滤、洗涤。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是
(2)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。
、Cl-、H2O。①请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:
②每生成2mol
 转移
转移II.工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
(3)试剂a是
(4)滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为
(5)上述流程中操作III包括
您最近一年使用:0次
2023-07-15更新
|
364次组卷
|
2卷引用:湖南省衡阳市2022-2023学年高一下学期期末检测化学试题
解题方法
7 . 以某冶金工业产生的废渣(含 、
、 及少量的
及少量的 )为原料,根据如图流程可制备
)为原料,根据如图流程可制备 ,下列说法错误的是
,下列说法错误的是

 、
、 及少量的
及少量的 )为原料,根据如图流程可制备
)为原料,根据如图流程可制备 ,下列说法错误的是
,下列说法错误的是
A.煅烧过程 发生的反应为 发生的反应为 |
B.通入 调pH的目的是为了除去Al元素和Si元素杂质 调pH的目的是为了除去Al元素和Si元素杂质 |
C.该流程中可循环使用的物质是 和 和 |
D.由 转化为 转化为 的过程中需要加入KOH 的过程中需要加入KOH |
您最近一年使用:0次
解题方法
8 . 硝酸盐是水体污染的污染物之一,甲酸在纳米级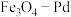 表面分解为活性
表面分解为活性 和
和 ,再经下列历程实现
,再经下列历程实现 的催化还原,进而减少硝酸盐污染。已知
的催化还原,进而减少硝酸盐污染。已知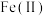 、
、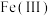 表示二价铁和三价铁。下列说法不正确的是
表示二价铁和三价铁。下列说法不正确的是

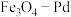 表面分解为活性
表面分解为活性 和
和 ,再经下列历程实现
,再经下列历程实现 的催化还原,进而减少硝酸盐污染。已知
的催化还原,进而减少硝酸盐污染。已知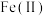 、
、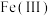 表示二价铁和三价铁。下列说法不正确的是
表示二价铁和三价铁。下列说法不正确的是
| A.甲酸分解时有极性键的断裂和生成 |
B. 、 、 的VSEPR模型相同 的VSEPR模型相同 |
C.反应历程中生成的 可调节体系pH,有增强 可调节体系pH,有增强 氧化性的作用 氧化性的作用 |
D.该过程的总反应为 |
您最近一年使用:0次
9 . 以铁镍合金(含少量铜)为原料,生产电极材料 的部分工艺流程如下:
的部分工艺流程如下:

已知:常温下,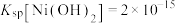 ,
,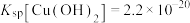 ,
,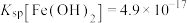 ;
; 。
。
回答下列问题:
(1)基态 原子价层电子轨道表示式是
原子价层电子轨道表示式是______ ;
(2)“酸溶”时 转化为
转化为 ,该过程中温度控制在
,该过程中温度控制在 的原因是
的原因是______ ;
(3)“氧化”时 的作用是(用离子方程式表示)
的作用是(用离子方程式表示)______ ;
(4)“除铜”时若选用 溶液,会导致部分
溶液,会导致部分 也产生沉淀,当常温时溶液中
也产生沉淀,当常温时溶液中 、
、 沉淀同时存在时,溶液中
沉淀同时存在时,溶液中
______ ;
(5)“沉镍”时得到碳酸镍 沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得
沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得 ,该反应的化学方程式是
,该反应的化学方程式是______ ;
(6)金属镍的配合物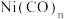 的中心原子的价电子数与配体提供的成键电子数之和为18,则
的中心原子的价电子数与配体提供的成键电子数之和为18,则
______ ; 与
与 结构相似,
结构相似, 分子内
分子内 键与
键与 键个数之比为
键个数之比为______ 。
 的部分工艺流程如下:
的部分工艺流程如下:
已知:常温下,
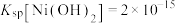 ,
,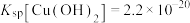 ,
,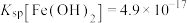 ;
; 。
。回答下列问题:
(1)基态
 原子价层电子轨道表示式是
原子价层电子轨道表示式是(2)“酸溶”时
 转化为
转化为 ,该过程中温度控制在
,该过程中温度控制在 的原因是
的原因是(3)“氧化”时
 的作用是(用离子方程式表示)
的作用是(用离子方程式表示)(4)“除铜”时若选用
 溶液,会导致部分
溶液,会导致部分 也产生沉淀,当常温时溶液中
也产生沉淀,当常温时溶液中 、
、 沉淀同时存在时,溶液中
沉淀同时存在时,溶液中
(5)“沉镍”时得到碳酸镍
 沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得
沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得 ,该反应的化学方程式是
,该反应的化学方程式是(6)金属镍的配合物
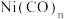 的中心原子的价电子数与配体提供的成键电子数之和为18,则
的中心原子的价电子数与配体提供的成键电子数之和为18,则
 与
与 结构相似,
结构相似, 分子内
分子内 键与
键与 键个数之比为
键个数之比为
您最近一年使用:0次
10 . “绿水青山就是金山银山”是重要的发展理念,研究 、
、 、
、 等大气污染物的处理方法具有重要意义。
等大气污染物的处理方法具有重要意义。
(1)钙基固硫技术可减少 排放,但煤炭燃烧过程中产生的
排放,但煤炭燃烧过程中产生的 又会与
又会与 发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
反应①:
反应②:
反应③:
___________ (填含 、
、 的代数式)。
的代数式)。
(2) 的排放主要来自汽车尾气。
的排放主要来自汽车尾气。
①有人利用尿素水溶液热解产生的 去除尾气中的
去除尾气中的 ,流程如图1;
,流程如图1;

a.尿素 中氮元素的化合价为
中氮元素的化合价为___________ 。
b.若氧化处理后的尾气中混有 ,此时催化剂表面会覆盖部分硫酸盐,导致催化剂中毒,降低
,此时催化剂表面会覆盖部分硫酸盐,导致催化剂中毒,降低 的去除率。试分析硫酸盐的产生过程:
的去除率。试分析硫酸盐的产生过程:___________ 。
②某种脱硝反应机理如图2所示, 参与的反应
参与的反应 的方程式为
的方程式为___________ 。

③实验室模拟汽车尾气转化器中的反应 。在2L的恒容密闭容器中,投入
。在2L的恒容密闭容器中,投入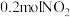 和
和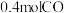 ,一段时间后反应达到平衡状态,测得
,一段时间后反应达到平衡状态,测得 的转化率为
的转化率为 。该温度下,反应的平衡常数为
。该温度下,反应的平衡常数为___________ 。
④一定条件下,反应 的反应历程如图3所示,该历程分三步进行,其中第
的反应历程如图3所示,该历程分三步进行,其中第___________ 步是决速步骤。在恒温恒容密闭容器中进行上述反应,原料组成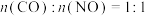 ,体系达到平衡时
,体系达到平衡时 的体积分数为
的体积分数为 ,则
,则 的平衡转化率为
的平衡转化率为___________ 。

 、
、 、
、 等大气污染物的处理方法具有重要意义。
等大气污染物的处理方法具有重要意义。(1)钙基固硫技术可减少
 排放,但煤炭燃烧过程中产生的
排放,但煤炭燃烧过程中产生的 又会与
又会与 发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:反应①:

反应②:

反应③:

 、
、 的代数式)。
的代数式)。(2)
 的排放主要来自汽车尾气。
的排放主要来自汽车尾气。①有人利用尿素水溶液热解产生的
 去除尾气中的
去除尾气中的 ,流程如图1;
,流程如图1;
a.尿素
 中氮元素的化合价为
中氮元素的化合价为b.若氧化处理后的尾气中混有
 ,此时催化剂表面会覆盖部分硫酸盐,导致催化剂中毒,降低
,此时催化剂表面会覆盖部分硫酸盐,导致催化剂中毒,降低 的去除率。试分析硫酸盐的产生过程:
的去除率。试分析硫酸盐的产生过程:②某种脱硝反应机理如图2所示,
 参与的反应
参与的反应 的方程式为
的方程式为
③实验室模拟汽车尾气转化器中的反应
 。在2L的恒容密闭容器中,投入
。在2L的恒容密闭容器中,投入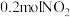 和
和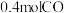 ,一段时间后反应达到平衡状态,测得
,一段时间后反应达到平衡状态,测得 的转化率为
的转化率为 。该温度下,反应的平衡常数为
。该温度下,反应的平衡常数为④一定条件下,反应
 的反应历程如图3所示,该历程分三步进行,其中第
的反应历程如图3所示,该历程分三步进行,其中第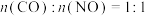 ,体系达到平衡时
,体系达到平衡时 的体积分数为
的体积分数为 ,则
,则 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
2023-07-06更新
|
97次组卷
|
2卷引用:湖南省衡阳市一中2022-2023学年高二下学期期末考试化学试题



