名校
1 . 蛇纹石是一类含水富镁硅酸盐矿物,主要成分为MgO和SiO2,含少量Fe、Ni的氧化物。可用于生产重要无机化工产品碱式碳酸镁[Mg2(OH)2CO3]。其制备流程如图所示:
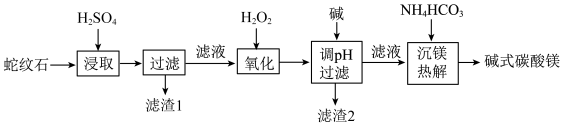
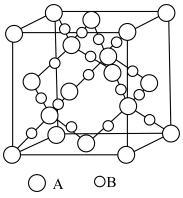
(1)滤渣1的主要成分从性质上来分,属于_______ 氧化物(填“酸性”“两性”或“碱性”),其用途很广泛,请写出一种:_______ 。如图表示该物质晶体的晶胞结构,1个该晶胞中含有_______ 个A-B键。
(2)滤渣2的主要成分是Fe(OH)3和Ni(OH)2,“氧化”过程中发现所用H2O2远高于理论用量,造成这一结果的主要原因有:①“氧化”过程中放热,温度升高加快了H2O2的分解速率、②_______ 。以下_______ (填序号)可以检验“氧化”过程已完全。
A.KSCN溶液 B.酸性KMnO4溶液 C.K3[Fe(CN)6]溶液 D.NaOH溶液
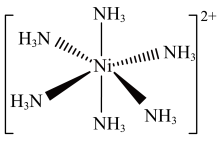
(3)Ni2+易形成[Ni(NH3)6]2+配合物,若[Ni(NH3)6]2+为正八面体构型(如图所示),则[Ni(CO)2(NH3)4]2+的结构有_______ 种。
(4)“沉镁热解”由连续的两步完成,第一步:沉镁生成正碳酸镁(MgCO3·3H2O),第二步:将正碳酸镁热解生成碱式碳酸镁。写出第一步的化学方程式:_______ 。
(5)用x吨含3MgO·2SiO2·2H2O(摩尔质量为a g/mol)为80%蛇纹石为原料,按以上流程制取[Mg2(OH)2CO3](摩尔质量为bg/mol),制得产品y吨,制取过程中镁元素的损失率为_______ ×100%(用含x、y、a、b的式子表示)。

(1)滤渣1的主要成分从性质上来分,属于

(2)滤渣2的主要成分是Fe(OH)3和Ni(OH)2,“氧化”过程中发现所用H2O2远高于理论用量,造成这一结果的主要原因有:①“氧化”过程中放热,温度升高加快了H2O2的分解速率、②
A.KSCN溶液 B.酸性KMnO4溶液 C.K3[Fe(CN)6]溶液 D.NaOH溶液
(3)Ni2+易形成[Ni(NH3)6]2+配合物,若[Ni(NH3)6]2+为正八面体构型(如图所示),则[Ni(CO)2(NH3)4]2+的结构有

(4)“沉镁热解”由连续的两步完成,第一步:沉镁生成正碳酸镁(MgCO3·3H2O),第二步:将正碳酸镁热解生成碱式碳酸镁。写出第一步的化学方程式:
(5)用x吨含3MgO·2SiO2·2H2O(摩尔质量为a g/mol)为80%蛇纹石为原料,按以上流程制取[Mg2(OH)2CO3](摩尔质量为bg/mol),制得产品y吨,制取过程中镁元素的损失率为
您最近一年使用:0次
2024-02-11更新
|
228次组卷
|
2卷引用:上海市宜川中学2023-2024学年高三上学期12月考试化学试题
名校
解题方法
2 . 为纪念元素周期表诞生150周年,IUPAC等向世界介绍了118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“ ,
, 、
、 ”元素的代言人。回答下列问题:
”元素的代言人。回答下列问题:
(1)根据汞的原子结构示意图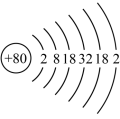 判断,汞在第
判断,汞在第___________ 周期。工业上冶炼金属汞的方法为___________ 。
(2)硒(Se)与硫位于同一主族,均是生命必需元素。下列推断不正确的是___________ 。
A.硒元素的最低负化合价为 价
价
B.还原性: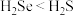
C.二氧化硒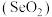 具有还原性
具有还原性
(3)氮是自然界各种生物体生命活动不可缺少的重要元素,磷(P)、砷(As)也是氮族元素。
①砷有多种同位素原子,其中稳定的核素是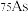 ,它的中子数为
,它的中子数为___________ 。
②已知 与
与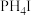 的性质相似,则对
的性质相似,则对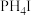 性质的推测正确的是
性质的推测正确的是___________ 。
A.含有离子键和共价键
B.能与 溶液反应
溶液反应
C.加热充分分解时与 分解产物的种类完全一样
分解产物的种类完全一样
③下列关于第ⅤA族元素及其化合物的说法正确的是___________ 。
A.热稳定性:
B.As的氧化物的水化物是强碱
C.简单离子半径随原子序数递增而增大
(4)砷酸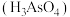 可用于制造杀虫剂、药物等。
可用于制造杀虫剂、药物等。 溶于稀硝酸中可得砷酸,此反应的化学方程式为
溶于稀硝酸中可得砷酸,此反应的化学方程式为___________ 。
 ,
, 、
、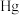 ”元素的代言人。回答下列问题:
”元素的代言人。回答下列问题:(1)根据汞的原子结构示意图
 判断,汞在第
判断,汞在第(2)硒(Se)与硫位于同一主族,均是生命必需元素。下列推断不正确的是
A.硒元素的最低负化合价为
 价
价B.还原性:
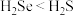
C.二氧化硒
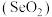 具有还原性
具有还原性(3)氮是自然界各种生物体生命活动不可缺少的重要元素,磷(P)、砷(As)也是氮族元素。
①砷有多种同位素原子,其中稳定的核素是
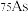 ,它的中子数为
,它的中子数为②已知
 与
与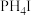 的性质相似,则对
的性质相似,则对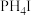 性质的推测正确的是
性质的推测正确的是A.含有离子键和共价键
B.能与
 溶液反应
溶液反应C.加热充分分解时与
 分解产物的种类完全一样
分解产物的种类完全一样③下列关于第ⅤA族元素及其化合物的说法正确的是
A.热稳定性:

B.As的氧化物的水化物是强碱
C.简单离子半径随原子序数递增而增大
(4)砷酸
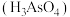 可用于制造杀虫剂、药物等。
可用于制造杀虫剂、药物等。 溶于稀硝酸中可得砷酸,此反应的化学方程式为
溶于稀硝酸中可得砷酸,此反应的化学方程式为
您最近一年使用:0次
2024-02-11更新
|
144次组卷
|
3卷引用:上海市宜川中学2023-2024学年高三上学期12月考试化学试题
名校
3 . I.人类活动中的碳排放无可避免。
(1)配平下列反应,并标出电子转移的方向和数目。___________
___________CH4+___________NO2 ___________NO+___________CO2+___________H2O
___________NO+___________CO2+___________H2O
(2)有一种处理废水中的HCOOH的微型原电池。电池含有Fe-C,使用时通入空气,便可以在___________ 生成H2O2。
A.阴极 B.负极 C.阳极 D.正极
写出H2O2与HCOOH反应生成CO2的化学方程式:___________ 。
Ⅱ.一种富集CO2的原电池模拟装置如下图。
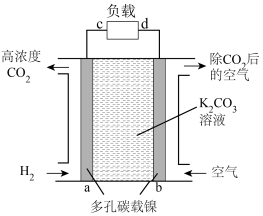
(3)b极为___________ 极(填“正”或“负”),a电极上发生的电极反应为___________ 。
(4)上述电极材料采用多孔碳载镍,“多孔”的优点是___________ 。
(5)该装置若消耗2 mol H2,则理论上在b极除去CO2的体积约为___________ L(标准状况下)。
(1)配平下列反应,并标出电子转移的方向和数目。
___________CH4+___________NO2
 ___________NO+___________CO2+___________H2O
___________NO+___________CO2+___________H2O(2)有一种处理废水中的HCOOH的微型原电池。电池含有Fe-C,使用时通入空气,便可以在
A.阴极 B.负极 C.阳极 D.正极
写出H2O2与HCOOH反应生成CO2的化学方程式:
Ⅱ.一种富集CO2的原电池模拟装置如下图。

(3)b极为
(4)上述电极材料采用多孔碳载镍,“多孔”的优点是
(5)该装置若消耗2 mol H2,则理论上在b极除去CO2的体积约为
您最近一年使用:0次
名校
4 . 氨气是重要的化工原料,氨水、硝酸盐、铵盐等均可作化肥产品。
(1)在VL浓度为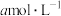 的氨水中滴加等体积
的氨水中滴加等体积 的盐酸,使pH=7,则产物中一水合氨浓度为
的盐酸,使pH=7,则产物中一水合氨浓度为___________  。
。
(2)在自然界的氮循环过程中,硝化细菌将土壤中的 转化为
转化为 后,土壤中的O2进一步将
后,土壤中的O2进一步将 氧化为
氧化为 ,在氧气较少的环境下,
,在氧气较少的环境下, 又可以在反硝化细菌的作用下与
又可以在反硝化细菌的作用下与 反应,使氮以N2形式放出。氧气与
反应,使氮以N2形式放出。氧气与 反应时,反应物
反应时,反应物 与O2的物质的量之比为
与O2的物质的量之比为___________ ,写出 与
与 作用生成N2的离子方程式
作用生成N2的离子方程式___________ 。
(1)在VL浓度为
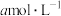 的氨水中滴加等体积
的氨水中滴加等体积 的盐酸,使pH=7,则产物中一水合氨浓度为
的盐酸,使pH=7,则产物中一水合氨浓度为 。
。(2)在自然界的氮循环过程中,硝化细菌将土壤中的
 转化为
转化为 后,土壤中的O2进一步将
后,土壤中的O2进一步将 氧化为
氧化为 ,在氧气较少的环境下,
,在氧气较少的环境下, 又可以在反硝化细菌的作用下与
又可以在反硝化细菌的作用下与 反应,使氮以N2形式放出。氧气与
反应,使氮以N2形式放出。氧气与 反应时,反应物
反应时,反应物 与O2的物质的量之比为
与O2的物质的量之比为 与
与 作用生成N2的离子方程式
作用生成N2的离子方程式
您最近一年使用:0次
名校
5 . 氮是大气中含量最多的一种元素,气及其化合物在生产、生活中有着重要作用。请回答:
(1)下列变化属于“氮的固定”的是___________ (填字母)。
a.植物从土壤中吸收氮肥
b.将空气中的氮气转变为氮的化合物
c.硝酸和氨气反应生成氮肥
d.大豆的根瘤菌将含氮的化合物转变为植物蛋白质
(2)汽车尾气中的CO、 在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出NO被CO还原的化学方程式:
在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出NO被CO还原的化学方程式:___________ 。
(3)已知铜在常温下能被稀 溶解。①写出该反应的化学方程式并用单线桥法标出反应中电子转移的方向和数目:
溶解。①写出该反应的化学方程式并用单线桥法标出反应中电子转移的方向和数目:___________ 。
②在反应中,起氧化作用的 与起酸性作用的
与起酸性作用的 的分子个数之比为
的分子个数之比为___________ 。
(1)下列变化属于“氮的固定”的是
a.植物从土壤中吸收氮肥
b.将空气中的氮气转变为氮的化合物
c.硝酸和氨气反应生成氮肥
d.大豆的根瘤菌将含氮的化合物转变为植物蛋白质
(2)汽车尾气中的CO、
 在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出NO被CO还原的化学方程式:
在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出NO被CO还原的化学方程式:(3)已知铜在常温下能被稀
 溶解。①写出该反应的化学方程式并用单线桥法标出反应中电子转移的方向和数目:
溶解。①写出该反应的化学方程式并用单线桥法标出反应中电子转移的方向和数目:②在反应中,起氧化作用的
 与起酸性作用的
与起酸性作用的 的分子个数之比为
的分子个数之比为
您最近一年使用:0次
6 . 氯及其化合物在日常生活中有广泛应用。某实验小组设计多组实验,对氯气及氯的化合物的性质进行研究
I.氯气的制备与性质研究
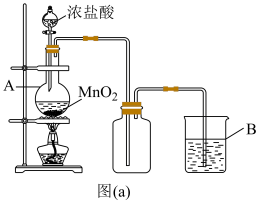
(1)实验室中常用如图(a)所示的装置制备氯气,反应的化学方程式为___________ 。
(2)图中仪器A的名称是___________ 。
(3)装置B内的溶液可以是___________ 。
(4)实验室中常用图(b)所示的装置制备氯气,并同时得到较浓的烧碱溶液。
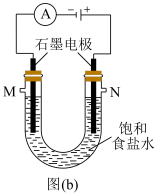
①图(b)反应的化学方程式为___________ 。
②检验制得的烧碱溶液中是否含有NaCl的实验方法是___________ 。
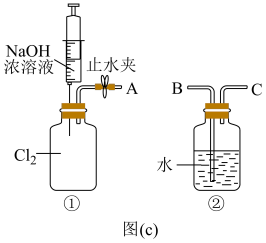
③用图(c)所示的组合装置验证氯气与烧碱溶液的反应。将A与B连接,打开止水夹,用注射器注入过量NaOH浓溶液,观察到的现象有___________ ;若其它操作不变,将A与C连接,②中观察到的现象有___________ 。
Ⅱ.次氯酸是重要的含氯化合物,应用于杀菌消毒、漂白等领域。学习小组以Cl2O为原料制备HClO。
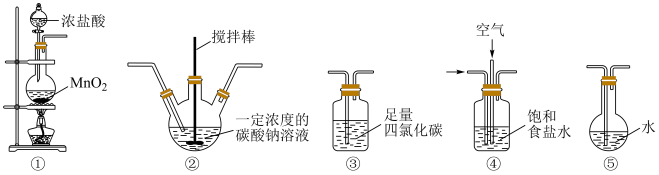
i.常温常压下Cl2O是一种黄绿色气体
ii.将氯气和空气(不参与反应)通入足量的Na2CO3溶液,发生反应生成Cl2O。
iii.Cl2O易溶于水并与水立即反应生成HClO
iv.已知:HClO+2I-+H+=I2+Cl-+H2O,I2+2 =2I-+
=2I-+
(5)装置③中的液体不可燃、不助燃也不导电,关于其用途正确的是___________。
(6)各装置的连接顺序为___________ 。
①→___________→___________→___________→___________
(7)装置②中发生的化学反应中氧化产物与还原产物的物质的量之比为___________ 。
(8)装置④的作用有___________ 。(至少写出2点)
I.氯气的制备与性质研究

(1)实验室中常用如图(a)所示的装置制备氯气,反应的化学方程式为
(2)图中仪器A的名称是
(3)装置B内的溶液可以是
(4)实验室中常用图(b)所示的装置制备氯气,并同时得到较浓的烧碱溶液。

①图(b)反应的化学方程式为
②检验制得的烧碱溶液中是否含有NaCl的实验方法是
③用图(c)所示的组合装置验证氯气与烧碱溶液的反应。将A与B连接,打开止水夹,用注射器注入过量NaOH浓溶液,观察到的现象有

Ⅱ.次氯酸是重要的含氯化合物,应用于杀菌消毒、漂白等领域。学习小组以Cl2O为原料制备HClO。

i.常温常压下Cl2O是一种黄绿色气体
ii.将氯气和空气(不参与反应)通入足量的Na2CO3溶液,发生反应生成Cl2O。
iii.Cl2O易溶于水并与水立即反应生成HClO
iv.已知:HClO+2I-+H+=I2+Cl-+H2O,I2+2
 =2I-+
=2I-+
(5)装置③中的液体不可燃、不助燃也不导电,关于其用途正确的是___________。
| A.可浮于水溶液上方——隔绝空气 | B.与水互不相溶——萃取剂 |
| C.可隔绝空气——灭火剂 | D.遇碘变色——指示剂 |
(6)各装置的连接顺序为
①→___________→___________→___________→___________
(7)装置②中发生的化学反应中氧化产物与还原产物的物质的量之比为
(8)装置④的作用有
您最近一年使用:0次
名校
解题方法
7 . 常温下0.1mol/LFe2(SO4)3溶液中,各组离子能大量共存的是
A.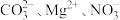 | B.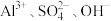 |
C.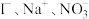 | D. |
您最近一年使用:0次
2024-02-02更新
|
83次组卷
|
2卷引用:上海市建平中学2023-2024学年高一上学期期末教学质量检测化学试卷
8 . 高铁酸钾(K2FeO4)是一种新型高效的水处理剂,在碱性溶液中较稳定。工业上有干法与湿法两种制备高铁酸钾的方法。(已知:Fe3++3H2O⇌Fe(OH)3+3H+)
(1)高铁酸钾可用于杀菌消毒,是因为它具有强___________ 性。
(2)高铁酸钾被用于消毒后,产物与水形成一种分散系,其中的分散质能使得水中的悬浮杂质聚沉,方便除去,这是因为________ 。这种分散系区分于其他分散系的最本质区别是_________ 。
(3)在使用高铁酸钾时,常通过测定其纯度来判断是否变质。K2FeO4在硫酸溶液中发生如下反应:______ +______H+=_____O2↑+______Fe3++_______。
+______H+=_____O2↑+______Fe3++_______。
①完成上述离子方程式:___________ 。
②现取10.00g样品,加入稀硫酸完全反应后,共收集到0.8064L气体(已换算成标准状况)。则样品中高铁酸钾的质量分数约为___________ 。(计算结果保留到0.1%)
湿法制备高铁酸钾的流程如下图。
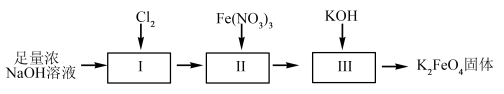
(4)过程II为碱性条件下制备高铁酸钠。写出过程II中反应的离子方程式,并标出电子转移方向和数目。___________ ,反应每生成1molCl-转移的电子数目为___________ 。
(5)湿法制备时,不同的温度下,不同质量浓度的Fe3+对K2FeO4生成率有不同影响,由下图可知工业生产中最佳条件(温度和Fe3+的质量浓度)为___________。

(1)高铁酸钾可用于杀菌消毒,是因为它具有强
(2)高铁酸钾被用于消毒后,产物与水形成一种分散系,其中的分散质能使得水中的悬浮杂质聚沉,方便除去,这是因为
(3)在使用高铁酸钾时,常通过测定其纯度来判断是否变质。K2FeO4在硫酸溶液中发生如下反应:______
 +______H+=_____O2↑+______Fe3++_______。
+______H+=_____O2↑+______Fe3++_______。①完成上述离子方程式:
②现取10.00g样品,加入稀硫酸完全反应后,共收集到0.8064L气体(已换算成标准状况)。则样品中高铁酸钾的质量分数约为
湿法制备高铁酸钾的流程如下图。

(4)过程II为碱性条件下制备高铁酸钠。写出过程II中反应的离子方程式,并标出电子转移方向和数目。
(5)湿法制备时,不同的温度下,不同质量浓度的Fe3+对K2FeO4生成率有不同影响,由下图可知工业生产中最佳条件(温度和Fe3+的质量浓度)为___________。

| A.24℃,75g∙L-1 | B.26℃,75g∙L-1 | C.28℃,75g∙L-1 | D.22℃,80g∙L-1 |
您最近一年使用:0次
名校
解题方法
9 . 开发和利用海洋资源是当前科学研究的一项重要任务,下面是学生模拟工业上提溴和海带提碘的流程。
Ⅰ.某小组在实验室模拟工业提溴的流程(见下图),设计下图的装置进行实验。
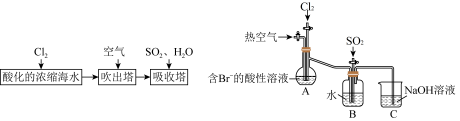
回答下列问题:
(1)实验中先向A中通入 ,反应的离子方程式是
,反应的离子方程式是___________ 。
(2)A中产生的气体被B中的水溶液吸收,反应的离子方程式为___________ 。
(3)从氧化还原角度分析,上述反应 在该反应中体现了
在该反应中体现了___________ 性,下列试剂中能代替水溶液的是___________ 。
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.氯水
溶液 D.氯水
(4)为将B中的溴元素转化为液溴,向反应后B装置的溶液中通入氯气,充分反应,再加入苯,后续的实验操作步骤包含___________。
(5)将 海水浓缩后最终得到
海水浓缩后最终得到 ,若提取率为70%,则海水中溴元素的浓度为
,若提取率为70%,则海水中溴元素的浓度为___________  。
。
Ⅱ.为了从海带中提取碘,该小组设计如下实验:
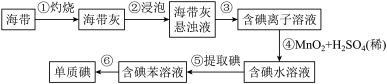
(6)步骤④的作用是___________ 。
A.浓缩 B.氧化 C.提取
(7)步骤⑤中选用苯提取碘的原因是___________。
(8)近年来,随着聚酯工业的快速发展, 的需求量和
的需求量和 的产出量随之迅速增长。因此,将
的产出量随之迅速增长。因此,将 转化为
转化为 的技术成为科学研究的热点。科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如图所示:
的技术成为科学研究的热点。科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如图所示:
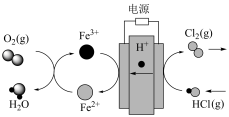
写出上述工艺将 转化为
转化为 的总反应的化学方程式
的总反应的化学方程式___________ 。
Ⅰ.某小组在实验室模拟工业提溴的流程(见下图),设计下图的装置进行实验。

回答下列问题:
(1)实验中先向A中通入
 ,反应的离子方程式是
,反应的离子方程式是(2)A中产生的气体被B中的水溶液吸收,反应的离子方程式为
(3)从氧化还原角度分析,上述反应
 在该反应中体现了
在该反应中体现了A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.氯水
溶液 D.氯水(4)为将B中的溴元素转化为液溴,向反应后B装置的溶液中通入氯气,充分反应,再加入苯,后续的实验操作步骤包含___________。
| A.过滤 | B.萃取、分液 | C.结晶 | D.蒸馏 |
(5)将
 海水浓缩后最终得到
海水浓缩后最终得到 ,若提取率为70%,则海水中溴元素的浓度为
,若提取率为70%,则海水中溴元素的浓度为 。
。Ⅱ.为了从海带中提取碘,该小组设计如下实验:

(6)步骤④的作用是
A.浓缩 B.氧化 C.提取
(7)步骤⑤中选用苯提取碘的原因是___________。
| A.碘易溶于苯 | B.苯的密度比水小 |
| C.苯与水不互溶 | D.苯易挥发 |
(8)近年来,随着聚酯工业的快速发展,
 的需求量和
的需求量和 的产出量随之迅速增长。因此,将
的产出量随之迅速增长。因此,将 转化为
转化为 的技术成为科学研究的热点。科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如图所示:
的技术成为科学研究的热点。科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如图所示:
写出上述工艺将
 转化为
转化为 的总反应的化学方程式
的总反应的化学方程式
您最近一年使用:0次
名校
解题方法
10 . 含氯消毒剂是指溶于水产生具有杀微生物活性的次氯酸的消毒剂,其杀微生物有效成分常以有效氯表示。这类消毒剂包括无机氯化合物(如次氯酸钠、次氯酸钙、氯化磷酸三钠)、有机氯化合物(如二氯异氰尿酸钠、三氯异氰尿酸、氯铵T等)。游泳池中的水通常为蓝色,是因为消毒和保证水质,加入了适量的胆矾和氯系消毒剂。然而,2016年里约奥运会跳水池中的水却由蓝色变成绿色,事后调查发现,是误加入的双氧水使前一天泳池中的含氯消毒剂失效,助长了藻类的滋生。
(1)写出加入双氧水后,发生反应的离子方程式为________ 。
(2)漂白粉的有效成分是___________ (填写化学式),该物质是由_________ 构成的(填“原子”、“分子”或“离子”),其生效原理的离子方程式为___________ 。
(3)在锥形瓶中盛有一定量研磨好的次氯酸钙固体(如下图):

用针筒向锥形瓶中注射一定浓度的盐酸2~3mL。选取以下药品:①刚开封的次氯酸钙固体,②在空气中久置的次氯酸钙固体,③2 mol/L盐酸,④0.2 mol/L盐酸,进行三次实验,观察到的现象如下:第一次:锥形瓶内产生黄绿色气体,有色纸片褪色;第二次:锥形瓶内无气泡产生,有色纸片褪色;第三次:锥形瓶内产生大量气泡,并有黄绿色气体,有色纸片褪色。
①分析三次实验现象,推测第一次选择的药品是_____ (填编号)。
②第三次实验过程中产生大量气泡,其中除了Cl2、水蒸气外,还有_______ 气体。
③第二次实验过程中发生反应的化学方程式为___________ , 解释产生与第一次的现象不同的原因:___________ 。
(1)写出加入双氧水后,发生反应的离子方程式为
(2)漂白粉的有效成分是
(3)在锥形瓶中盛有一定量研磨好的次氯酸钙固体(如下图):

用针筒向锥形瓶中注射一定浓度的盐酸2~3mL。选取以下药品:①刚开封的次氯酸钙固体,②在空气中久置的次氯酸钙固体,③2 mol/L盐酸,④0.2 mol/L盐酸,进行三次实验,观察到的现象如下:第一次:锥形瓶内产生黄绿色气体,有色纸片褪色;第二次:锥形瓶内无气泡产生,有色纸片褪色;第三次:锥形瓶内产生大量气泡,并有黄绿色气体,有色纸片褪色。
①分析三次实验现象,推测第一次选择的药品是
②第三次实验过程中产生大量气泡,其中除了Cl2、水蒸气外,还有
③第二次实验过程中发生反应的化学方程式为
您最近一年使用:0次



