名校
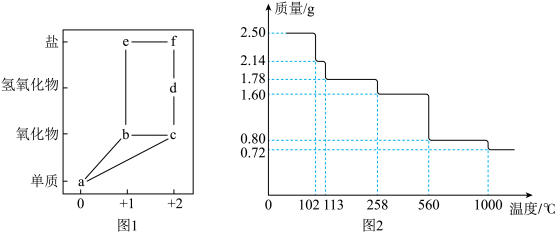
1 . 部分含铜物质的分类与相应化合价关系如图1所示,2.50g胆矾受热分解过程的热重曲线(固体样品质量随温度变化的曲线)如图2所示。 的电镀废液中,可将
的电镀废液中,可将 转化为e的氯盐沉淀而除去,该反应的离子方程式为
转化为e的氯盐沉淀而除去,该反应的离子方程式为___________ 。
(2)由图2推断:150℃时固体物质的化学式为___________ 。
(3)结合图1、2信息推测:b和c中,高温下更稳定的物质的化学式是___________ ,理由为___________ 。
(4)胆矾中水分子与铜离子的结合方式___________ ,理由是___________ 。
A.相同 B.不同
 的电镀废液中,可将
的电镀废液中,可将 转化为e的氯盐沉淀而除去,该反应的离子方程式为
转化为e的氯盐沉淀而除去,该反应的离子方程式为(2)由图2推断:150℃时固体物质的化学式为
(3)结合图1、2信息推测:b和c中,高温下更稳定的物质的化学式是
(4)胆矾中水分子与铜离子的结合方式
A.相同 B.不同
您最近一年使用:0次
名校
2 . 海水提溴过程中溴元素的变化如下图所示:
(2)过程II中,用热空气将溴赶出,再用浓 (aq)吸收。将该过程中反应的化学方程式补充完整,并用单线桥标出电子转移的方向和数目。
(aq)吸收。将该过程中反应的化学方程式补充完整,并用单线桥标出电子转移的方向和数目。___________

向盛有KI(aq)的试管中加入少许 后滴加氯水,振荡、静置后,
后滴加氯水,振荡、静置后, 层变成紫色,如果继续向试管中滴加氯水,振荡,
层变成紫色,如果继续向试管中滴加氯水,振荡, 层会逐渐变浅,最后变成无色。
层会逐渐变浅,最后变成无色。
(3)写出 层由紫色变成无色(生成
层由紫色变成无色(生成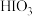 )的化学方程式:
)的化学方程式:___________ 。
(4)整个过程两步反应的还原剂分别是:第一步___________ 、第二步___________ 。
(5)把KI换成KBr,则 层变为
层变为___________ 色,继续滴加氯水, 层的颜色没有变化。向用硫酸酸化的NaI(aq)中逐滴加入
层的颜色没有变化。向用硫酸酸化的NaI(aq)中逐滴加入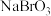 (aq),当加入2.6mol
(aq),当加入2.6mol 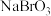 时,测得反应后溶液中溴和碘的存在形式及物质的量(n)如下表。则原溶液中NaI的物质的量是
时,测得反应后溶液中溴和碘的存在形式及物质的量(n)如下表。则原溶液中NaI的物质的量是___________ mol。
 、
、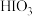 、
、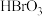 氧化性由强到弱的顺序合理的是
氧化性由强到弱的顺序合理的是___________ 。
A.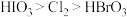 B.
B.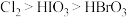
C. D.
D.

A. | B.HCl | C. | D. |
(2)过程II中,用热空气将溴赶出,再用浓
 (aq)吸收。将该过程中反应的化学方程式补充完整,并用单线桥标出电子转移的方向和数目。
(aq)吸收。将该过程中反应的化学方程式补充完整,并用单线桥标出电子转移的方向和数目。
向盛有KI(aq)的试管中加入少许
 后滴加氯水,振荡、静置后,
后滴加氯水,振荡、静置后, 层变成紫色,如果继续向试管中滴加氯水,振荡,
层变成紫色,如果继续向试管中滴加氯水,振荡, 层会逐渐变浅,最后变成无色。
层会逐渐变浅,最后变成无色。(3)写出
 层由紫色变成无色(生成
层由紫色变成无色(生成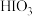 )的化学方程式:
)的化学方程式:(4)整个过程两步反应的还原剂分别是:第一步
(5)把KI换成KBr,则
 层变为
层变为 层的颜色没有变化。向用硫酸酸化的NaI(aq)中逐滴加入
层的颜色没有变化。向用硫酸酸化的NaI(aq)中逐滴加入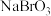 (aq),当加入2.6mol
(aq),当加入2.6mol 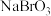 时,测得反应后溶液中溴和碘的存在形式及物质的量(n)如下表。则原溶液中NaI的物质的量是
时,测得反应后溶液中溴和碘的存在形式及物质的量(n)如下表。则原溶液中NaI的物质的量是| 粒子 |  |  | 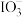 |
| n/mol | 0.5 | 1.3 | 未知 |
 、
、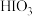 、
、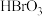 氧化性由强到弱的顺序合理的是
氧化性由强到弱的顺序合理的是A.
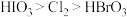 B.
B.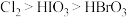
C.
 D.
D.
您最近一年使用:0次
2024-01-21更新
|
208次组卷
|
2卷引用:上海市南洋模范中学2023-2024学年高一上学期期末考试化学试卷
名校
解题方法
3 . 84消毒液是生活中常见的一种消毒剂,常用于环境的消毒,其有效成分是NaClO。
(1)84消毒液的制取和漂粉精的制取原理相同,都是用氯气和碱反应来制取,84消毒液所用的碱是氢氧化钠溶液,写出该反应的离子方程式___________ 。
(2)84消毒液使用时除了要按一定比例稀释,对消毒时间也有要求,一般在10-20分钟左右。结合有关的化学方程式并用文字解释原因___________ ,家庭使用84消毒液时,可以采取哪些措施缩短消毒时间___________ 。
(3)次氯酸钠可用于去除废水中的铵态氮,配平离子方程式并标出电子转移方向和数目。___________ 。
_______NH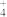 +_______ClO−——_______N2+_______Cl−+_______H2O+_______H+
+_______ClO−——_______N2+_______Cl−+_______H2O+_______H+
(4)消毒学专家指出,将84消毒液与洁厕灵(主要成分:浓盐酸)一起合并使用,可能会导致使用者的呼吸道伤害。结合有关的化学方程式分析可能的原因___________ 。
(1)84消毒液的制取和漂粉精的制取原理相同,都是用氯气和碱反应来制取,84消毒液所用的碱是氢氧化钠溶液,写出该反应的离子方程式
(2)84消毒液使用时除了要按一定比例稀释,对消毒时间也有要求,一般在10-20分钟左右。结合有关的化学方程式并用文字解释原因
(3)次氯酸钠可用于去除废水中的铵态氮,配平离子方程式并标出电子转移方向和数目。
_______NH
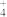 +_______ClO−——_______N2+_______Cl−+_______H2O+_______H+
+_______ClO−——_______N2+_______Cl−+_______H2O+_______H+(4)消毒学专家指出,将84消毒液与洁厕灵(主要成分:浓盐酸)一起合并使用,可能会导致使用者的呼吸道伤害。结合有关的化学方程式分析可能的原因
您最近一年使用:0次
名校
解题方法
4 . 联氨(N2H4)可用于处理锅炉水中的溶解氧, 一种反应机理如下图所示。
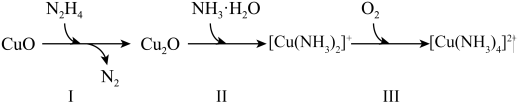
(1)NH3 的电子式为___________ 。
(2)[Cu(NH3)4]2+中心离子是___________ ,配位数是___________ 。
(3)写出反应 I 的化学方程式,并用单线桥法表示电子转移的方向和数目:___________ 。
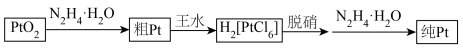
(4)已知水合肼(N2H4•H2O)具有较强还原性,通常可被氧化为 N2。现用如图流程可制得较纯的单质 Pt,下列有关说法不正确的是___________。

(1)NH3 的电子式为
(2)[Cu(NH3)4]2+中心离子是
(3)写出反应 I 的化学方程式,并用单线桥法表示电子转移的方向和数目:
(4)已知水合肼(N2H4•H2O)具有较强还原性,通常可被氧化为 N2。现用如图流程可制得较纯的单质 Pt,下列有关说法不正确的是___________。

| A.王水(由浓盐酸与浓硝酸组成)与粗 Pt 反应时仅体现氧化作用 |
B. 中 N 原子的杂化轨道类型为 sp2 ,空间结构为平面三角形 中 N 原子的杂化轨道类型为 sp2 ,空间结构为平面三角形 |
| C.脱硝除去残余的 HNO3 和氮氧化物,主要目的是防止其污染环境 |
| D.由 PtO2 制得 1mol 纯 Pt ,除脱销过程外理论上只需要 1mol N2H4•H2O 作还原剂 |
您最近一年使用:0次
名校
解题方法
5 . 含氯消毒剂会与水中有机物发生氯代反应,生成物会在人体内积留产生慢性累积中毒,诱发癌症,而 ClO2 是国际上公认的最理想的更换替代产品,我国从2000年起就逐渐用它取代了其它含氯消毒剂。市面上销售的二氧化氯消毒片都是二氧化氯的前体:亚氯酸钠,亚氯酸钠溶液与酸、有机物、还原剂或者氯供体接触,将会发生反应生成二氧化氯气体。
(1)亚氯酸钠溶液和盐酸反应产生ClO2的化学方程式为___________ 。
(2)此反应中氧化剂与还原剂的物质的量之比为____ ,反应中盐酸的作用是____ (填编号)。
A.只有还原性 B.还原性和酸性 C.只有酸性 D.氧化性和酸性
(3)将二氧化氯通入含 CN-的废水中,产生两种对环境友好的气体,氯被还原成最低价离子,发生反应的离子方程式为______ 。
(4)(CN)2、(OCN)2、(SCN)2 等通称为拟卤素,它们的性质与卤素相似,氧化性强弱顺序是:F2>(OCN)2>Cl2>(CN)2>(SCN)2>I2,下列方程式中错误的是____(填编号)。
(5)在ClO2的制备方法中,有下列两种制备方法:
方法 1:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法 2:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O:
①分析方法1的化学反应方程式,用双线桥标出电子转移方向和数目______ ,2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。
②方法2在实际制备过程中,NaClO3与H2O2的物质的量之比小于2,可能的原因是______ 。
③用方法2制备的ClO2更适合用于饮用水的消毒,其主要原因是_______ 。
(6)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的 ,其含量应不超过0.2mg/L,可用FeCl2溶液处理饮用水中残留的
,其含量应不超过0.2mg/L,可用FeCl2溶液处理饮用水中残留的 ,反应后的溶液中可以产生丁达尔现象,写出反应的离子方程式
,反应后的溶液中可以产生丁达尔现象,写出反应的离子方程式_________ 。
(7)饮用水中的ClO2、 含量可用连续碘量法进行测定。ClO2被I-还原为
含量可用连续碘量法进行测定。ClO2被I-还原为 、Cl-的转化率与溶液pH的关系如图所示,当pH≤2.0时,
、Cl-的转化率与溶液pH的关系如图所示,当pH≤2.0时, 也能被I-完全还原为Cl-,反应生成的I-的量可以用已知浓度的Na2S2O3溶液来确定:2Na2S2O3+I2=Na2S4O6+2NaI。
也能被I-完全还原为Cl-,反应生成的I-的量可以用已知浓度的Na2S2O3溶液来确定:2Na2S2O3+I2=Na2S4O6+2NaI。
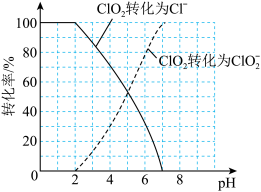
①请写出pH≤2.0时 与I-反应的离子方程式:
与I-反应的离子方程式:_________ 。
②请完成相应的实验步骤:
步骤 1:准确量取V mL水样加入到锥形瓶中;
步骤 2:调节水样的pH为7.0~8.0;
步骤 3:加入足量的KI晶体,充分反应后,滴入少量淀粉溶液,溶液显蓝色;
步骤 4:当加入的c mol/LNa2S2O3溶液体积为V1 mL,恰好完全反应,溶液蓝色恰好褪去;
步骤 5:_____ ,溶液再次显蓝色;
步骤 6:当加入的 c mol/L Na2S2O3 溶液体积达到 V2 mL,溶液蓝色恰好再次褪去。
③根据上述分析数据,测得该饮用水中 的浓度为
的浓度为_______ mol/L(用含字母的代数式表示)。
(1)亚氯酸钠溶液和盐酸反应产生ClO2的化学方程式为
(2)此反应中氧化剂与还原剂的物质的量之比为
A.只有还原性 B.还原性和酸性 C.只有酸性 D.氧化性和酸性
(3)将二氧化氯通入含 CN-的废水中,产生两种对环境友好的气体,氯被还原成最低价离子,发生反应的离子方程式为
(4)(CN)2、(OCN)2、(SCN)2 等通称为拟卤素,它们的性质与卤素相似,氧化性强弱顺序是:F2>(OCN)2>Cl2>(CN)2>(SCN)2>I2,下列方程式中错误的是____(填编号)。
| A.2NaSCN+MnO2+2H2SO4=Na2SO4+(SCN)2↑+MnSO4+2H2O |
| B.(CN)2+2KI=2KCN+I2 |
| C.Cl2+2NaOCN= (OCN)2+2NaCl |
| D.2AgCN=2Ag+(CN)2 |
(5)在ClO2的制备方法中,有下列两种制备方法:
方法 1:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法 2:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O:
①分析方法1的化学反应方程式,用双线桥标出电子转移方向和数目
②方法2在实际制备过程中,NaClO3与H2O2的物质的量之比小于2,可能的原因是
③用方法2制备的ClO2更适合用于饮用水的消毒,其主要原因是
(6)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的
 ,其含量应不超过0.2mg/L,可用FeCl2溶液处理饮用水中残留的
,其含量应不超过0.2mg/L,可用FeCl2溶液处理饮用水中残留的 ,反应后的溶液中可以产生丁达尔现象,写出反应的离子方程式
,反应后的溶液中可以产生丁达尔现象,写出反应的离子方程式(7)饮用水中的ClO2、
 含量可用连续碘量法进行测定。ClO2被I-还原为
含量可用连续碘量法进行测定。ClO2被I-还原为 、Cl-的转化率与溶液pH的关系如图所示,当pH≤2.0时,
、Cl-的转化率与溶液pH的关系如图所示,当pH≤2.0时, 也能被I-完全还原为Cl-,反应生成的I-的量可以用已知浓度的Na2S2O3溶液来确定:2Na2S2O3+I2=Na2S4O6+2NaI。
也能被I-完全还原为Cl-,反应生成的I-的量可以用已知浓度的Na2S2O3溶液来确定:2Na2S2O3+I2=Na2S4O6+2NaI。
①请写出pH≤2.0时
 与I-反应的离子方程式:
与I-反应的离子方程式:②请完成相应的实验步骤:
步骤 1:准确量取V mL水样加入到锥形瓶中;
步骤 2:调节水样的pH为7.0~8.0;
步骤 3:加入足量的KI晶体,充分反应后,滴入少量淀粉溶液,溶液显蓝色;
步骤 4:当加入的c mol/LNa2S2O3溶液体积为V1 mL,恰好完全反应,溶液蓝色恰好褪去;
步骤 5:
步骤 6:当加入的 c mol/L Na2S2O3 溶液体积达到 V2 mL,溶液蓝色恰好再次褪去。
③根据上述分析数据,测得该饮用水中
 的浓度为
的浓度为
您最近一年使用:0次
6 . Ⅰ.硒( )在人体内可以起到提高免疫力、抗氧化等功效,含硒化合物在材料和药物领域具有重要作用。铬(
)在人体内可以起到提高免疫力、抗氧化等功效,含硒化合物在材料和药物领域具有重要作用。铬( )被广泛应用在冶金、化工、铸铁、耐火及高精端科技等领域。
)被广泛应用在冶金、化工、铸铁、耐火及高精端科技等领域。
(1)在元素周期表中,硒是第34号元素,与氧同主族,硒原子的电子式表示为___________ ,比较硫和硒的氢化物的热稳定性:
___________  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
Ⅱ.工业制备高纯硒的流程如下:
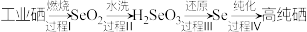
(2)下列说法正确的是___________。
(3)过程Ⅲ中还需要用的反应物为 ,对应产物为
,对应产物为 ,标况下,当有
,标况下,当有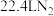 生成时,该反应中转移的电子数目为
生成时,该反应中转移的电子数目为___________ 。
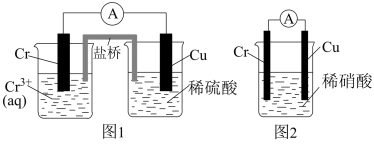
(4)工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是___________。
Ⅲ.+6价铬的化合物毒性较大,常用甲醇酸性燃料电池电解处理酸性含铬废水(主要含有 ),其原理示意图如下图所示:
),其原理示意图如下图所示:
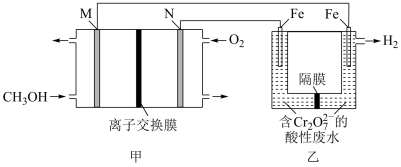
(5)M极为原电池的___________ 极(填“正”或“负”)。
(6)N极附近的
___________ (填“变大”或“变小”或“不变”)。
(7)写出电解池中阳极产物将 转化为
转化为 的离子方程式
的离子方程式___________ 。
 )在人体内可以起到提高免疫力、抗氧化等功效,含硒化合物在材料和药物领域具有重要作用。铬(
)在人体内可以起到提高免疫力、抗氧化等功效,含硒化合物在材料和药物领域具有重要作用。铬( )被广泛应用在冶金、化工、铸铁、耐火及高精端科技等领域。
)被广泛应用在冶金、化工、铸铁、耐火及高精端科技等领域。(1)在元素周期表中,硒是第34号元素,与氧同主族,硒原子的电子式表示为

 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。Ⅱ.工业制备高纯硒的流程如下:
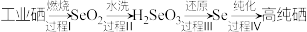
(2)下列说法正确的是___________。
| A.过程Ⅰ只发生氧化反应 |
| B.过程Ⅱ的水洗过程属于非氧化还原反应 |
C. 能与 能与 反应生成 反应生成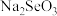 和 和 |
D. 在过程Ⅲ的反应中体现了还原性 在过程Ⅲ的反应中体现了还原性 |
(3)过程Ⅲ中还需要用的反应物为
 ,对应产物为
,对应产物为 ,标况下,当有
,标况下,当有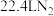 生成时,该反应中转移的电子数目为
生成时,该反应中转移的电子数目为(4)工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是___________。

A.由实验现象可知:金属活动性 |
B.图1为原电池装置, 电极上产生的是 电极上产生的是 |
C.两个装置中,电子均由 电极流向 电极流向 电极 电极 |
D.图2装置中 电极上发生的电极反应式为 电极上发生的电极反应式为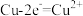 |
Ⅲ.+6价铬的化合物毒性较大,常用甲醇酸性燃料电池电解处理酸性含铬废水(主要含有
 ),其原理示意图如下图所示:
),其原理示意图如下图所示:
(5)M极为原电池的
(6)N极附近的

(7)写出电解池中阳极产物将
 转化为
转化为 的离子方程式
的离子方程式
您最近一年使用:0次
名校
解题方法
7 . 含氯物质在生产、生活中有重要作用。工业上常用次氯酸钠处理含有 NO 等氮氧化物的尾气,反应方程式如下:NaClO + NO + H2O — NaCl + HNO3 (未配平)。
(1)氯在元素周期表中的位置是_______ ,其所在主族的元素中,最高价氧化物对应的水化物酸性最强的是_______ (填化学式)。其所在周期的元素中,第一电离能最大的是______ (填化学式)。
(2)配平上述反应方程式_______ 。每有 0.3mol 电子发生转移,可消耗标准状况下 NO 气体的体积约为______ L。
(3)NaClO 溶液中存在如下关系:c(OH-)_____ c(HClO)(填“>”、“=”、或“<”)。
其他条件相同,随着 NaClO 溶液初始 pH(用稀硫酸调节)的不同,NO 转化率如图。
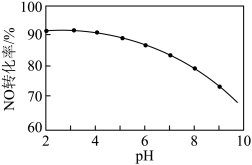
(4)NaClO 溶液的初始pH 越大,NO 的转化率越________ (填“高”或“低”),其原因是_________ 。
(5)取少量 NaClO 溶液和 KClO3 溶液,分别置于 A 试管和 B 试管,滴加试剂,观察现象,记录于下表。请将表格填写完整。
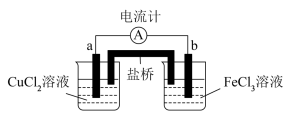
(6)某化学学习小组设计原电池装置如下图 (a 为铜电极 b 为石墨电极) :,请写出负极的电极反应式________ ;盐桥在原电池中所起的作用(任意写出一条)__________ 。
(1)氯在元素周期表中的位置是
(2)配平上述反应方程式
(3)NaClO 溶液中存在如下关系:c(OH-)
其他条件相同,随着 NaClO 溶液初始 pH(用稀硫酸调节)的不同,NO 转化率如图。

(4)NaClO 溶液的初始pH 越大,NO 的转化率越
(5)取少量 NaClO 溶液和 KClO3 溶液,分别置于 A 试管和 B 试管,滴加试剂,观察现象,记录于下表。请将表格填写完整。
| 滴加 KI 溶液 | 再滴加 CCl4,振荡、静置 | 结论 | |
| A 试管 | 溶液变为棕黄色 | 溶液分层,下层显 | 氧化性强弱:(填“>”或“<”) KClO3 |
| B 试管 | 无现象 | 溶液分层,均无色 |
(6)某化学学习小组设计原电池装置如下图 (a 为铜电极 b 为石墨电极) :,请写出负极的电极反应式

您最近一年使用:0次
名校
8 . 回答下列问题。
(1)请配平上述离子方程式并用单线桥表示电子转移的方向和数目:___________ 。
_______Fe2++_______H++_______ =_______Fe3++______N2O↑+_______H2O
=_______Fe3++______N2O↑+_______H2O
(2)写出还原半反应___________ 。
(3)该反应中,还原产物为___________ ,标况每生成22.4L气体,转移电子数为___________ 。
(1)请配平上述离子方程式并用单线桥表示电子转移的方向和数目:
_______Fe2++_______H++_______
 =_______Fe3++______N2O↑+_______H2O
=_______Fe3++______N2O↑+_______H2O(2)写出还原半反应
(3)该反应中,还原产物为
您最近一年使用:0次
名校
解题方法
9 . 配平方程式:___________
___________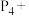 ___________
___________ ___________
___________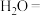 ___________
___________ ___________
___________ ___________
___________
___________
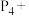 ___________
___________ ___________
___________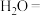 ___________
___________ ___________
___________ ___________
___________
您最近一年使用:0次
10 . 强氧化剂中,ClO2的地位不可磨灭,化学中比较不同氧化剂之间氧化能力往往通过有效氯来进行比较。“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的得电子数量相当于多少克Cl2的得电子数量,产物均为-1的氯。
(1)据此计算,ClO2的“有效氯含量”为___________ (计算结果保留两位小数)
(2)在用二氧化氯进行水处理时,ClO2除了杀菌消毒外,还能除去水中的Fe2+和Mn2+。用ClO2氧化除去Mn2+生成 和MnO2的离子方程式为
和MnO2的离子方程式为___________ 。
(1)据此计算,ClO2的“有效氯含量”为
(2)在用二氧化氯进行水处理时,ClO2除了杀菌消毒外,还能除去水中的Fe2+和Mn2+。用ClO2氧化除去Mn2+生成
 和MnO2的离子方程式为
和MnO2的离子方程式为
您最近一年使用:0次



