名校
1 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
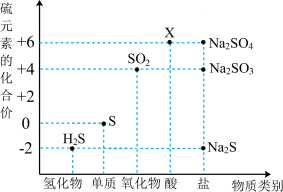
(1)X的浓溶液与碳在一定条件下可以发生反应,体现了X的___________ 性。从硫元素化合价变化的角度分析,图中只有还原性的物质有___________ (填化学式)。
(2)收集了一些含有S元素的酸雨,放置一段时间后,pH变小,小攀认为可能是因为酸雨中的亚硫酸被氧化为了___________ 。小登觉得可以设计实验验证这一推论,具体操作是___________ 。
(3)配平下列反应:___________
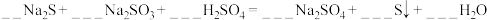 。
。
(4)如图是验证二氧化硫性质的实验装置。
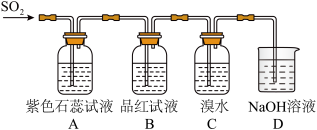
二氧化硫具有:①漂白性、②酸性氧化物性质、③还原性、④氧化性,上述装置中对应表现出的性质是:A中___________ (填序号,下同);B中___________ ;C中___________ 。D装置的作用是___________ 。

(1)X的浓溶液与碳在一定条件下可以发生反应,体现了X的
(2)收集了一些含有S元素的酸雨,放置一段时间后,pH变小,小攀认为可能是因为酸雨中的亚硫酸被氧化为了
(3)配平下列反应:
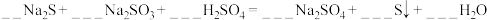 。
。(4)如图是验证二氧化硫性质的实验装置。

二氧化硫具有:①漂白性、②酸性氧化物性质、③还原性、④氧化性,上述装置中对应表现出的性质是:A中
您最近一年使用:0次
名校
2 . 蛇纹石是一类含水富镁硅酸盐矿物,主要成分为MgO和SiO2,含少量Fe、Ni的氧化物。可用于生产重要无机化工产品碱式碳酸镁[Mg2(OH)2CO3]。其制备流程如图所示:
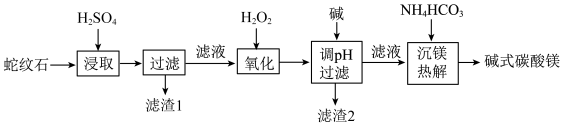
(1)滤渣1的主要成分从性质上来分,属于_______ 氧化物(填“酸性”“两性”或“碱性”),其用途很广泛,请写出一种:_______ 。如图表示该物质晶体的晶胞结构,1个该晶胞中含有_______ 个A-B键。
(2)滤渣2的主要成分是Fe(OH)3和Ni(OH)2,“氧化”过程中发现所用H2O2远高于理论用量,造成这一结果的主要原因有:①“氧化”过程中放热,温度升高加快了H2O2的分解速率、②_______ 。以下_______ (填序号)可以检验“氧化”过程已完全。
A.KSCN溶液 B.酸性KMnO4溶液 C.K3[Fe(CN)6]溶液 D.NaOH溶液
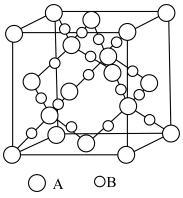
(3)Ni2+易形成[Ni(NH3)6]2+配合物,若[Ni(NH3)6]2+为正八面体构型(如图所示),则[Ni(CO)2(NH3)4]2+的结构有_______ 种。
(4)“沉镁热解”由连续的两步完成,第一步:沉镁生成正碳酸镁(MgCO3·3H2O),第二步:将正碳酸镁热解生成碱式碳酸镁。写出第一步的化学方程式:_______ 。
(5)用x吨含3MgO·2SiO2·2H2O(摩尔质量为a g/mol)为80%蛇纹石为原料,按以上流程制取[Mg2(OH)2CO3](摩尔质量为bg/mol),制得产品y吨,制取过程中镁元素的损失率为_______ ×100%(用含x、y、a、b的式子表示)。

(1)滤渣1的主要成分从性质上来分,属于

(2)滤渣2的主要成分是Fe(OH)3和Ni(OH)2,“氧化”过程中发现所用H2O2远高于理论用量,造成这一结果的主要原因有:①“氧化”过程中放热,温度升高加快了H2O2的分解速率、②
A.KSCN溶液 B.酸性KMnO4溶液 C.K3[Fe(CN)6]溶液 D.NaOH溶液
(3)Ni2+易形成[Ni(NH3)6]2+配合物,若[Ni(NH3)6]2+为正八面体构型(如图所示),则[Ni(CO)2(NH3)4]2+的结构有

(4)“沉镁热解”由连续的两步完成,第一步:沉镁生成正碳酸镁(MgCO3·3H2O),第二步:将正碳酸镁热解生成碱式碳酸镁。写出第一步的化学方程式:
(5)用x吨含3MgO·2SiO2·2H2O(摩尔质量为a g/mol)为80%蛇纹石为原料,按以上流程制取[Mg2(OH)2CO3](摩尔质量为bg/mol),制得产品y吨,制取过程中镁元素的损失率为
您最近一年使用:0次
2024-02-11更新
|
225次组卷
|
2卷引用:上海市宜川中学2023-2024学年高三上学期12月考试化学试题
3 . 氯及其化合物在日常生活中有广泛应用。某实验小组设计多组实验,对氯气及氯的化合物的性质进行研究
I.氯气的制备与性质研究
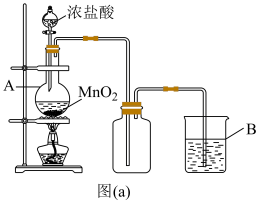
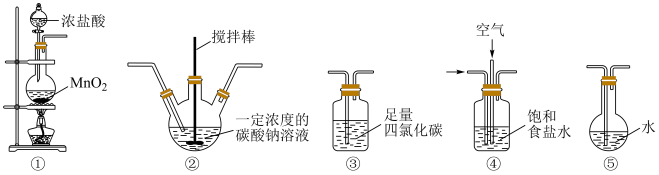
(1)实验室中常用如图(a)所示的装置制备氯气,反应的化学方程式为___________ 。
(2)图中仪器A的名称是___________ 。
(3)装置B内的溶液可以是___________ 。
(4)实验室中常用图(b)所示的装置制备氯气,并同时得到较浓的烧碱溶液。
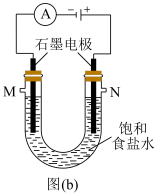
①图(b)反应的化学方程式为___________ 。
②检验制得的烧碱溶液中是否含有NaCl的实验方法是___________ 。
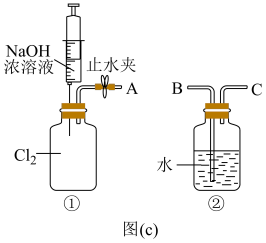
③用图(c)所示的组合装置验证氯气与烧碱溶液的反应。将A与B连接,打开止水夹,用注射器注入过量NaOH浓溶液,观察到的现象有___________ ;若其它操作不变,将A与C连接,②中观察到的现象有___________ 。
Ⅱ.次氯酸是重要的含氯化合物,应用于杀菌消毒、漂白等领域。学习小组以Cl2O为原料制备HClO。
i.常温常压下Cl2O是一种黄绿色气体
ii.将氯气和空气(不参与反应)通入足量的Na2CO3溶液,发生反应生成Cl2O。
iii.Cl2O易溶于水并与水立即反应生成HClO
iv.已知:HClO+2I-+H+=I2+Cl-+H2O,I2+2 =2I-+
=2I-+
(5)装置③中的液体不可燃、不助燃也不导电,关于其用途正确的是___________。
(6)各装置的连接顺序为___________ 。
①→___________→___________→___________→___________
(7)装置②中发生的化学反应中氧化产物与还原产物的物质的量之比为___________ 。
(8)装置④的作用有___________ 。(至少写出2点)
I.氯气的制备与性质研究

(1)实验室中常用如图(a)所示的装置制备氯气,反应的化学方程式为
(2)图中仪器A的名称是
(3)装置B内的溶液可以是
(4)实验室中常用图(b)所示的装置制备氯气,并同时得到较浓的烧碱溶液。

①图(b)反应的化学方程式为
②检验制得的烧碱溶液中是否含有NaCl的实验方法是
③用图(c)所示的组合装置验证氯气与烧碱溶液的反应。将A与B连接,打开止水夹,用注射器注入过量NaOH浓溶液,观察到的现象有

Ⅱ.次氯酸是重要的含氯化合物,应用于杀菌消毒、漂白等领域。学习小组以Cl2O为原料制备HClO。

i.常温常压下Cl2O是一种黄绿色气体
ii.将氯气和空气(不参与反应)通入足量的Na2CO3溶液,发生反应生成Cl2O。
iii.Cl2O易溶于水并与水立即反应生成HClO
iv.已知:HClO+2I-+H+=I2+Cl-+H2O,I2+2
 =2I-+
=2I-+
(5)装置③中的液体不可燃、不助燃也不导电,关于其用途正确的是___________。
| A.可浮于水溶液上方——隔绝空气 | B.与水互不相溶——萃取剂 |
| C.可隔绝空气——灭火剂 | D.遇碘变色——指示剂 |
(6)各装置的连接顺序为
①→___________→___________→___________→___________
(7)装置②中发生的化学反应中氧化产物与还原产物的物质的量之比为
(8)装置④的作用有
您最近一年使用:0次
22-23高一下·上海浦东新·期中
名校
解题方法
4 . 钠元素在自然界中都以化合物的形式存在,钠的单质和化合物用途广泛,回答下列问题:
(1)采用空气和Na为原料可制备 。空气与熔融的金属Na反应前需依次通过的试剂为
。空气与熔融的金属Na反应前需依次通过的试剂为___________ 、___________ (选填编号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d. 溶液
溶液
(2)向酸性 溶液中加入
溶液中加入 粉末,观察到溶液褪色,发生如下反应:___________
粉末,观察到溶液褪色,发生如下反应:___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________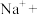 ___________
___________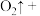 ___________。配平上述离子方程式,并用单线桥法表示电子转移的方向和数目
___________。配平上述离子方程式,并用单线桥法表示电子转移的方向和数目___________ 。该反应说明 具有
具有___________ (选填“氧化性”“还原性”或“漂白性”)。
某研究性学习小组的同学,为测定某种含有少量氧化钠的过氧化钠试样中过氧化钠的含量,称取w g样品与足量的水反应,测定生成气体在通常状况(约20℃,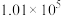 Pa)的体积,设计了如图所示的实验装置进行探究
Pa)的体积,设计了如图所示的实验装置进行探究
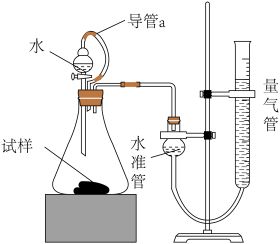
回答下列问题:
(3)装置中导管a的作用是___________ 。
(4)反应前后量气管中液面读数分别为 mL、
mL、 mL(实验条件下的气体摩尔体积为
mL(实验条件下的气体摩尔体积为 L/mol),试计算试样中过氧化钠的质量分数:
L/mol),试计算试样中过氧化钠的质量分数:___________ 。
(5)通过实验,测得该试样中过氧化钠质量分数偏高,产生这种现象的原因可能是___________ (选填编号)。
a.反应后测定气体体积时水准管的水面低于量气管的水面
b.锥形瓶中留有反应生成的气体
c.测定气体体积时未冷却至室温
(1)采用空气和Na为原料可制备
 。空气与熔融的金属Na反应前需依次通过的试剂为
。空气与熔融的金属Na反应前需依次通过的试剂为a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.
 溶液
溶液(2)向酸性
 溶液中加入
溶液中加入 粉末,观察到溶液褪色,发生如下反应:___________
粉末,观察到溶液褪色,发生如下反应:___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________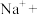 ___________
___________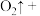 ___________。配平上述离子方程式,并用单线桥法表示电子转移的方向和数目
___________。配平上述离子方程式,并用单线桥法表示电子转移的方向和数目 具有
具有某研究性学习小组的同学,为测定某种含有少量氧化钠的过氧化钠试样中过氧化钠的含量,称取w g样品与足量的水反应,测定生成气体在通常状况(约20℃,
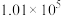 Pa)的体积,设计了如图所示的实验装置进行探究
Pa)的体积,设计了如图所示的实验装置进行探究
回答下列问题:
(3)装置中导管a的作用是
(4)反应前后量气管中液面读数分别为
 mL、
mL、 mL(实验条件下的气体摩尔体积为
mL(实验条件下的气体摩尔体积为 L/mol),试计算试样中过氧化钠的质量分数:
L/mol),试计算试样中过氧化钠的质量分数:(5)通过实验,测得该试样中过氧化钠质量分数偏高,产生这种现象的原因可能是
a.反应后测定气体体积时水准管的水面低于量气管的水面
b.锥形瓶中留有反应生成的气体
c.测定气体体积时未冷却至室温
您最近一年使用:0次
名校
解题方法
5 . 亚硝酸钠 是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下;
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下;
________ ________
________ ________=________
________=________ ________
________ ________
________ ________
________ ________
________
(1)补充并配平该化学方程式______ (若系数为1,请标注“1”)。
(2)从物质分类角度来看, 是
是________ (填字母)。
a.酸 b.酸式盐 c.碱 d.非电解质
e.电解质 f.离子化合物 g.共价化合物
(3)用上述反应来处理 并不是最佳方法,其原因是
并不是最佳方法,其原因是________ 。
(4)下列方法不能用来区分固体 和NaCl的是________(填字母)。
和NaCl的是________(填字母)。
(5)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列________(填字母)反应中
表现出的性质与下列________(填字母)反应中 表现出的性质相同。
表现出的性质相同。
(6)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学方程式,并用单线桥表示其电子转移的方向和数目:________ 。
 是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下;
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下;________
 ________
________ ________=________
________=________ ________
________ ________
________ ________
________ ________
________
(1)补充并配平该化学方程式
(2)从物质分类角度来看,
 是
是a.酸 b.酸式盐 c.碱 d.非电解质
e.电解质 f.离子化合物 g.共价化合物
(3)用上述反应来处理
 并不是最佳方法,其原因是
并不是最佳方法,其原因是(4)下列方法不能用来区分固体
 和NaCl的是________(填字母)。
和NaCl的是________(填字母)。| A.分别溶于水 | B.分别溶于水并滴加 酸化的 酸化的 溶液 溶液 |
| C.分别加强热并收集气体检验 | D.用筷子分别蘸取固体品尝味道 |
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列________(填字母)反应中
表现出的性质与下列________(填字母)反应中 表现出的性质相同。
表现出的性质相同。A. |
B. |
C.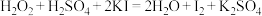 |
D.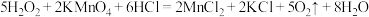 |
您最近一年使用:0次
名校
解题方法
6 . 亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似,有咸味,容易误食中毒。由于
)是一种用途广泛的工业盐,因其外观和食盐相似,有咸味,容易误食中毒。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:_______
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:_______ _______
_______ _______
_______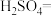 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______ ;完成下列填空:
;完成下列填空:
(1)请配平上述化学反应并标出电子转移的方向和数目_______ :从物质分类角度来看, 属于
属于_______ (填字母)。
a.酸 b.酸式盐 c.正盐 d.碱方程式
氧化剂与还原剂的物质的量之比为_______ 。
(2)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列_______(填字母)反应中
表现出的性质与下列_______(填字母)反应中 表现出的性质完全相同。
表现出的性质完全相同。
 )是一种用途广泛的工业盐,因其外观和食盐相似,有咸味,容易误食中毒。由于
)是一种用途广泛的工业盐,因其外观和食盐相似,有咸味,容易误食中毒。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:_______
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:_______ _______
_______ _______
_______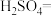 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______ ;完成下列填空:
;完成下列填空:(1)请配平上述化学反应并标出电子转移的方向和数目
 属于
属于a.酸 b.酸式盐 c.正盐 d.碱方程式
氧化剂与还原剂的物质的量之比为
(2)误食
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列_______(填字母)反应中
表现出的性质与下列_______(填字母)反应中 表现出的性质完全相同。
表现出的性质完全相同。A. |
B. |
C. |
D. |
您最近一年使用:0次
名校
解题方法
7 . 硫及其化合物在工业生产、生活中有重要的用途。
(1) 原子最外层有
原子最外层有______ 种不同运动状态的电子,能量最高的亚层电子云形状为______ 。
(2)元素周期表中与 元素相邻,且原子序数小于
元素相邻,且原子序数小于 的元素,其原子半径大小关系为
的元素,其原子半径大小关系为______ (用元素符号表示)。工业上常用 除去原料气中少量
除去原料气中少量 ,生成物为固体
,生成物为固体 和
和 反应所涉及的化合物中仅有一种是非极性分子,其电子式为
反应所涉及的化合物中仅有一种是非极性分子,其电子式为____________ 。
(3)硫化钠和硫化钾是两种重要的化工原料,请比较两者熔点高低,并从结构角度解释原因。
_____________
(4) 、
、 是两种重要的含硫化合物。
是两种重要的含硫化合物。
①往 稀溶液中加入少量
稀溶液中加入少量 固体完全溶解后(忽略溶解过程中溶液温度变化)溶液中
固体完全溶解后(忽略溶解过程中溶液温度变化)溶液中 的值
的值______ (填“变大”、“变小”或“保持不变”)。
② 是常用的还原剂,但不能在强酸性环境下使用。写出
是常用的还原剂,但不能在强酸性环境下使用。写出 与稀硫酸混合反应的离子方程式
与稀硫酸混合反应的离子方程式____________ 。
(5)工业烟气中含有 ,可以用软猛矿(主要成分
,可以用软猛矿(主要成分 ,含
,含 、
、 、
、 等杂质金属元素)的悬浊液吸收,制备
等杂质金属元素)的悬浊液吸收,制备 。调节
。调节 除去
除去 和
和 后,得到
后,得到 和
和 的混合溶液,两者的结晶水合物的溶解度随温度的变化曲线如图所示,从
的混合溶液,两者的结晶水合物的溶解度随温度的变化曲线如图所示,从 和
和 混合溶液中获得
混合溶液中获得 晶体的操作有
晶体的操作有______ ,______ ,热水洗涤,干燥。

(1)
 原子最外层有
原子最外层有(2)元素周期表中与
 元素相邻,且原子序数小于
元素相邻,且原子序数小于 的元素,其原子半径大小关系为
的元素,其原子半径大小关系为 除去原料气中少量
除去原料气中少量 ,生成物为固体
,生成物为固体 和
和 反应所涉及的化合物中仅有一种是非极性分子,其电子式为
反应所涉及的化合物中仅有一种是非极性分子,其电子式为(3)硫化钠和硫化钾是两种重要的化工原料,请比较两者熔点高低,并从结构角度解释原因。
(4)
 、
、 是两种重要的含硫化合物。
是两种重要的含硫化合物。①往
 稀溶液中加入少量
稀溶液中加入少量 固体完全溶解后(忽略溶解过程中溶液温度变化)溶液中
固体完全溶解后(忽略溶解过程中溶液温度变化)溶液中 的值
的值②
 是常用的还原剂,但不能在强酸性环境下使用。写出
是常用的还原剂,但不能在强酸性环境下使用。写出 与稀硫酸混合反应的离子方程式
与稀硫酸混合反应的离子方程式(5)工业烟气中含有
 ,可以用软猛矿(主要成分
,可以用软猛矿(主要成分 ,含
,含 、
、 、
、 等杂质金属元素)的悬浊液吸收,制备
等杂质金属元素)的悬浊液吸收,制备 。调节
。调节 除去
除去 和
和 后,得到
后,得到 和
和 的混合溶液,两者的结晶水合物的溶解度随温度的变化曲线如图所示,从
的混合溶液,两者的结晶水合物的溶解度随温度的变化曲线如图所示,从 和
和 混合溶液中获得
混合溶液中获得 晶体的操作有
晶体的操作有
您最近一年使用:0次
8 . 氧化还原反应在工农业生产、日常生活中具有广泛的用途。
(1)“服用维生素C,可以使食物中的Fe3+转化为Fe2+”,说明维生素C具有____ (填“氧化”或“还原”)性。
(2)二氧化氯是一种高效消毒剂。工业制备ClO2的反应为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①氧化性:NaClO3____ (填“>”或“<”)Cl2。
②ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO ),需将其转化为Cl-除去,下列试剂中可将ClO2转化为Cl-的是
),需将其转化为Cl-除去,下列试剂中可将ClO2转化为Cl-的是____ (填字母)。
a.O3 b.FeSO4 c.Fe2(SO4)3 d.KMnO4
(3)FeCl3溶液能与Cu反应制作印刷电路板。其制作原理可用2FeCl3+Cu=CuCl2+2X表示。
①上式中X的化学式为____ 。
②该反应的离子方程式为____ 。
(4)配平下列方程式。____ 。
________Al+________NaNO3+_________NaOH=________NaAlO2+________N2↑+_______H2O
(5)某反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程H2O2→O2。
①该反应中的氧化剂是____ 。
②写出该反应的化学方程式____ 。
(1)“服用维生素C,可以使食物中的Fe3+转化为Fe2+”,说明维生素C具有
(2)二氧化氯是一种高效消毒剂。工业制备ClO2的反应为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①氧化性:NaClO3
②ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO
 ),需将其转化为Cl-除去,下列试剂中可将ClO2转化为Cl-的是
),需将其转化为Cl-除去,下列试剂中可将ClO2转化为Cl-的是a.O3 b.FeSO4 c.Fe2(SO4)3 d.KMnO4
(3)FeCl3溶液能与Cu反应制作印刷电路板。其制作原理可用2FeCl3+Cu=CuCl2+2X表示。
①上式中X的化学式为
②该反应的离子方程式为
(4)配平下列方程式。
________Al+________NaNO3+_________NaOH=________NaAlO2+________N2↑+_______H2O
(5)某反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程H2O2→O2。
①该反应中的氧化剂是
②写出该反应的化学方程式
您最近一年使用:0次
2022-10-16更新
|
232次组卷
|
2卷引用:上海市崇明区横沙中学2023-2024学年高二上学期期末考试化学试题
名校
解题方法
9 . 铁及其化合物在生产、生活中存在广泛用途:Fe(OH)3+NaOH+Cl2=Na2FeO4+NaCl+H2O
(1)配平上述反应,并标出电子转移方向及数目___________ 。
(2)自然界中存在的54Fe和56Fe,它们互称为___________ 。
(3)将铁片放入冷浓硫酸中,片刻后将铁片移入硫酸铜溶液中,发现铁片表面无明显变化,原因是___________ ,通常证明某溶液中含Fe2+的化学方法是___________ 。
(4)SO2有强还原性,写出其与FeCl3溶液反应的离子方程式___________ 。
(5)发黄的深井水通常含Fe3+,若向水中加入Na2CO3溶液,则产生红褐色沉淀和无色无味的气体。请从平衡角度解释这一现象___________ 。
(1)配平上述反应,并标出电子转移方向及数目
(2)自然界中存在的54Fe和56Fe,它们互称为
(3)将铁片放入冷浓硫酸中,片刻后将铁片移入硫酸铜溶液中,发现铁片表面无明显变化,原因是
(4)SO2有强还原性,写出其与FeCl3溶液反应的离子方程式
(5)发黄的深井水通常含Fe3+,若向水中加入Na2CO3溶液,则产生红褐色沉淀和无色无味的气体。请从平衡角度解释这一现象
您最近一年使用:0次
10 . 非金属元素及其化合物在生活、生产中有着重要的用途
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的最外层电子排布式为___________ ,已知3种原子晶体的熔点数据如下表:
金刚石熔点比晶体硅熔点高的原因是___________ 。
(2)CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,发生反应2S2(g)+CH4(g) CS2(g)+2H2S(g),CS2分子的空间构型为
CS2(g)+2H2S(g),CS2分子的空间构型为___________ ,用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单质硫,可实现废物利用,保护环境,写出其中一个反应的化学方程式___________ 。
(3)中国传统的农具、兵器曾大量使用铁,铁器的修复是文物保护的重要课题。铁器表面氧化层的成分有多种,性质如下:
在有氧条件下,Fe3O4在含Cl–溶液中会转化为FeOCl,将相关反应的离子方程式补充完整___________ ,4Fe3O4 +_____O2 +______ +_____H2O _____FeOCl +___________,若4mol Fe3O4完全转化为FeOCl,则转移的电子数目为
_____FeOCl +___________,若4mol Fe3O4完全转化为FeOCl,则转移的电子数目为___________ 。
(4)化学修复可以使FeOCl转化为Fe3O4致密保护层:用Na2SO3和NaOH混合溶液浸泡锈蚀的铁器,一段时间后取出,再用NaOH溶液反复洗涤。
①FeOCl在NaOH的作用下转变为FeO(OH),推测溶解度FeOCl___________ FeO(OH)(填“>”或“<”)。
② Na2SO3的作用是___________ 。
③ 检验FeOCl转化完全的操作和现象是___________ 。
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的最外层电子排布式为
| 金刚石 | 碳化硅 | 晶体硅 | |
| 熔点/℃ | >3550 | 2600 | 1415 |
金刚石熔点比晶体硅熔点高的原因是
(2)CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,发生反应2S2(g)+CH4(g)
 CS2(g)+2H2S(g),CS2分子的空间构型为
CS2(g)+2H2S(g),CS2分子的空间构型为(3)中国传统的农具、兵器曾大量使用铁,铁器的修复是文物保护的重要课题。铁器表面氧化层的成分有多种,性质如下:
| 成分 | Fe3O4 | FeO(OH) | FeOCl |
| 性质 | 致密 | 疏松 | 疏松 |
在有氧条件下,Fe3O4在含Cl–溶液中会转化为FeOCl,将相关反应的离子方程式补充完整
 _____FeOCl +___________,若4mol Fe3O4完全转化为FeOCl,则转移的电子数目为
_____FeOCl +___________,若4mol Fe3O4完全转化为FeOCl,则转移的电子数目为(4)化学修复可以使FeOCl转化为Fe3O4致密保护层:用Na2SO3和NaOH混合溶液浸泡锈蚀的铁器,一段时间后取出,再用NaOH溶液反复洗涤。
①FeOCl在NaOH的作用下转变为FeO(OH),推测溶解度FeOCl
② Na2SO3的作用是
③ 检验FeOCl转化完全的操作和现象是
您最近一年使用:0次



