名校
1 . 地球上的金属资源广泛地存在于地壳和海洋中,除金、银等少数很不活泼的金属主要以单质形式存在外,其余都以化合物的形式存在。高铁酸钾为紫色固体,极易溶于水,微溶于浓KOH溶液,难溶于有机溶剂;在酸性、中性溶液中易分解放出 ,在0∼5°C.强碱性溶液中较稳定。某兴趣小组利用如图所示装置(夹持、加热等装置略)制取
,在0∼5°C.强碱性溶液中较稳定。某兴趣小组利用如图所示装置(夹持、加热等装置略)制取 并探究其性质。回答下列问题:
并探究其性质。回答下列问题:
Ⅰ.制取

(1)仪器a的名称是___________ ,装置D的作用是___________ (用离子方程式表示)。
(2)装置C中反应的化学方程式为___________ 。
(3)装置C中反应为放热反应,控制反应温度在0~5℃的方法是___________ 。
Ⅱ.探究 性质。取装置C中紫色溶液,加入足量稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
性质。取装置C中紫色溶液,加入足量稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。
。
(4) 生成的可能原因:①
生成的可能原因:① 氧化
氧化 ;②
;②___________ (用离子方程式表示)。
为探究 产生的原因,设计以下方案:
产生的原因,设计以下方案:
由方案甲中溶液变红知溶液a中含有___________ (填离子符号),但该离子不一定是 将
将 氧化所得,还可能由
氧化所得,还可能由___________ 产生(用离子方程式表示)。方案乙可证明酸性条件下 氧化
氧化 产生
产生 。
。
(5)某铁的氧化物( )1.52 g溶于足量盐酸中,向所得溶液中通入标准状况下112 mL
)1.52 g溶于足量盐酸中,向所得溶液中通入标准状况下112 mL  ,恰好将
,恰好将 完全氧化,x值为
完全氧化,x值为___________ 。(需在答题纸上写出计算过程)
 ,在0∼5°C.强碱性溶液中较稳定。某兴趣小组利用如图所示装置(夹持、加热等装置略)制取
,在0∼5°C.强碱性溶液中较稳定。某兴趣小组利用如图所示装置(夹持、加热等装置略)制取 并探究其性质。回答下列问题:
并探究其性质。回答下列问题:Ⅰ.制取


(1)仪器a的名称是
(2)装置C中反应的化学方程式为
(3)装置C中反应为放热反应,控制反应温度在0~5℃的方法是
Ⅱ.探究
 性质。取装置C中紫色溶液,加入足量稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
性质。取装置C中紫色溶液,加入足量稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。
。(4)
 生成的可能原因:①
生成的可能原因:① 氧化
氧化 ;②
;②为探究
 产生的原因,设计以下方案:
产生的原因,设计以下方案:| 方案甲 | 取少量溶液a,滴加KSCN溶液至过量,溶液量红色 |
| 方案乙 | 用KOH浓溶液充分洗涤C中所得晶体,再用KOH稀溶液将 溶解,得紫色溶液b.取少量溶液b,滴加盐酸,有 溶解,得紫色溶液b.取少量溶液b,滴加盐酸,有 产生 产生 |
 将
将 氧化所得,还可能由
氧化所得,还可能由 氧化
氧化 产生
产生 。
。(5)某铁的氧化物(
 )1.52 g溶于足量盐酸中,向所得溶液中通入标准状况下112 mL
)1.52 g溶于足量盐酸中,向所得溶液中通入标准状况下112 mL  ,恰好将
,恰好将 完全氧化,x值为
完全氧化,x值为
您最近一年使用:0次
名校
2 . S2Cl2和SCl2均为重要的化工产品。
(1)二氯化二硫是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构如图所示。S2Cl2的结构式为______ ,其化学键类型有______ (填“极性键”或“非极性键”)。
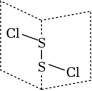
(2)S2Cl2中硫的化合价为______ ,S2Cl2分子中中心S原子的杂化轨道空间分布为______ ,S原子有______ 对孤电子对,S2Cl2是______ (填“极性”或“非极性”)分子。
(3)S2Cl2易发生水解反应,产生无色有刺激性气味的气体,同时生成淡黄色沉淀,该反应的化学方程式为______ 。
(4)实验室在111~140℃的温度下加热氯气和硫蒸气的混合物可制得S2Cl2,为检测所得物质中否纯净,某同学认为只要通过设计实验检测到有氯和硫两种元素存在,即可认为所得物质为纯净物的二氯化二硫。试从元素的价态分析并判断该同学的实验方案是否可行。______ 。
(1)二氯化二硫是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构如图所示。S2Cl2的结构式为

(2)S2Cl2中硫的化合价为
(3)S2Cl2易发生水解反应,产生无色有刺激性气味的气体,同时生成淡黄色沉淀,该反应的化学方程式为
(4)实验室在111~140℃的温度下加热氯气和硫蒸气的混合物可制得S2Cl2,为检测所得物质中否纯净,某同学认为只要通过设计实验检测到有氯和硫两种元素存在,即可认为所得物质为纯净物的二氯化二硫。试从元素的价态分析并判断该同学的实验方案是否可行。
您最近一年使用:0次
名校
3 .  是火箭燃料中常用氧化剂,
是火箭燃料中常用氧化剂, 是人体中一种传递神经信息的“信使分子”。
是人体中一种传递神经信息的“信使分子”。
(1)实验室常用一定浓度的硝酸制取 。65%的浓硝酸(密度为
。65%的浓硝酸(密度为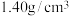 )的物质的量浓度是
)的物质的量浓度是___________ (写出计算过程,保留小数点后1位)。
(2)工业上在一定的温度和催化剂条件下可用 来消除
来消除 的污染,生成对环境无害的物质
的污染,生成对环境无害的物质 和
和 ,写出
,写出 与
与 的化学方程式:
的化学方程式:___________ 。
(3)清华大学有关研究表明, 时,
时, 能够被木炭、无烟煤、焦炭等碳质固体还原,还原率在99%左右。有关反应为:
能够被木炭、无烟煤、焦炭等碳质固体还原,还原率在99%左右。有关反应为: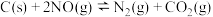 。在一恒温密闭容器中投入炭和
。在一恒温密闭容器中投入炭和 ,判断该反应达到平衡的标志是___________
,判断该反应达到平衡的标志是___________
 是火箭燃料中常用氧化剂,
是火箭燃料中常用氧化剂, 是人体中一种传递神经信息的“信使分子”。
是人体中一种传递神经信息的“信使分子”。(1)实验室常用一定浓度的硝酸制取
 。65%的浓硝酸(密度为
。65%的浓硝酸(密度为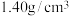 )的物质的量浓度是
)的物质的量浓度是(2)工业上在一定的温度和催化剂条件下可用
 来消除
来消除 的污染,生成对环境无害的物质
的污染,生成对环境无害的物质 和
和 ,写出
,写出 与
与 的化学方程式:
的化学方程式:(3)清华大学有关研究表明,
 时,
时, 能够被木炭、无烟煤、焦炭等碳质固体还原,还原率在99%左右。有关反应为:
能够被木炭、无烟煤、焦炭等碳质固体还原,还原率在99%左右。有关反应为: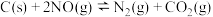 。在一恒温密闭容器中投入炭和
。在一恒温密闭容器中投入炭和 ,判断该反应达到平衡的标志是___________
,判断该反应达到平衡的标志是___________| A.容器内压强不再变化 | B.混合气体的平均相对分子质量不再变化 |
C. 和 和 的物质的量之比不再变化 的物质的量之比不再变化 | D.混合气体的密度不再变化 |
您最近一年使用:0次
名校
解题方法
4 . 叠氮化钠 是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置(下图)及实验步骤如下:
是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置(下图)及实验步骤如下:
①关闭止水夹 ,打开止水夹
,打开止水夹 ,开始通入氨气。
,开始通入氨气。
②加热装置(一)中的金属钠,使其熔化并充分反应生成 后,停止通入氨气并关闭止水夹
后,停止通入氨气并关闭止水夹 。
。
③向装置(一)中的b容器内充入加热介质,并加热到 ,然后打开止水夹
,然后打开止水夹 ,通入
,通入 发生反应。
发生反应。
④反应结束后,进行以下操作,得到 固体。
固体。
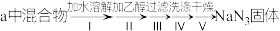
已知: 熔点
熔点 ,沸点
,沸点 ,在水溶液中易水解。
,在水溶液中易水解。
请回答下列问题:
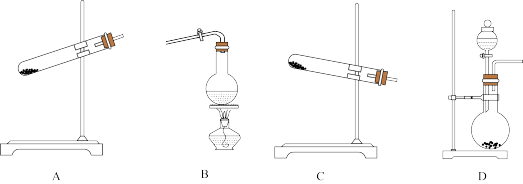
(1)制取氨气时的发生装置可选择上图中的___________ 装置(填字母符号)。
(2)图中仪器a用不锈钢材质而不用玻璃,其主要原因是___________ 。
(3)装置(二)的作用___________ 。
(4)步骤①中先通氨气的目的是___________ ;步骤③中最适宜的加热方式为___________ 。
(5)生成 的化学方程式为
的化学方程式为___________ 。
(6)步骤④中操作Ⅱ的目的是___________ 。操作Ⅳ最好选用的试剂是___________ 。
 是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置(下图)及实验步骤如下:
是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置(下图)及实验步骤如下:
①关闭止水夹
 ,打开止水夹
,打开止水夹 ,开始通入氨气。
,开始通入氨气。②加热装置(一)中的金属钠,使其熔化并充分反应生成
 后,停止通入氨气并关闭止水夹
后,停止通入氨气并关闭止水夹 。
。③向装置(一)中的b容器内充入加热介质,并加热到
 ,然后打开止水夹
,然后打开止水夹 ,通入
,通入 发生反应。
发生反应。④反应结束后,进行以下操作,得到
 固体。
固体。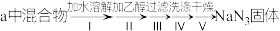
已知:
 熔点
熔点 ,沸点
,沸点 ,在水溶液中易水解。
,在水溶液中易水解。请回答下列问题:

(1)制取氨气时的发生装置可选择上图中的
(2)图中仪器a用不锈钢材质而不用玻璃,其主要原因是
(3)装置(二)的作用
(4)步骤①中先通氨气的目的是
(5)生成
 的化学方程式为
的化学方程式为(6)步骤④中操作Ⅱ的目的是
您最近一年使用:0次
2023-12-19更新
|
685次组卷
|
4卷引用:上海市宜川中学2023-2024学年高三上学期期末考试化学试题
上海市宜川中学2023-2024学年高三上学期期末考试化学试题2024届四川省自贡市普高高三上学期第一次诊断性考试理综试题(已下线)题型一 实验简答题答题规范-备战2024年高考化学答题技巧与模板构建(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
解题方法
5 . 为探索某工厂的废金属屑(主要成分为Fe、Cu、Al、Al2O3等)的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、胆矾晶体( )和水处理剂高铁酸钾(K2FeO4)。
)和水处理剂高铁酸钾(K2FeO4)。
(1)试剂X可以是___________。(填编号)
(2)试剂Y可以是___________。
(3)关于溶液D的说法正确的是___________。
(4)从CuSO4溶液中获取胆矾晶体的操作是___________ 、___________ 过滤、洗涤。
(5)从AlCl3溶液得到氯化铝固体时要加入适量的盐酸,结合化学用语解释原因___________ 。
(6)在步骤Ⅱ时,小组成员用下图装置进行试验,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,你的建议是___________ 。 对K2FeO4生成率有不同影响,由图可知工业生产中最佳条件(温度和
对K2FeO4生成率有不同影响,由图可知工业生产中最佳条件(温度和 的质量浓度)为___________。
的质量浓度)为___________。
(8)在固体F中加入稀硫酸和H2O2来制备CuSO4溶液是一种环保工艺,该反应的总的离子方程式为___________ 。
(9)高铁酸钾(K2FeO4)是一种环保、高效的水处理剂,它能氧化杀菌并能吸附水中悬浮的杂质,有关说法不正确的是___________。
(10)该小组同学取用100.0g该废金属屑,经过实验,最终得到胆矾晶体20.0g,该废料中铜的质量分数约为___________ 。
 )和水处理剂高铁酸钾(K2FeO4)。
)和水处理剂高铁酸钾(K2FeO4)。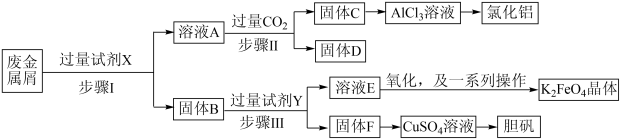
(1)试剂X可以是___________。(填编号)
| A.氨水 | B.氢氧化钠溶液 | C.盐酸 | D.硫酸 |
(2)试剂Y可以是___________。
| A.氨水 | B.氢氧化钠溶液 | C.盐酸 | D.硫酸 |
(3)关于溶液D的说法正确的是___________。
| A.含有碳酸氢钠溶质 |
| B.一定显碱性 |
C.存在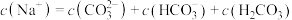 |
D.存在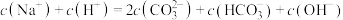 |
(4)从CuSO4溶液中获取胆矾晶体的操作是
(5)从AlCl3溶液得到氯化铝固体时要加入适量的盐酸,结合化学用语解释原因
(6)在步骤Ⅱ时,小组成员用下图装置进行试验,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,你的建议是
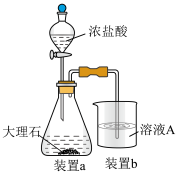
 对K2FeO4生成率有不同影响,由图可知工业生产中最佳条件(温度和
对K2FeO4生成率有不同影响,由图可知工业生产中最佳条件(温度和 的质量浓度)为___________。
的质量浓度)为___________。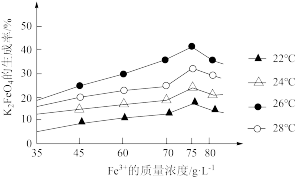
A.22℃, | B.24℃, |
C.26℃, | D.28℃, |
(8)在固体F中加入稀硫酸和H2O2来制备CuSO4溶液是一种环保工艺,该反应的总的离子方程式为
(9)高铁酸钾(K2FeO4)是一种环保、高效的水处理剂,它能氧化杀菌并能吸附水中悬浮的杂质,有关说法不正确的是___________。
| A.高铁酸钾的还原产物易水解形成胶体,可使水中悬浮物凝聚沉降 |
| B.高铁酸钾中含有离子键、极性共价键 |
C.1mol高铁酸钾生成胶粒数等于 |
| D.高铁酸钾中铁元素为+6价 |
(10)该小组同学取用100.0g该废金属屑,经过实验,最终得到胆矾晶体20.0g,该废料中铜的质量分数约为
您最近一年使用:0次
6 . 水是清洁、可持续的氢能来源。利用太阳能从水中获取氢气符合可持续发展的理念。“太阳能直接热分解水制氢”通过集中阳光产生2000K以上高温,促使 分解为
分解为 和
和 ;若温度进一步升高至5000K,
;若温度进一步升高至5000K, 与
与 会分解为气态原子。
会分解为气态原子。
(1) 分解过程中断裂的化学键属于
分解过程中断裂的化学键属于___________ 。
A.离子键 B.极性共价键 C.非极性共价键
(2)在相同条件下,同时存在如下两个过程:
i.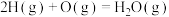 ii.
ii.
比较下列量的相对大小(均从选项中选择):①放出热量___________ ;②反应速率___________ 。
A.i>ii B.i=ii C.i<ii
“太阳能光催化分解水制氢”原理可以表示为: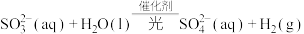 。
。
(3)已知 呈平面正三角形结构,推测
呈平面正三角形结构,推测 的立体构型为
的立体构型为___________ 。
A.平面正三角形 B.正四面体型 C.三角锥型
(4)能说明氯的非金属性比硫强的事实是___________。
(5) 与
与 结构相似,但
结构相似,但 的沸点高于
的沸点高于 ,原因是
,原因是___________ 。
(6)反应开始一段时间后,取出一定量溶液,写出检验溶液中 的操作方法:
的操作方法:________ 。
“太阳能热化学循环制氢”是将太阳能转化成化学能,通过多个化学过程产生 。如常见的铁氧化物循环制氢过程如图所示。
。如常见的铁氧化物循环制氢过程如图所示。
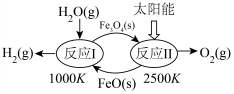
(7)写出反应I的化学方程式:___________ ;若该反应生成标准状况下 氢气,转移电子数目为
氢气,转移电子数目为___________ 。
(8)科学家想要用组成相似的钴氧化物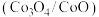 代替铁氧化物进行循环制氢。查阅资料发现,使用钴氧化物后反应I和反应II的
代替铁氧化物进行循环制氢。查阅资料发现,使用钴氧化物后反应I和反应II的 值随温度
值随温度 变化如图所示。
变化如图所示。
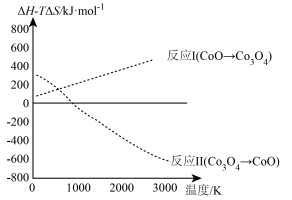
结合图像判断能否用钴氧化物代替铁氧化物进行热化学循环制氢?若可行,举出采用钴氧化物的一个优势;若不可行,说明理由___________ 。
(9)除了上述“直接热分解”、“光催化分解”和“热化学循环”外,请再设计一种利用太阳能从水中获取氢气的方法:___________ (简述即可,不必展开)。
 分解为
分解为 和
和 ;若温度进一步升高至5000K,
;若温度进一步升高至5000K, 与
与 会分解为气态原子。
会分解为气态原子。(1)
 分解过程中断裂的化学键属于
分解过程中断裂的化学键属于A.离子键 B.极性共价键 C.非极性共价键
(2)在相同条件下,同时存在如下两个过程:
i.
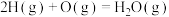 ii.
ii.
比较下列量的相对大小(均从选项中选择):①放出热量
A.i>ii B.i=ii C.i<ii
“太阳能光催化分解水制氢”原理可以表示为:
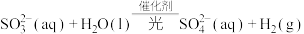 。
。(3)已知
 呈平面正三角形结构,推测
呈平面正三角形结构,推测 的立体构型为
的立体构型为A.平面正三角形 B.正四面体型 C.三角锥型
(4)能说明氯的非金属性比硫强的事实是___________。
A.溶解性: | B.氧化性: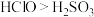 |
C.热稳定性: | D.酸性: |
(5)
 与
与 结构相似,但
结构相似,但 的沸点高于
的沸点高于 ,原因是
,原因是(6)反应开始一段时间后,取出一定量溶液,写出检验溶液中
 的操作方法:
的操作方法:“太阳能热化学循环制氢”是将太阳能转化成化学能,通过多个化学过程产生
 。如常见的铁氧化物循环制氢过程如图所示。
。如常见的铁氧化物循环制氢过程如图所示。
(7)写出反应I的化学方程式:
 氢气,转移电子数目为
氢气,转移电子数目为(8)科学家想要用组成相似的钴氧化物
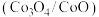 代替铁氧化物进行循环制氢。查阅资料发现,使用钴氧化物后反应I和反应II的
代替铁氧化物进行循环制氢。查阅资料发现,使用钴氧化物后反应I和反应II的 值随温度
值随温度 变化如图所示。
变化如图所示。
结合图像判断能否用钴氧化物代替铁氧化物进行热化学循环制氢?若可行,举出采用钴氧化物的一个优势;若不可行,说明理由
(9)除了上述“直接热分解”、“光催化分解”和“热化学循环”外,请再设计一种利用太阳能从水中获取氢气的方法:
您最近一年使用:0次
名校
解题方法
7 . Ⅰ.卤素单质及其化合物在社会生产、生活中有重要的应用。
(1)①卤素原子的最外层电子数相同,碘离子的电子式为___________ 。
②同温同压下,HBr气体和HI气体的体积比为1:2,则这两种气体的质量之比为___________ 。标准状况下, 氯气被足量石灰乳完全吸收,所制得的漂白粉中,有效成分的质量为
氯气被足量石灰乳完全吸收,所制得的漂白粉中,有效成分的质量为___________ 。
③漂白粉在使用过程中,吸收 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(2)卤素单质及化合物在许多性质上都存在着递变规律,下列有关说法中,正确的是___________。
Ⅱ.某同学设计了如图所示装置,进行实验。实验操作步骤如下:

①打开弹簧夹,缓缓通入氯气
②当a和b中的溶液都变为黄色时,夹紧弹簧夹。
③当a中溶液由黄色变为棕色时,停止通氯气。
④___________,取下试管c震荡,静置。
请回答:
(3)步骤②中反应的离子方程式为:___________ 。设计步骤③的实验目的是___________ 。
(4)步骤④横线上的操作是___________ 。
(5)从试管c中获得纯净的碘单质,需进行的操作步骤为___________ 。
(6)本实验的目的是:___________ 。
(1)①卤素原子的最外层电子数相同,碘离子的电子式为
②同温同压下,HBr气体和HI气体的体积比为1:2,则这两种气体的质量之比为
 氯气被足量石灰乳完全吸收,所制得的漂白粉中,有效成分的质量为
氯气被足量石灰乳完全吸收,所制得的漂白粉中,有效成分的质量为③漂白粉在使用过程中,吸收
 发生反应的化学方程式为
发生反应的化学方程式为(2)卤素单质及化合物在许多性质上都存在着递变规律,下列有关说法中,正确的是___________。
| A.卤化氢的热稳定性按HCl、HBr、HI的顺序依次增强 |
| B.卤化银的颜色按AgCl、AgBr、AgI的顺序依次加深 |
| C.卤化钠的还原性按NaCl、NaBr,NaI的顺序依次增强 |
D.卤素单质与氢气化合按 、 、 、 、 的顺序由难变易 的顺序由难变易 |
Ⅱ.某同学设计了如图所示装置,进行实验。实验操作步骤如下:

①打开弹簧夹,缓缓通入氯气
②当a和b中的溶液都变为黄色时,夹紧弹簧夹。
③当a中溶液由黄色变为棕色时,停止通氯气。
④___________,取下试管c震荡,静置。
请回答:
(3)步骤②中反应的离子方程式为:
(4)步骤④横线上的操作是
(5)从试管c中获得纯净的碘单质,需进行的操作步骤为
(6)本实验的目的是:
您最近一年使用:0次
解题方法
8 . (一)金属种类繁多,性质各异,应用十分广泛。
(1)将一小块金属钠分别放入下列溶液中,对应的现象正确的是_______
(2)少量Na2O2与H2O反应生成H2O2和NaOH。下列说法正确的是_______
(3)向某溶液中加入少量Na2O2后,原溶液中所含的下列离子浓度会显著改变的是_______
(二)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:(已知:室温下Ksp[Fe(OH)3]= 4.0×10-38)Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液;Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
(4)FeCl3蚀刻铜箔反应的离子方程式为___________ :过程Ⅰ分离得到固体的主要成分是___________ 。
(5)过程Ⅱ中发生反应的化学方程式为___________ ;过程Ⅱ中调节溶液的pH为5,最终溶液中金属离子浓度为___________ 。(列式计算)
(6)有同学研究上述“过程Ⅱ”方案后,设计了下列方案:向滤液中加入足量的NaOH溶液使Fe2+完全沉淀,过滤,小心加热沉淀直到水分蒸干,再灼烧到质量不再变化。假设现有200mL0.1mol·L-1FeCl2溶液,按照上述操作,理想情况下,该同学应该得到的固体质量为___________ ;通过比较,说明石灰水—空气法与氢氧化钠—加热法相比的一个优点是___________ 。
(1)将一小块金属钠分别放入下列溶液中,对应的现象正确的是_______
| A.饱和NaOH溶液:产生气体,恢复至室温后溶液的pH增大 |
| B.稀CuSO4溶液:产生气体,有紫红色物质析出 |
| C.MgCl2溶液:产生气体,生成白色沉淀 |
| D.NH4NO3溶液:产生无色无味气体 |
(2)少量Na2O2与H2O反应生成H2O2和NaOH。下列说法正确的是_______
A.Na2O2的电子式为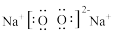 | B.H2O的空间构型为直线形 |
| C.H2O2中O元素的化合价为-1 | D.NaOH仅含离子键 |
(3)向某溶液中加入少量Na2O2后,原溶液中所含的下列离子浓度会显著改变的是_______
A.NO | B.NH | C.HCO | D.SO |
(二)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:(已知:室温下Ksp[Fe(OH)3]= 4.0×10-38)Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液;Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
(4)FeCl3蚀刻铜箔反应的离子方程式为
(5)过程Ⅱ中发生反应的化学方程式为
(6)有同学研究上述“过程Ⅱ”方案后,设计了下列方案:向滤液中加入足量的NaOH溶液使Fe2+完全沉淀,过滤,小心加热沉淀直到水分蒸干,再灼烧到质量不再变化。假设现有200mL0.1mol·L-1FeCl2溶液,按照上述操作,理想情况下,该同学应该得到的固体质量为
您最近一年使用:0次
9 . I.纳米氧化亚铜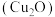 粒径在
粒径在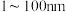 之间,是一种重要的无机化工原料,在涂料、有色玻璃和催化剂领域有着广泛的应用。
之间,是一种重要的无机化工原料,在涂料、有色玻璃和催化剂领域有着广泛的应用。
(1)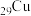 在元素周期表中的位置是第四周期
在元素周期表中的位置是第四周期___________ 族;
(2)基态铜原子的价电子排布式为___________。
(3)在普通玻璃中加入纳米 可制成红色玻璃。用光束照射该玻璃,在垂直方向上可以观察到
可制成红色玻璃。用光束照射该玻璃,在垂直方向上可以观察到___________ 。
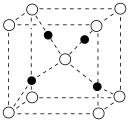
(4) 属于离子晶体,晶体结构如图所,图中●表示的微粒是___________。
属于离子晶体,晶体结构如图所,图中●表示的微粒是___________。
II. 溶于浓氨水中形成无色的
溶于浓氨水中形成无色的 ,该无色溶液接触空气会很快变成深蓝色。
,该无色溶液接触空气会很快变成深蓝色。
(5) 中
中 的N原子提供
的N原子提供___________ ,与中心离子形成___________ 。
A.空轨道、离子键 B.孤电子对、离子键
C.空轨道、配位键 D.孤电子对、配位键
(6)已知 分子中
分子中 键角为107°,则
键角为107°,则 中
中 键角___________。
键角___________。
(7)无色溶液在空气中变色的原因可表示如下,完成并配平该离子方程式________ (化学计量数若为1可不写)。
III.纳米 的制备方法有多种,常见的有还原法、电解法等。
的制备方法有多种,常见的有还原法、电解法等。
(8)还原法以葡萄糖作为主要原料。能用葡萄糖制备 是因为其分子中含有
是因为其分子中含有___________ (填官能团名称),制备时除了葡萄糖溶液与硫酸铜溶液外,还需要___________ (填试剂名称)。
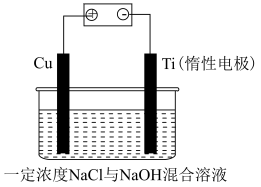
(9)电解法制备 的装置如图所示,电解过程中阳极依次发生反应:
的装置如图所示,电解过程中阳极依次发生反应:
①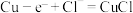
②
③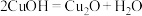
阴极的电极反应式为___________ ;该法制备 的总反应可以表示为:
的总反应可以表示为:___________ 。
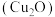 粒径在
粒径在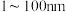 之间,是一种重要的无机化工原料,在涂料、有色玻璃和催化剂领域有着广泛的应用。
之间,是一种重要的无机化工原料,在涂料、有色玻璃和催化剂领域有着广泛的应用。(1)
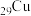 在元素周期表中的位置是第四周期
在元素周期表中的位置是第四周期(2)基态铜原子的价电子排布式为___________。
A. | B.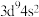 | C.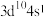 | D. |
(3)在普通玻璃中加入纳米
 可制成红色玻璃。用光束照射该玻璃,在垂直方向上可以观察到
可制成红色玻璃。用光束照射该玻璃,在垂直方向上可以观察到(4)
 属于离子晶体,晶体结构如图所,图中●表示的微粒是___________。
属于离子晶体,晶体结构如图所,图中●表示的微粒是___________。
A. | B. | C. | D. |
II.
 溶于浓氨水中形成无色的
溶于浓氨水中形成无色的 ,该无色溶液接触空气会很快变成深蓝色。
,该无色溶液接触空气会很快变成深蓝色。(5)
 中
中 的N原子提供
的N原子提供A.空轨道、离子键 B.孤电子对、离子键
C.空轨道、配位键 D.孤电子对、配位键
(6)已知
 分子中
分子中 键角为107°,则
键角为107°,则 中
中 键角___________。
键角___________。| A.大于107° | B.小于107° | C.等于107° | D.等于107° |
(7)无色溶液在空气中变色的原因可表示如下,完成并配平该离子方程式

III.纳米
 的制备方法有多种,常见的有还原法、电解法等。
的制备方法有多种,常见的有还原法、电解法等。(8)还原法以葡萄糖作为主要原料。能用葡萄糖制备
 是因为其分子中含有
是因为其分子中含有(9)电解法制备
 的装置如图所示,电解过程中阳极依次发生反应:
的装置如图所示,电解过程中阳极依次发生反应:
①
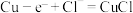
②

③
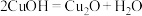
阴极的电极反应式为
 的总反应可以表示为:
的总反应可以表示为:
您最近一年使用:0次
名校
解题方法
10 . 高铁酸钾(K2FeO4)是兼具杀菌消毒和吸附絮凝功能的高效水处理剂。
(1) K2FeO4在处理污水时,与水体中的___________ 物质反应生成 。
。
A.氧化性 B.还原性
(2) 再水解生成
再水解生成 胶体,起到吸附絮凝作用,这与胶体的
胶体,起到吸附絮凝作用,这与胶体的___________ 有关。
A.丁达尔现象 B.电泳 C.聚沉
(一)电解法制备K2FeO4:
装置如图所示,原理为 。
。
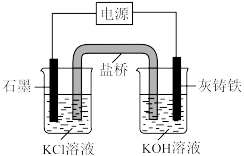
(3)灰铸铁材料作___________极。
(4)电解时,左侧烧杯中溶液的
___________ 。
A.升高 B.降低 C.不变
(5)写出电解时石墨电极反应式___________ 。
(二)水相法制备K2FeO4:
实验流程如下所示。
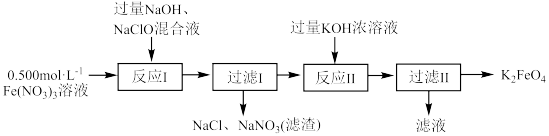
(6)实验室配制 溶液,不需要使用的玻璃仪器是___________。
溶液,不需要使用的玻璃仪器是___________。
(7)实验室制取 所需的两种原料为
所需的两种原料为___________ 、___________ 。
(8)写出反应I的化学方程式___________ 。
(9)简述反应Ⅱ能生成K2FeO4的原因___________ 。
(三) K2FeO4的纯度分析
水相法制备的K2FeO4产品纯度测定步骤如下:称取 产品配成
产品配成 溶液。取
溶液。取 置于锥形瓶,再加入足量
置于锥形瓶,再加入足量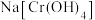 溶液,再加适量稀硫酸;最后用
溶液,再加适量稀硫酸;最后用 标准溶液滴定,终点时消耗标准溶液
标准溶液滴定,终点时消耗标准溶液 。主要反应如下:
。主要反应如下:



(10) 溶液通常用红色手柄的滴定管盛放,主要是由于其溶液显
溶液通常用红色手柄的滴定管盛放,主要是由于其溶液显___________ 。
A.酸性 B.碱性
(11)计算该K2FeO4产品纯度为___________ 。
(12)下列操作会使测定结果偏大的是___________。
(1) K2FeO4在处理污水时,与水体中的
 。
。A.氧化性 B.还原性
(2)
 再水解生成
再水解生成 胶体,起到吸附絮凝作用,这与胶体的
胶体,起到吸附絮凝作用,这与胶体的A.丁达尔现象 B.电泳 C.聚沉
(一)电解法制备K2FeO4:
装置如图所示,原理为
 。
。
(3)灰铸铁材料作___________极。
| A.正 | B.负 | C.阴 | D.阳 |
(4)电解时,左侧烧杯中溶液的

A.升高 B.降低 C.不变
(5)写出电解时石墨电极反应式
(二)水相法制备K2FeO4:
实验流程如下所示。

(6)实验室配制
 溶液,不需要使用的玻璃仪器是___________。
溶液,不需要使用的玻璃仪器是___________。| A.容量瓶 | B.玻璃棒 | C.胶头滴管 | D.量筒 |
(7)实验室制取
 所需的两种原料为
所需的两种原料为(8)写出反应I的化学方程式
(9)简述反应Ⅱ能生成K2FeO4的原因
(三) K2FeO4的纯度分析
水相法制备的K2FeO4产品纯度测定步骤如下:称取
 产品配成
产品配成 溶液。取
溶液。取 置于锥形瓶,再加入足量
置于锥形瓶,再加入足量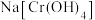 溶液,再加适量稀硫酸;最后用
溶液,再加适量稀硫酸;最后用 标准溶液滴定,终点时消耗标准溶液
标准溶液滴定,终点时消耗标准溶液 。主要反应如下:
。主要反应如下:


(10)
 溶液通常用红色手柄的滴定管盛放,主要是由于其溶液显
溶液通常用红色手柄的滴定管盛放,主要是由于其溶液显A.酸性 B.碱性
(11)计算该K2FeO4产品纯度为
(12)下列操作会使测定结果偏大的是___________。
| A.配制 K2FeO4溶液定容时,仰视容量瓶刻度线 |
| B.盛放K2FeO4溶液的锥形瓶未干燥 |
C.盛放 标准溶液的滴定管未润洗 标准溶液的滴定管未润洗 |
| D.终点读数时,俯视滴定管刻度线 |
您最近一年使用:0次



